Конъюгированная кислота - Conjugate acid
А конъюгированная кислота, в пределах Кислотно-основная теория Бренстеда – Лоури, представляет собой химическое соединение, образующееся, когда кислота жертвует протон (ЧАС+ ) к основание - другими словами, это база с водород к нему добавляется ион, так как в обратной реакции он теряет ион водорода. С другой стороны, сопряженное основание это то, что остается после того, как кислота отдала протон во время химической реакции. Следовательно, сопряженное основание - это вид, образованный удаление протона из кислоты, так как в обратной реакции он может получить ион водорода.[1] Потому что некоторые кислоты способны высвобождать несколько протонов, сопряженное основание кислоты может само быть кислотным.
Таким образом, это можно представить как следующую химическую реакцию:
- Кислота + Основание ⇌ Конъюгат Основа + Конъюгат Кислота


Йоханнес Николаус Бронстед и Мартин Лоури представил теорию Бренстеда – Лоури, согласно которой любое соединение, которое может переносить протон на любое другое соединение, является кислотой, а соединение, которое принимает протон, является основанием. Протон - это ядерная частица с единичным положительным электрическим зарядом; обозначается символом H+ потому что он составляет ядро водорода атом,[2] это катион водорода.
А катион может быть конъюгированной кислотой и анион может быть сопряженным основанием, в зависимости от которого вещество участвует и который кислотно-основная теория это точка зрения. Простейшим анионом, который может быть сопряженным основанием, является сольватированный электрон сопряженная кислота которого представляет собой атомарный водород.
Кислотно-основные реакции
В кислотно-основная реакция, кислота плюс основание реагирует с образованием конъюгата основания и конъюгированной кислоты:
Конъюгаты образуются, когда кислота теряет протон водорода или основание приобретает протон водорода. См. Следующий рисунок:
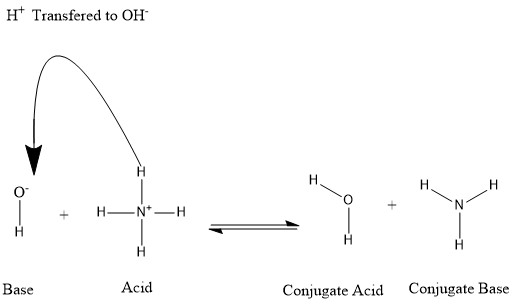
Мы говорим, что молекула воды представляет собой сопряженную кислоту гидроксид-иона после того, как последний получил протон водорода, подаренный им. аммоний. С другой стороны, аммиак представляет собой сопряженное основание для кислого аммония после того, как аммоний отдал ион водорода в сторону образования молекулы воды. Мы также можем назвать OH- сопряженным основанием ЧАС
2О, поскольку молекула воды отдает протон на образование NH+
4 в обратной реакции, которая является преобладающим процессом в природе из-за прочности основания NH
3 над гидроксид-ионом. На основании этой информации становится ясно, что термины «кислота», «основание», «конъюгированная кислота» и «конъюгированное основание» не являются фиксированными для определенных химических веществ; но взаимозаменяемы в зависимости от протекающей реакции.
Сила конъюгатов
Сила конъюгированной кислоты прямо пропорциональна ее константа диссоциации. Если конъюгированная кислота сильная, ее диссоциация будет иметь более высокий константа равновесия и продукты реакции будут предпочтительнее. Силу сопряженного основания можно рассматривать как тенденцию разновидностей «притягивать» протоны водорода к себе. Если сопряженное основание классифицируется как сильное, оно будет «удерживать» протон водорода, когда находится в растворе, и его кислота не будет диссоциировать.
Если разновидность классифицируется как сильная кислота, его сопряженное основание будет слабым.[3] Примером этого случая может быть диссоциация соляная кислота HCl в воде. Поскольку HCl - сильная кислота (в значительной степени диссоциирует), ее сопряженное основание (Cl−
) будет слабой сопряженной базой. Следовательно, в этой системе большинство ЧАС+
будет в виде гидроксоний ион ЧАС
3О+
вместо прикрепления к Cl− анион и сопряженное основание будут слабее молекулы воды.
С другой стороны, если вид классифицируется как слабая кислота, его сопряженное основание не обязательно будет сильным основанием. Учтите, что ацетат, сопряженное основание уксусной кислоты, имеет константу диссоциации основания (Kb) приблизительно 5,6х10−10, что делает его слабой базой. Для того, чтобы у вида было сильное сопряженное основание, оно должно быть очень слабой кислотой, например, такой как вода.
Идентификация конъюгированных кислотно-основных пар
Кислота и конъюгат основания, а также основание и конъюгированная кислота известны как пары конъюгатов. При обнаружении конъюгированной кислоты или основания важно смотреть на реагенты из химическое уравнение. В этом случае реагентами являются кислоты и основания, а кислота соответствует сопряженному основанию на стороне продукта химического уравнения; как и основание для конъюгированной кислоты на стороне продукта уравнения.
Чтобы идентифицировать конъюгированную кислоту, поищите пару связанных соединений. В кислотно-основная реакция можно рассматривать в смысле до и после. Передняя часть уравнения представляет собой реагент, а вторая часть уравнения - продукт. Конъюгированная кислота в конечной части уравнения приобретает ион водорода, поэтому в передней части уравнения соединение, которое имеет на один ион водорода меньше, чем сопряженная кислота, является основанием. Основание конъюгата в задней части уравнения потеряло ион водорода, поэтому в передней части уравнения соединение, которое имеет еще один ион водорода конъюгированного основания, является кислотой.
Рассмотрим следующую кислотно-щелочную реакцию:
- HNO
3 + ЧАС
2О → ЧАС
3О+
+ НЕТ−
3
Азотная кислота (HNO
3) является кислота потому что он отдает протон молекуле воды и ее сопряженное основание является нитрат (НЕТ−
3). Молекула воды действует как основание, потому что она принимает протон водорода, а его сопряженная кислота является гидроксоний ион (ЧАС
3О+
).
| Уравнение | Кислота | Основание | Основание конъюгата | Конъюгированная кислота |
|---|---|---|---|---|
| HClO 2 + ЧАС 2О → ClO− 2 + ЧАС 3О+ | HClO 2 | ЧАС 2О | ClO− 2 | ЧАС 3О+ |
| ClO− + ЧАС 2О → HClO + ОЙ− | ЧАС 2О | ClO− | ОЙ− | HClO |
| HCl + ЧАС 2PO− 4 → Cl− + ЧАС 3PO 4 | HCl | ЧАС 2PO− 4 | Cl− | ЧАС 3PO 4 |
Приложения
Одно из применений конъюгированных кислот и оснований заключается в буферных системах, которые включают буферный раствор. В буфере используется слабая кислота и ее конъюгированная основа (в форме соли) или слабое основание и ее конъюгированная кислота, чтобы ограничить изменение pH во время процесса титрования. Буферы имеют как органические, так и неорганические химические применения. Например, помимо буферов, используемых в лабораторных процессах, наша кровь действует как буфер для поддержания pH. Самый важный буфер в нашем кровотоке - это угольная кислота-бикарбонатный буфер, что предотвращает резкие изменения pH при CO
2 вводится. Это функционирует как таковое:
Кроме того, вот таблица общих буферов.
Буферный агент pKа Полезный диапазон pH Лимонная кислота 3.13, 4.76, 6.40 2.1 - 7.4 Уксусная кислота 4.8 3.8 - 5.8 KH2PO4, 7.2 6.2 - 8.2 CHES 9.3 8.3–10.3 Борат 9.24 8.25 - 10.25
Вторым распространенным применением органического соединения может быть создание буфера с уксусной кислотой. Если уксусная кислота, слабая кислота с формулой CH
3COOH, был превращен в буферный раствор, его необходимо было объединить с его конъюгированным основанием CH
3COO−
в виде соли. Полученная смесь называется ацетатным буфером, состоящим из водной CH
3COOH и водный CH
3COONa. Уксусная кислота, наряду со многими другими слабыми кислотами, служат полезными компонентами буферов в различных лабораторных условиях, каждая из которых полезна в пределах своего собственного диапазона pH.
Примером неорганического соединения может быть медицинское использование конъюгата основания молочной кислоты, известного как лактат в Раствор Рингера с лактатом и Решение Хартмана. Молочная кислота имеет формулу C
3ЧАС
6О
6 и его конъюгатное основание используется во внутривенных жидкостях, которые состоят из катионов натрия и калия, а также лактатных и хлоридных анионов в растворе с дистиллированной водой. Эти жидкости обычно изотоничны по отношению к человеческой крови и обычно используются для повышения уровня жидкости в системе после тяжелой кровопотери из-за травмы, операции или ожога.
Таблица кислот и их сопряженных оснований
В таблице ниже приведены несколько примеров кислот и их сопряженных оснований; обратите внимание, как они отличаются всего на один протон (H+ ион). Сила кислоты уменьшается, а прочность конъюгированного основания увеличивается вниз по таблице.
| Кислота | Основание конъюгата |
|---|---|
| ЧАС 2F+ Флуороний ион | HF Фтористый водород |
| HCl Соляная кислота | Cl− Хлористый ион |
| ЧАС2ТАК4 Серная кислота | HSO− 4 Сероводород ион |
| HNO3 Азотная кислота | НЕТ− 3 Нитрат ион |
| ЧАС3О+ Гидроний ион | ЧАС2О Вода |
| HSO− 4 Сероводород ион | ТАК2− 4 Сульфат ион |
| ЧАС3PO4 Фосфорная кислота | ЧАС2PO− 4 Дигидрофосфат ион |
| CH3COOH Уксусная кислота | CH3COO− Ацетат ион |
| HF Плавиковая кислота | F− Фторид ион |
| ЧАС2CO3 Угольная кислота | HCO− 3 Карбонат водорода ион |
| ЧАС2S Сероводородная кислота | HS− Сероводород ион |
| ЧАС2PO− 4 Дигидрофосфат ион | HPO2− 4 Фосфат водорода ион |
| NH+ 4 Аммоний ион | NH3 Аммиак |
| ЧАС2О Вода (pH =7) | ОЙ− Гидроксид ион |
| HCO− 3 Гидрокарбонат (бикарбонат) ион | CO2− 3 Карбонат ион |
Таблица оснований и их сопряженных кислот
Напротив, вот таблица оснований и их сопряженных кислот. Точно так же сила основания уменьшается, а сила конъюгированной кислоты увеличивается вниз по таблице.
| Основание | Конъюгированная кислота |
|---|---|
| C 2ЧАС 5NH 2 Этиламин | C 2ЧАС 5NH+ 3 Ион этиламмония |
| CH 3NH 2 Метиламин | CH 3NH+ 3 Метиламмоний ион |
| NH 3 Аммиак | NH+ 4 Аммоний ион |
| C 5ЧАС 5N Пиридин | C 5ЧАС 6N+ Пиридиний |
| C 6ЧАС 5NH 2 Анилин | C 6ЧАС 5NH+ 3 Ион фениламмония |
| C 6ЧАС 5CO− 2 Бензоат-ион | C 6ЧАС 6CO 2 Бензойная кислота |
| F− Фторид ион | HF Фтористый водород |
| PO3− 4 Фосфат ион | HPO2− 4 Фосфат водорода ион |
| ОЙ− Гидроксид ион | ЧАС2О Вода (нейтральный, pH 7) |
Смотрите также
Рекомендации
- ^ Зумдал, Стивен С. и Зумдал, Сьюзан А. Химия. Хоутон Миффлин, 2007 год, ISBN 0618713700
- ^ "Теория Бренстеда – Лоури | химия". Энциклопедия Британника. Получено 2020-02-25.
- ^ "Учебное пособие по химии конъюгированных кислот и оснований". www.ausetute.com.au. Получено 2020-02-25.


