Самоионизация воды - Self-ionization of water

В самоионизация воды (также автоионизация воды, и автодиссоциация воды) является ионизация реакция в чистая вода или в водный раствор, в котором молекула воды H2О, депротонирует (теряет ядро одного из своих атомов водорода), чтобы стать гидроксид ион, ОН−. В ядро водорода, H+, немедленно протонирует еще одна молекула воды для образования гидроксоний, H3О+. Это пример автопротолиз, и является примером амфотерный природа воды.
Константа равновесия

Химически чистая вода имеет электрические проводимость 0,055 мкмS /см. Согласно теории Сванте Аррениус, это должно быть из-за наличия ионов. Ионы образуются в результате реакции самоионизации воды, которая применима к чистой воде и любому водному раствору:
- ЧАС2O + H2O ⇌ H3О+ + ОН−
Выражено химическая деятельность авместо концентраций термодинамическая константа равновесия для реакции ионизации воды составляет:
которая численно равна более традиционной константе термодинамического равновесия, записанной как:
в предположении, что сумма химических потенциалов H+ и H3О+ формально равна удвоенному химическому потенциалу H2O при той же температуре и давлении.[1]
Поскольку большинство кислотно-основных растворов обычно очень разбавлены, активность воды обычно приближается к единице, что позволяет выразить ионный продукт воды как:[2]
В разбавленных водных растворах активность частиц растворенного вещества примерно равна их концентрации. Таким образом константа ионизации, константа диссоциации, константа самоионизации, постоянная продукта иона воды или же ионный продукт воды, символизируемой Kш, может быть выдан:
где [H3О+] это молярность (≈молярная концентрация )[3] водорода или ион гидроксония, и [OH−] - концентрация гидроксид ион. Когда константа равновесия записывается как произведение концентраций (в отличие от активности), необходимо внести поправки в значение в зависимости от ионная сила и другие факторы (см. ниже).[4]
При 25 ° C и нулевой ионной силе Kш равно 1.0×10−14. Обратите внимание, что, как и в случае со всеми константами равновесия, результат безразмерен, потому что концентрация фактически является концентрацией относительно стандартное состояние, что для H+ и ОН− оба определены как 1 моль (или молярный). Для большинства практических целей молярные и молярные концентрации равны вблизи температуры и давления окружающей среды. Шкала молярной концентрации дает значения концентрации, которые учитывают изменения плотности при изменении температуры или давления; следовательно, это шкала, используемая в точных или некоммерческих приложениях, например, для морская вода,[3] или при повышенных температурах, как на тепловых электростанциях.
Мы также можем определить pKш −log10 Kш (что составляет примерно 14 при 25 ° C). Это аналогично обозначениям pH и pKа для константа диссоциации кислоты, где символ p обозначает одеколон. Логарифмическая форма уравнения константы равновесия pKш = pH + pOH.
Зависимость от температуры, давления и ионной силы
 Температурная зависимость константы ионизации воды при 25 МПа | 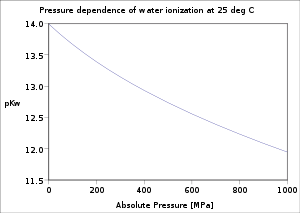 Зависимость константы ионизации воды от давления при 25 ° C |  Вариация pKш с ионной силой растворов NaCl при 25 ° C |
Зависимость ионизации воды от температуры и давления тщательно исследована.[5] Значение pKш уменьшается по мере увеличения температуры от точки плавления льда до минимума в c. 250 ° C, после чего увеличивается до критическая точка воды c. 374 ° С. Он уменьшается с увеличением давления.
| Температура | Давление[7] | пKш |
|---|---|---|
| 0 ° C | 0,10 МПа | 14.95 |
| 25 ° C | 0,10 МПа | 13.99 |
| 50 ° С | 0,10 МПа | 13.26 |
| 75 ° С | 0,10 МПа | 12.70 |
| 100 ° C | 0,10 МПа | 12.25 |
| 150 ° С | 0,47 МПа | 11.64 |
| 200 ° С | 1,5 МПа | 11.31 |
| 250 ° С | 4,0 МПа | 11.20 |
| 300 ° С | 8,7 МПа | 11.34 |
| 350 ° С | 17 МПа | 11.92 |
С электролит решений, значение pKш зависит от ионная сила электролита. Ценности для хлорид натрия типичны для электролита 1: 1. С электролитами 1: 2, MX2, пKш уменьшается с увеличением ионной силы.[8]
Значение Kш обычно представляет интерес жидкая фаза. Примеры значений для перегретый пар (газ) и сверхкритическая вода жидкости приведены в таблице.
Сравнение pKш значения для жидкой воды, перегретого пара и сверхкритической воды.[1] Темп.Давление350 ° С 400 ° С 450 ° С 500 ° С 600 ° С 800 ° С 0,1 МПа 47.961б 47.873б 47.638б 46.384б 40.785б 17 МПа 11,920 (жидкость)а 25 МПа 11,551 (жидкость)c 16.566 18.135 18.758 19.425 20.113 100 МПа 10.600 (жидкость)c 10.744 11.005 11.381 12.296 13.544 1000 МПа 8,311 (жидкость)c 8.178 8.084 8.019 7.952 7.957
- Примечания к таблице. Значения приведены для сверхкритической жидкости, кроме отмеченных: а при давлении насыщения, соответствующем 350 ° C. б перегретый пар. c сжатая или недогретая жидкость.
Изотопные эффекты
Тяжелая вода, D2O, самоионизируется меньше, чем обычная вода, H2О;
- D2O + D2O ⇌ D3О+ + OD−
Это связано с равновесный изотопный эффект, квантово-механический эффект, приписываемый кислороду, образуя немного более прочную связь с дейтерий потому что большая масса дейтерия приводит к меньшему энергия нулевой точки.
Выражено деятельностью а, вместо концентраций термодинамическая константа равновесия для реакции ионизации тяжелой воды равна:
Предполагая, что активность D2O равным 1, и если предположить, что деятельность D3О+ и OD− близки по их концентрации
В следующей таблице сравниваются значения pKш для ч2O и D2О.[9]
пKш значения для чистой воды Т / ° C 10 20 25 30 40 50 ЧАС2О 14.535 14.167 13.997 13.830 13.535 13.262 D2О 15.439 15.049 14.869 14.699 14.385 14.103
Ионизационные равновесия в смесях вода – тяжелая вода.
В равновесии смесей вода – тяжелая вода участвуют несколько видов: H2О, HDO, D2ОЙ3О+, D3О+, H2ДЕЛАТЬ+, HD2О+, HO−, ДЕЛАТЬ−.
Механизм
В скорость реакции для реакции ионизации
- 2 ч2O → H3О+ + ОН−
зависит от энергия активации, ΔE‡. Согласно Распределение Больцмана доля молекул воды, обладающих достаточной энергией из-за тепловой заселенности, определяется выражением
куда k это Постоянная Больцмана. Таким образом, некоторая диссоциация может происходить из-за наличия достаточной тепловой энергии. Следующая последовательность событий была предложена на основе электрическое поле колебания жидкой воды.[10] Случайные колебания молекулярных движений время от времени (примерно раз в 10 часов на молекулу воды[11]) создают электрическое поле, достаточно сильное, чтобы разорвать кислородно-водородную связь, в результате чего образуется гидроксид (OH−) и ион гидроксония (H3О+); ядро водорода иона гидроксония движется вдоль молекул воды по Механизм Grotthuss и изменение водородная связь сетка в растворителе изолирует два иона, которые стабилизируются путем сольватации. В пределах 1пикосекунда однако вторая реорганизация сети водородных связей позволяет быстро переносить протоны вниз по разности электрических потенциалов и последующую рекомбинацию ионов. Этот временной масштаб соответствует времени, которое требуется водородным связям для переориентации в воде.[12][13][14]
Обратная реакция рекомбинации
- ЧАС3О+ + ОН− → 2 H2О
является одной из самых быстрых известных химических реакций, с константа скорости реакции из 1.3×1011 M−1 s−1 при комнатной температуре. Такая высокая скорость характерна для реакция, управляемая диффузией, в котором скорость ограничена скоростью молекулярного распространение.[15]
Связь с нейтральной точкой воды
Молекулы воды распадаются на равные количества H3О+ и ОН−, поэтому их концентрации равны 1.00×10−7 моль дм−3 при 25 ° С. Решение, в котором H3О+ и ОН− равные друг другу концентрации считаются нейтральный решение. Как правило, pH нейтральной точки численно равен 1/2пKш.
Чистая вода нейтральна, но большинство проб воды содержат примеси. Если примесь кислота или же основание, это повлияет на концентрацию иона гидроксония и иона гидроксида. Образцы воды, находящиеся на воздухе, поглощают углекислый газ с образованием угольной кислоты (H2CO3) и концентрации H3О+ увеличится за счет реакции H2CO3 + H2O = HCO3− + H3О+. Концентрация ОН− уменьшится так, что произведение [H3О+][ОЙ−] остается постоянным при фиксированных температуре и давлении. Таким образом, эти образцы воды будут слегка кислыми. Если требуется ровно 7,0 pH, его следует поддерживать с помощью подходящих буферный раствор.
Смотрите также
- Кислотно-основная реакция
- Химическое равновесие
- Молекулярная автоионизация (из различных растворителей)
- Стандартный водородный электрод
Рекомендации
- ^ а б "Выпуск на константу ионизации H2O " (PDF). Люцерн: Международная ассоциация свойств воды и пара. Август 2007 г.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "константа автопротолиза ". Дои:10.1351 / goldbook.A00532
- ^ а б Штумм, Вернер; Морган, Джеймс (1996). Водная химия. Химические равновесия и скорости в природных водах (3-е изд.). John Wiley & Sons, Inc. ISBN 9780471511847.
- ^ Harned, H.S .; Оуэн, Б. Б. (1958). Физическая химия электролитических растворов. (3-е изд.). Нью-Йорк: Рейнхольд. стр.635.
- ^ Международная ассоциация свойств воды и пара (IAPWS)
- ^ Бандура, Андрей В .; Львов, Сергей Н. (2006). «Константа ионизации воды в широком диапазоне температур и плотности» (PDF). Журнал физических и химических справочных данных. 35 (1): 15–30. Bibcode:2006JPCRD..35 ... 15B. Дои:10.1063/1.1928231.
- ^ 0,1 МПа для Т <100 ° С. Давление насыщения за Т > 100 ° С.
- ^ Harned, H.S .; Оуэн, Б. Б. (1958). Физическая химия электролитических растворов. (3-е изд.). Нью-Йорк: Рейнхольд. стр.634 –649, 752–754.
- ^ Лиде, Д. Р., изд. (1990). CRC Справочник по химии и физике (70-е изд.). Бока-Ратон (Флорида): CRC Press.
- ^ Geissler, P.L .; Dellago, C .; Chandler, D .; Hutter, J .; Парринелло, М. (2001). «Автоионизация в жидкой воде». Наука. 291 (5511): 2121–2124. Bibcode:2001Sci ... 291.2121G. CiteSeerX 10.1.1.6.4964. Дои:10.1126 / science.1056991. PMID 11251111.
- ^ Эйген, М .; Де Майер, Л. (1955). "Untersuchungen über die Kinetik der Neutralization I" [Исследования кинетики нейтрализации I]. Z. Elektrochem. 59: 986.
- ^ Стиллинджер, Ф. Х. (1975). Теория и молекулярные модели воды. Adv. Chem. Phys. Успехи химической физики. 31. С. 1–101. Дои:10.1002 / 9780470143834.ch1. ISBN 9780470143834.
- ^ Рапапорт, Д. К. (1983). «Водородные связи в воде». Мол. Phys. 50 (5): 1151–1162. Bibcode:1983МолФ..50.1151Р. Дои:10.1080/00268978300102931.
- ^ Chen, S.-H .; Тейшейра, Дж. (1986). Структура и динамика низкотемпературной воды с помощью методов рассеяния. Adv. Chem. Phys. Успехи химической физики. 64. С. 1–45. Дои:10.1002 / 9780470142882.ch1. ISBN 9780470142882.
- ^ Tinoco, I .; Sauer, K .; Ван, Дж. К. (1995). Физическая химия: принципы и приложения в биологических науках (3-е изд.). Прентис-Холл. п. 386.
внешняя ссылка
- Общая химия - Автоионизация воды





![K _ {{{ rm {w}}}} = [{{ rm {{H_ {3} O ^ {+}}}}] [{{ rm {{OH ^ {-}}}}} ]](https://wikimedia.org/api/rest_v1/media/math/render/svg/86dca39006c4f875cacc14395c7ff6e38a09d990)



![K _ {{{ rm {w}}}} = [{{ rm {{D_ {3} O ^ {+}}}}}] [{{ rm {{OD ^ {-}}}}} ]](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d7bac103d47e7740413a796f0347b2bf98fda2c)
