Продигиозин - Prodigiosin
 | |
| Имена | |
|---|---|
| Название ИЮПАК 4-Метокси-5 - [(Z) - (5-метил-4-пентил-2ЧАС-пиррол-2-илиден) метил] -1ЧАС,1′ЧАС-2,2′-бипиррол | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| MeSH | Продигиозин |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C20ЧАС25N3О | |
| Молярная масса | 323.440 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Продигиозин красный пигмент, производимый многими штаммами бактерий. Serratia marcescens,[1] а также других грамотрицательных, гамма-протеобактерий, таких как Вибрион психроэритрус и Хахелла Chejuensis.[2] Он отвечает за розовый оттенок, который иногда встречается в грязи, которая накапливается на фарфоровых поверхностях, таких как ванны, раковины и унитазы. Это в вундеркинды семейство соединений, которые продуцируются некоторыми грамотрицательными гамма-протеобактериями, а также некоторыми грамположительными актинобактериями (например, Streptomyces однотонный).[2] Название продигиозин происходит от потрясающий (т.е. что-то чудесное).
Вторичный метаболит
Продигиозин - вторичный метаболит Serratia marcescens. Поскольку его легко обнаружить, его использовали в качестве модельной системы для изучения вторичного метаболизма. Давно известно, что производство продигиозина увеличивается за счет ограничения фосфата. Было показано, что в условиях низкого содержания фосфата пигментированные штаммы вырастают до более высокой плотности, чем непигментированные штаммы.[3]
Религиозная функция
Способность пигментированных штаммов Serratia marcescens расти на хлеб привело к возможному объяснению Средневековый чудеса пресуществления, в которых Евхаристический хлеб превращается в Тело Христа. Такой чудеса привело к Папа Урбан IV создание Праздник Корпус-Кристи в 1264 году. Масса в Больсена в 1263 г. во главе с Богемный священник, который сомневался в пресуществление. Во время мессы казалось, что евхаристия истекает кровью, и каждый раз, когда священник вытирал кровь, появлялось больше. Это событие отмечается в фреска в Папском дворце в Ватикан, нарисовано Рафаэль.[4]
Биологическая активность
Продигиозин получил новое внимание[2][5] за широкий спектр биологической активности, в том числе противомалярийное,[6] противогрибковый,[7] иммунодепрессант,[8] и антибиотики.[9] Возможно, он наиболее известен своей способностью запускать апоптоз злокачественных раковых клеток. Точный механизм этого ингибирования очень сложен и до конца не выяснен, но может включать в себя несколько процессов, включая ингибирование фосфатазы, опосредованное медью расщепление двухцепочечной ДНК или нарушение градиента pH посредством трансмембранного транспорта ионов H + и Cl-.[10] В результате продигиозин является очень многообещающим лекарственным средством и в настоящее время проходит доклинические исследования для лечения рака поджелудочной железы.[11]Недавно было обнаружено, что продигиозин обладает отличной активностью против стационарная фаза Borrelia burgdorferi, возбудитель Болезнь Лайма.[12]
Биосинтез
Эта секция отсутствует информация о конкретных ферментах / оперонах (попробуйте Williamson). (Апрель 2019) |

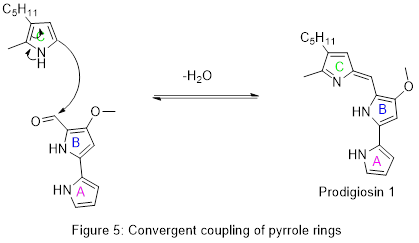
Биосинтез продигиозина[13][14] включает конвергентное связывание трех колец пиррольного типа (обозначенных A, B и C на рисунке 1) из L-пролина, L-серина, L-метионина, пирувата и 2-октенала.
Кольцо A синтезируется из L-пролина через путь нерибосомальной пептид-синтазы (NRPS) (рисунок 2), где пирролидиновое кольцо пролина окисляется дважды через FAD + с образованием пиррольного кольца A.

Затем кольцо A расширяется по пути поликетидсинтазы, чтобы включить L-серин в кольцо B (рис. 3). Фрагмент кольца А переносится от белка-носителя пептидила (PCP) к белку-носителю ацила (ACP) с помощью домена KS с последующим переносом на малонил-ACP посредством декарбоксилатной конденсации Клайзена. Затем этот фрагмент способен реагировать с замаскированным карбанионом, образованным в результате PLP-опосредованного декарбоксилирования L-серина, который циклизуется в реакции дегидратации с образованием второго пиррольного кольца. Затем этот промежуточный продукт модифицируют метилированием (которое включает метильную группу из L-метионина на спирт в положении 6) и окислением первичного спирта до альдегида с получением кольцевой структуры ядра A-B.

Кольцо C образуется в результате декарбоксилирующего присоединения пирувата к 2-октеналю, опосредованного TPP, с последующей реакцией с PLP с образованием амина для внутримолекулярной конденсации. Окисление образовавшегося кольца дает окончательное пиррольное кольцо C.

Наконец, эти две части сшиваются вместе в результате реакции дегидратации, вызванной установлением конъюгированной системы на всех трех кольцах. Это завершает конвергентный синтез натурального продукта.
Смотрите также
- Обатоклакс, экспериментальный препарат с близкой химической структурой
Рекомендации
- ^ Беннетт Дж. У., Бентли Р. (2000). «Увидеть красный: история продигиозина». Adv Appl Microbiol. Успехи прикладной микробиологии. 47: 1–32. Дои:10.1016 / S0065-2164 (00) 47000-0. ISBN 9780120026470. PMID 12876793.
- ^ а б c Уильямсон Н.Р., Файнран ПК, Гриствуд Т., Липер Ф.Дж., Салмонд Г.П. (2006). «Биосинтез и регуляция производных бактерий». Обзоры природы Микробиология. 4 (12): 887–899. Дои:10.1038 / nrmicro1531. PMID 17109029. S2CID 11649828.
- ^ М. Тодд-Гуай и П.Х. Демчик. 1995. Роль продигиозина в недостаточности фосфатов. Serratia marcescens. Резюме ежегодного собрания Американского общества микробиологов.
- ^ "Месса в Больсене Рафаэля". Музеи Ватикана. Получено 2017-08-18.
- ^ Уильямсон Н.Р., Файнран ПК, Гриствуд Т., Чаврай С.Р., Липер Ф.Дж., Салмонд Г.П. (2007). «Противораковые и иммунодепрессивные свойства продигининов бактерий». Будущий микробиол. 2 (6): 605–618. Дои:10.2217/17460913.2.6.605. PMID 18041902.
- ^ Кастро, А. Дж. (1967). «Антималярийная активность продигиозина». Природа. 213 (5079): 903–904. Bibcode:1967Натура.213..903С. Дои:10.1038 / 213903a0. PMID 6030049. S2CID 4221849.
- ^ Берг, Г. Разнообразие противогрибковых и ассоциированных с растениями штаммов Serratia plymuthica. J. Appl. Microbiol. 88, 952–960 (2000).
- ^ Magae, J., Miller, M. W., Nagai, K. & Shearer, G. M. Действие метациклопродигиозина, ингибитора Т-клеток-киллеров, на пересадку кожи и сердца мыши. J. Antibiot. (Токио) 49, 86–90 (1996).
- ^ Катаока, Т .; и другие. (1995). «Продигиозин 25-C разъединяет Н + -АТФазу вакуолярного типа, ингибирует закисление вакуолей и влияет на процессинг гликопротеина». FEBS Lett. 359 (1): 53–59. Дои:10.1016/0014-5793(94)01446-8. PMID 7851530. S2CID 30504320.
- ^ Растоги, С .; и другие. (2013). «Синтетические продигиозены и влияние замены С-кольца на расщепление ДНК, трансмембранный транспорт хлоридов и основность». Орг. Biomol. Chem. 11 (23): 3834–3845. Дои:10.1039 / c3ob40477c. PMID 23640568.
- ^ Perez-Tomas, R .; Винас, М. (2010). "Новые взгляды на противоопухолевые свойства продигининов". Curr. Med. Chem. 17 (21): 2222–2231. Дои:10.2174/092986710791331103. PMID 20459382.
- ^ Фэн, Цзе; Ши, Ванлян; Чжан, Шо; Чжан, Ин (3 июня 2015 г.). «Идентификация новых соединений с высокой активностью против стационарной фазы Borrelia burgdorferi из коллекции соединений NCI». Новые микробы и инфекции. 4 (5): e31–. Дои:10.1038 / emi.2015.31. ЧВК 5176177. PMID 26954881.
- ^ Уолш, К. Т., Гарно-Цодикова, С., Ховард-Джонс, А. Р. Биологическое образование пирролов: логика природы и ферментативный механизм. Nat. Prod. Реп. 23, 517–531 (2006).
- ^ Ху, Деннис X .; Уитхолл, Дэвид М .; Challis, Gregory L .; Томсон, Риган Дж. (2016). «Структура, химический синтез и биосинтез натуральных продуктов продигинина». Химические обзоры. 116 (14): 7818–7853. Дои:10.1021 / acs.chemrev.6b00024. ЧВК 5555159. PMID 27314508.
