Radixin - Википедия - Radixin
Радиксин это белок что у людей кодируется Гексоген ген.[5][6][7]
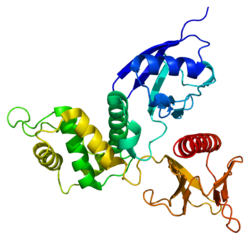
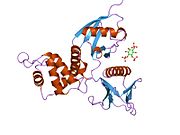
Радиксин - это цитоскелет белок, который может иметь важное значение для связывания актин к плазматической мембране. Он очень похож по последовательности на оба Эзрин и Moesin. Ген радиксина был локализован с помощью флуоресцентной гибридизации in situ в 11q23. Усеченная версия, представляющая псевдоген (RDXP2) был назначен Xp 21.3. Еще один псевдоген, которому, казалось, не хватало интроны (RDXP1) был сопоставлен с 11р с помощью Саузерн-анализа и ПЦР-анализа.[7]
Взаимодействия
Радиксин был показан взаимодействовать с GNA13.[8]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000137710 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000032050 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Вильгенбус К.К., Милатович А., Франк У., Фуртмайр Х. (июнь 1993 г.). «Молекулярное клонирование, последовательность кДНК и хромосомное отнесение гена радиксина человека и двух диспергированных псевдогенов». Геномика. 16 (1): 199–206. Дои:10.1006 / geno.1993.1159. PMID 8486357.
- ^ Хан С.Ю., Ахмед З.М., Шаббир М.И., Китаджири С., Калсум С., Тасним С., Шайик С., Рамеш А., Шрисайлпати С., Хан С.Н., Смит Р.Дж., Риазуддин С., Фридман Т.Б., Риазуддин С. (апрель 2007 г.). «Мутации гена RDX вызывают несиндромную потерю слуха в локусе DFNB24». Хум Мутат. 28 (5): 417–23. Дои:10.1002 / humu.20469. PMID 17226784. S2CID 7671031.
- ^ а б "Entrez Gene: RDX радиксин".
- ^ Вайскунайте Р., Адаричев В., Фуртмайр Х., Козаса Т., Гудков А., Войно-Ясенецкая Т.А. (август 2000 г.). «Конформационная активация радиксина альфа-субъединицей белка G13». J. Biol. Chem. 275 (34): 26206–12. Дои:10.1074 / jbc.M001863200. PMID 10816569.
дальнейшее чтение
- Хёфлич К.П., Икура М (2005). «Радиксин: цитоскелетный адоптер и сигнальный белок». Int. J. Biochem. Cell Biol. 36 (11): 2131–6. Дои:10.1016 / j.biocel.2003.11.018. PMID 15313460.
- Матаррезе П., Малорни В. (2006). «Белки вируса иммунодефицита человека (ВИЧ) -1 и цитоскелет: партнеры в вирусной жизни и гибели клетки-хозяина». Разница в гибели клеток. 12 Дополнение 1: 932–41. Дои:10.1038 / sj.cdd.4401582. PMID 15818415.
- Сато Н., Фунаяма Н., Нагафучи А., Йонемура С., Цукита С., Цукита С. (1992). «Семейство генов, состоящее из эзрина, радиксина и моэзина. Его специфическая локализация в сайтах ассоциации актинового филамента / плазматической мембраны». J. Cell Sci. 103 (1): 131–43. PMID 1429901.
- Хирао М., Сато Н., Кондо Т., Йонемура С., Монден М., Сасаки Т., Такай Ю., Цукита С., Цукита С. (1996). «Механизм регуляции ассоциации белок ERM (эзрин / радиксин / моэзин) / плазматическая мембрана: возможное участие в обмене фосфатидилинозитола и Rho-зависимом пути передачи сигналов». J. Cell Biol. 135 (1): 37–51. Дои:10.1083 / jcb.135.1.37. ЧВК 2121020. PMID 8858161.
- Боналдо М.Ф., Леннон Г., Соарес МБ (1997). «Нормализация и вычитание: два подхода для облегчения открытия генов». Genome Res. 6 (9): 791–806. Дои:10.1101 / гр.6.9.791. PMID 8889548.
- Стеммер-Рахамимов А.О., Гонсалес-Агости С., Сюй Л., Бурвик Дж. А., Бошамп Р., Пинни Д., Луис Д. Н., Рамеш В. (1997). «Экспрессия кодируемого NF2 мерлина и родственных белков семейства ERM в центральной нервной системе человека». J. Neuropathol. Exp. Neurol. 56 (6): 735–42. Дои:10.1097/00005072-199756060-00011. PMID 9184664.
- Такахаши К., Сасаки Т., Маммото А., Такаиши К., Камеяма Т., Цукита С., Такай И. (1997). «Прямое взаимодействие ингибитора диссоциации Rho GDP с эзрином / радиксином / моэзином инициирует активацию малого G-белка Rho». J. Biol. Chem. 272 (37): 23371–5. Дои:10.1074 / jbc.272.37.23371. PMID 9287351.
- Кондо Т., Такеучи К., Дои Й, Йонемура С., Нагата С., Цукита С. (1997). «Основанный на ERM (эзрин / радиксин / моэзин) молекулярный механизм разрушения микровилл на ранней стадии апоптоза». J. Cell Biol. 139 (3): 749–58. Дои:10.1083 / jcb.139.3.749. ЧВК 2141718. PMID 9348291.
- Мурти А., Гонсалес-Агости С., Кордеро Е., Пинни Д., Кандия С., Соломон Ф., Гуселла Дж., Рамеш В. (1998). «NHE-RF, регуляторный кофактор для обмена Na (+) - H +, является общим взаимодействующим для белков мерлина и ERM (MERM)». J. Biol. Chem. 273 (3): 1273–6. Дои:10.1074 / jbc.273.3.1273. PMID 9430655.
- Мацуи Т., Маэда М., Дои Й, Йонемура С., Амано М., Кайбути К., Цукита С., Цукита С. (1998). «Ро-киназа фосфорилирует COOH-концевые треонины белков эзрина / радиксина / моэзина (ERM) и регулирует их ассоциацию« голова к хвосту »». J. Cell Biol. 140 (3): 647–57. Дои:10.1083 / jcb.140.3.647. ЧВК 2140160. PMID 9456324.
- Йонемура С., Хирао М., Дои Й, Такахаши Н., Кондо Т., Цукита С., Цукита С. (1998). «Белки эзрин / радиксин / моэзин (ERM) связываются с положительно заряженным аминокислотным кластером в цитоплазматическом домене юкста-мембраны CD44, CD43 и ICAM-2». J. Cell Biol. 140 (4): 885–95. Дои:10.1083 / jcb.140.4.885. ЧВК 2141743. PMID 9472040.
- Бхартур С.Г., Голденринг-младший (1998). «Картирование димеризации эзрина с использованием дрожжевого двухгибридного скрининга». Biochem. Биофиз. Res. Сообщество. 243 (3): 874–7. Дои:10.1006 / bbrc.1998.8196. PMID 9501018.
- Такахаши К., Сасаки Т., Маммото А., Хотта И., Такаиши К., Имамура Н., Накано К., Кодама А., Такай И. (1998). «Взаимодействие радиксина с Rho small G-белком GDP / GTP-обменным белком Dbl». Онкоген. 16 (25): 3279–84. Дои:10.1038 / sj.onc.1201874. PMID 9681826. S2CID 21445282.
- Лэмб РФ, Рой С., Дифенбах Т.Дж., Винтерс Х.В., Джонсон М.В., Джей Д.Г., Зал A (2000). «Хамартин, супрессор опухоли TSC1, регулирует клеточную адгезию через белки ERM и GTPase Rho». Nat. Cell Biol. 2 (5): 281–7. Дои:10.1038/35010550. PMID 10806479. S2CID 25353057.
- Вайскунайте Р, Адаричев В, Фуртмайр Х, Козаса Т, Гудков А, Войно-Ясенецкая Т.А. (2000). «Конформационная активация радиксина альфа-субъединицей белка G13». J. Biol. Chem. 275 (34): 26206–12. Дои:10.1074 / jbc.M001863200. PMID 10816569.
- Хамада К., Симидзу Т., Мацуи Т., Цукита С., Цукита С., Хакосима Т. (2001). «Кристаллографическая характеристика домена радиксина FERM, связанного с цитоплазматическим хвостом адгезионного белка ICAM-2». Acta Crystallogr. D. 57 (Pt 6): 891–2. Дои:10.1107 / S0907444901005716. PMID 11375520.
- Кикучи С., Хата М., Фукумото К., Ямане Ю., Мацуи Т., Тамура А., Йонемура С., Ямагиши Х., Кепплер Д., Цукита С., Цукита С. (2002). «Дефицит радиксина вызывает конъюгированную гипербилирубинемию с потерей Mrp2 из мембран желчных каналов». Nat. Genet. 31 (3): 320–5. Дои:10,1038 / ng905. PMID 12068294. S2CID 24961102.
- Dickson TC, Mintz CD, Benson DL, Salton SR (2002). «Функциональное связывающее взаимодействие, идентифицированное между аксональным CAM L1 и членами семейства ERM». J. Cell Biol. 157 (7): 1105–12. Дои:10.1083 / jcb.200111076. ЧВК 2173555. PMID 12070130.
- Хаддад Л.А., Смит Н., Баузер М., Ниида Ю., Мурти В., Гонсалес-Агости К., Рамеш В. (2003). «Хамартин, супрессор опухоли TSC1, взаимодействует с нейрофиламентом-L и, возможно, функционирует как новый интегратор цитоскелета нейронов». J. Biol. Chem. 277 (46): 44180–6. Дои:10.1074 / jbc.M207211200. PMID 12226091.
| Эта статья о ген на хромосома человека 11 это заглушка. Вы можете помочь Википедии расширяя это. |