Уравнение Ван т Гоффа - Википедия - van t Hoff equation
В Уравнение Ван 'т Гоффа связывает изменение в константа равновесия, Kэквхимической реакции на изменение температура, Т, Учитывая стандартное изменение энтальпии, ΔЧАС⊖, для процесса. Он был предложен голландским химиком Якобус Хенрикус ван 'т Хофф в 1884 г. в своей книге Études de Dynamique Chimique (Исследования по динамической химии).[1] Это уравнение иногда также называют уравнением Вуканчича – Вуковича.[2][3][4]
Уравнение Ван 'т Гоффа широко использовалось для изучения изменений в государственные функции в термодинамическая система. В сюжет Ван Т Хоффа, которое выводится из этого уравнения, особенно эффективно при оценке изменения энтальпия, или полная энергия, и энтропия, или количество доступных микросостояния, из химическая реакция.
Уравнение
В стандартных условиях
Под стандартные условия, уравнение Ван 'т Гоффа имеет вид[5][6]
куда пер обозначает натуральный логарифм и р это постоянная идеального газа. Это уравнение точно при любой температуре. На практике уравнение часто интегрируют между двумя температурами в предположении, что энтальпия реакции ΔЧАС постоянно. Поскольку на самом деле ΔЧАС и энтропия реакции ΔS зависят от температуры для большинства процессов,[7] интегральное уравнение является только приближенным.
Основное использование интегрированного уравнения - оценка нового константа равновесия на новом абсолютная температура предполагая постоянный стандартная энтальпия изменить температурный диапазон.
Чтобы получить интегрированное уравнение, удобно сначала переписать уравнение Вант-Гоффа в виде[5]
Определенный интеграл между температурами Т1 и Т2 затем
В этом уравнении K1 - константа равновесия при абсолютной температуре Т1, и K2 - константа равновесия при абсолютной температуре Т2.
Развитие из термодинамики
Объединяя определение Свободная энергия Гиббса:
куда S это энтропия системы и уравнение изотермы свободной энергии Гиббса:[8]
мы получаем
Дифференцирование этого выражения по переменной Т дает уравнение Ван 'т Гоффа.
При условии, что ΔЧАС⊖ и ΔS⊖ постоянны, предыдущее уравнение дает пер K как линейная функция от 1/Т и поэтому известен как линейная форма уравнения Ван 'т Гоффа. Следовательно, когда диапазон температур достаточно мал, чтобы стандартная энтальпия реакции и энтропия реакции были по существу постоянными, график зависимости натуральный логарифм константы равновесия в зависимости от взаимный температура дает прямую линию. Наклон линии можно умножить на газовая постоянная р получить стандарт энтальпия изменение реакции, и перехват может быть умножен на р получить стандарт энтропия изменять.
изотерма Ван 'т Гоффа
В Свободная энергия Гиббса изменяется в зависимости от температуры и давления термодинамическая система. В Ван Т Хофф изотерма может использоваться для определения свободной энергии Гиббса для реакций с нестандартным состоянием при постоянной температуре:[9]
куда Δрграмм - свободная энергия Гиббса для реакции, а Qр это коэффициент реакции. Когда реакция на равновесие, Qр = Kэкв. Изотерма Ван 'т Гоффа может помочь оценить смещение равновесной реакции. Когда Δрграмм < 0, реакция движется в прямом направлении. Когда Δрграмм > 0, реакция движется в обратном направлении. Видеть Химическое равновесие.
сюжет Ван Т Хоффа
Для обратимая реакция, константа равновесия может быть измерена при различных температурах. Эти данные можно отобразить на графике с пер Kэкв на уось и 1/Т на Икс ось. Данные должны иметь линейную зависимость, уравнение для которой может быть найдено путем подбора данных с использованием линейной формы уравнения Ван'та Хоффа.
Этот график называется «графиком Ван 'т Хоффа» и широко используется для оценки энтальпия и энтропия из химическая реакция. Из этого сюжета, −ΔЧАС/р это наклон, а ΔS/р - точка пересечения линейной посадки.
Измеряя константа равновесия, Kэкв, при различных температурах график Ван 'т Гоффа можно использовать для оценки реакции при изменении температуры.[10][11] Зная наклон и точку пересечения графика Ван-т-Гоффа, энтальпию и энтропию реакции можно легко получить, используя
График Ван 'т-Гоффа можно использовать для быстрого определения энтальпии химической реакции как качественно, так и количественно. Изменение энтальпии может быть положительным или отрицательным, что приводит к двум основным формам графика Ван 'т Гоффа.
Эндотермические реакции

Для эндотермическая реакция, тепло поглощается, делая изменение чистой энтальпии положительным. Таким образом, согласно определению уклона:
для эндотермический реакция ΔЧАС > 0 (и газовая постоянная р > 0), так
Таким образом, для эндотермической реакции график Ван 'т Гоффа всегда должен иметь отрицательный наклон.
Экзотермические реакции
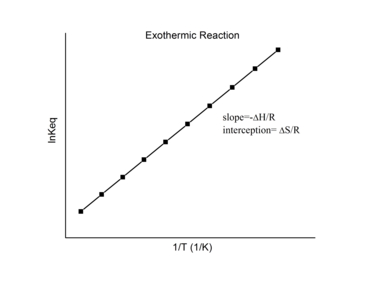
Для экзотермическая реакция, выделяется тепло, в результате чего чистое изменение энтальпии становится отрицательным. Таким образом, согласно определению уклона:
из экзотермический реакция ΔЧАС < 0, так
Таким образом, для экзотермической реакции график Ван 'т Гоффа всегда должен иметь положительный наклон.
Распространение ошибки
Используя тот факт, что Δграмм⊖ = −RT пер K = ΔЧАС⊖ − ТΔS⊖, казалось бы, что два измерения K достаточно, чтобы получить значение ΔЧАС⊖:
куда K1 и K2 - значения констант равновесия, полученные при температурах Т1 и Т2 соответственно. В точность из ΔЧАС⊖ Значения, полученные таким образом, сильно зависят от точности значений констант равновесия. Типичная пара температур может быть 25 и 35 ° C (298 и 308 K). Для этих температур
Вставив это значение в выражение для ΔЧАС⊖:
Сейчас же, распространение ошибки показывает, что ошибка на ΔЧАС⊖ будет примерно в 76 кДж / моль раз больше ошибки на (ln K1 - ln K2), или примерно в 110 кДж / моль раз больше ошибки пер K значения. Предположим, например, что ошибка на каждом пер K является σ ≈ 0.05, небольшая, но разумная стоимость. Ошибка на ΔЧАС⊖ будет о 5 кДж / моль. Таким образом, даже несмотря на то, что отдельные константы стабильности были определены с хорошей точностью, энтальпия, вычисленная таким образом, подвержена значительной ошибке.
Тогда энтропия будет получена из ΔS⊖ = 1/Т(ΔЧАС⊖ + RT пер K). В этом выражении ошибка второго члена пренебрежимо мала по сравнению с ошибкой первого члена. Тогда коэффициент увеличения равен 76 кДж / моль ÷ 298 К, поэтому при ошибке в логарифмах 0,05 ошибка на ΔS⊖ будет порядка 17 Дж / (К моль).
Когда константы равновесия измеряются при трех или более температурах, значения ΔЧАС⊖ будет получен прямолинейный фитинг. В этом случае ошибка стандартной энтальпии будет увеличиваться в несколько меньшей, но все же значительной степени.
Применение сюжета Ван 'т Гоффа
анализ Ван 'т Гоффа

В биологических исследованиях график Ван'т Хоффа также называется анализом Ван'т Гоффа.[12] Это наиболее эффективно для определения предпочтительного продукта в реакции.
Предположим, что в реакции образуются два продукта B и C:
- а А + d D → б B,
- а А + d D → c С.
В этом случае, Kэкв можно определить как отношение B к C, а не как константу равновесия.
Когда B/C > 1, B - предпочтительный продукт, и данные на графике Ван 'т Гоффа будут в положительной области.
Когда B/C <1, C - предпочтительный продукт, и данные на графике Ван 'т Хоффа будут в отрицательной области.
Используя эту информацию, анализ Ван 'т Гоффа может помочь определить наиболее подходящую температуру для предпочтительного продукта.
В 2010 г. был использован анализ Ван 'т Гоффа, чтобы определить, образует ли вода преимущественно водородная связь с C-терминал или N-терминал из аминокислота пролин.[13] Константа равновесия для каждой реакции была найдена при различных температурах, и был построен график Ван 'т Гоффа. Этот анализ показал, что энтальпийно вода предпочитает водородную связь с C-конце, но энтропийно он был более благоприятным для водородной связи с N-терминал. В частности, они обнаружили, что C-концевая водородная связь составляла 4,2–6,4 кДж / моль. В N-концевая водородная связь составляла 31–43 Дж / (К · моль).
Сами по себе эти данные не могли сделать вывод, с каким участком вода будет предпочтительно водородной связью, поэтому были использованы дополнительные эксперименты. Было определено, что при более низких температурах энтальпийно предпочтительные частицы вода связывается водородными связями с C-terminus, было предпочтительнее. При более высоких температурах, энтропийно предпочтительные частицы вода связывается водородными связями с N-терминал, было предпочтительнее.
Механистические исследования

Химическая реакция может претерпевать разные механизмы реакции при разных температурах.[14]
В этом случае можно использовать график Ван'т-Хоффа с двумя или более линейными подгонками. Каждая линейная аппроксимация имеет различный наклон и точку пересечения, что указывает на разные изменения энтальпии и энтропии для каждого отдельного механизма. График Ван 'т-Гоффа можно использовать для определения изменения энтальпии и энтропии для каждого механизма и предпочтительного механизма при различных температурах.
На рисунке в качестве примера реакция протекает по механизму 1 при высокой температуре и по механизму 2 при низкой температуре.
Температурная зависимость

График Ван 'т Хоффа является линейным на основе молчаливое предположение что энтальпия и энтропия постоянны при изменении температуры. Однако в некоторых случаях энтальпия и энтропия резко меняются с температурой. Приближение первого порядка предполагает, что два разных продукта реакции имеют разную теплоемкость. Включение этого предположения дает дополнительный член c/Т2 в выражении для константы равновесия как функции температуры. Затем можно использовать полиномиальную аппроксимацию для анализа данных, которые демонстрируют непостоянную стандартную энтальпию реакции:[15]
куда
Таким образом, энтальпию и энтропию реакции можно определить при определенных температурах, даже если существует температурная зависимость.
Самостоятельная сборка ПАВ
Соотношение Ван 'т-Гоффа особенно полезно для определения мицеллообразование энтальпия ΔЧАС⊖
м из поверхностно-активные вещества из температурной зависимости критическая концентрация мицелл (CMC):
Однако это соотношение теряет силу, когда номер агрегации также зависит от температуры, и вместо этого следует использовать следующее соотношение:[16]
с граммN + 1 и граммN свободные энергии поверхностно-активного вещества в мицелле с числом агрегации N + 1 и N соответственно. Этот эффект особенно актуален для неионные этоксилированные поверхностно-активные вещества[17] или же блок-сополимеры полиоксипропилена и полиоксиэтилена (Полоксамеры, Плюроники, Синпероники).[18] Расширенное уравнение может быть использовано для извлечения числа агрегации самоорганизованных мицелл из дифференциальная сканирующая калориметрия термограммы.[19]
Смотрите также
- Соотношение Клаузиуса – Клапейрона
- фактор Ван 'т Гоффа (я)
- Уравнение Гиббса – Гельмгольца.
- Равновесие растворимости
Рекомендации
- ^ Биография на сайте Нобелевской премии. Nobelprize.org (1911-03-01). Проверено 8 ноября 2013.
- ^ Журнал по моделированию активности TiO2 Prograde и ее значению для Ti в кварцевой термобарометрии пелитовых метаморфических пород. Academia.edu. п. 2.
- ^ Журнал непрямого спектрофотометрического определения фолиевой кислоты на основе реакции окисления и изучения некоторых термодинамических параметров. Academia.edu. п. 67.
- ^ Исправление вспомогательной информации PNAS. (PNAS) Труды Национальной академии наук Соединенных Штатов Америки. 30 ноября 2012 г. с. 3.
- ^ а б Аткинс, Питер; Де Паула, Хулио (10 марта 2006 г.). Физическая химия (8-е изд.). В. Х. Фриман и компания. п.212. ISBN 978-0-7167-8759-4.
- ^ Айвз, Д. Дж. Г. (1971). Химическая термодинамика. Университетская химия. Макдональд Технический и научный. ISBN 978-0-356-03736-3.
- ^ Крейг, Норман (1996). «Диаграммы энтропии». J. Chem. Образовательный. 73 (8): 710. Bibcode:1996JChEd..73..710C. Дои:10.1021 / ed073p710.
- ^ Дикерсон, Р. Э .; Гейс, И. (1976). Химия, материя и Вселенная. США: W. A. Benjamin Inc. ISBN 978-0-19-855148-5.
- ^ Монах, Пол (2004). Физическая химия: понимание нашего химического мира. Вайли. п.162. ISBN 978-0471491811.
- ^ Ким, Тэ Ву (2012). «Динамическое [2] сцепление самоорганизующихся макроциклов Pd (II) в воде». Chem. Латыш. 41: 70. Дои:10.1246 / cl.2012.70.
- ^ Итикава, Такаюки (2010). «Термодинамические свойства амидов металлов, определяемые изотермами давление-состав аммиака» (PDF). J. Chem. Термодинамика. 42: 140. Дои:10.1016 / j.jct.2009.07.024.
- ^ "Анализ Вант Хоффа". Группа анализа и дизайна белков.
- ^ Прелл, Джеймс; Уильямс Э. (2010). "Энтропия вынуждает присоединенную молекулу воды от C- к N-Terminus на протонированном пролине ». Варенье. Chem. Soc. 132 (42): 14733–5. Дои:10.1021 / ja106167d. PMID 20886878.
- ^ Чатаке, Тошиюки (2010). «Подход к кристаллизации ДНК с помощью термического обратимого процесса дуплексов ДНК». Cryst. Рост Des. 10 (3): 1090. Дои:10.1021 / cg9007075.
- ^ Дэвид, Виктор (28 апреля 2011 г.). «Отклонение от зависимости Вант-Гоффа в RP-LC, вызванное таутомерным взаимопревращением, наблюдается для четырех соединений». Журнал сепарационной науки. 34 (12): 1423–8. Дои:10.1002 / jssc.201100029. PMID 21538875.
- ^ Хольцер, Альфред; Хольцер, Мэрилин Ф. (1 мая 2002 г.). «Использование соотношения Вант-Гоффа для определения энтальпии мицеллообразования». Журнал физической химии. 78 (14): 1442–1443. Дои:10.1021 / j100607a026.
- ^ Херклоц, Хейко; Цамалукас, Алекос; Кита-Токарчик, Катаржина; Струнц, Павел; Гутберлет, Томас (25 ноября 2004 г.). "Структурные, объемные и термодинамические характеристики перехода мицеллярной сферы к стержню". Журнал Американского химического общества. 126 (50): 16544–16552. Дои:10.1021 / ja045525w. PMID 15600359.
- ^ Табоада, Пабло; Москера, Виктор; Аттвуд, Дэвид; Ян, Чжо; Бут, Колин (5 июня 2003 г.). «Энтальпия мицеллизации диблок-сополи (оксиэтилен / оксипропилен) методом изотермической калориметрии титрования. Сравнение со значением Вант-Гоффа». Физическая химия Химическая физика. 5 (12): 2625–2627. Bibcode:2003PCCP .... 5.2625T. Дои:10.1039 / b303108j.
- ^ Кьяппизи, Леонардо; Лаззара, Джузеппе; Градзельски, Майкл; Милиото, Стефана (6 декабря 2012 г.). «Количественное описание термограмм индуцированной температуры самоагрегации, определенных методом дифференциальной сканирующей калориметрии» (PDF). Langmuir. 28 (51): 17609–17616. Дои:10.1021 / la303599d. HDL:10447/96872. PMID 23171124.















![{ displaystyle { begin {align} Delta H_ {1} & = - R times { text {slope}} _ {1}, & Delta S_ {1} & = R times { text {intercept }} _ {1}; [5pt] Delta H_ {2} & = - R times { text {slope}} _ {2}, & Delta S_ {2} & = R times { текст {перехват}} _ {2}. end {выровненный}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a6c1cf504bbb52519d024ecbad81f7a50dee58f)



