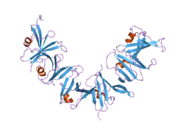AXIN1 - Википедия - AXIN1
Аксин-1 это белок что у людей кодируется AXIN1 ген.[5]
Функция
Этот ген кодирует цитоплазматический белок, который содержит домен регуляции передачи сигналов G-белка (RGS) и растрепанный и домен axin (DIX). Кодируемый белок взаимодействует с полипозом кишечной палочки аденоматоза, катенин (кадгерин-ассоциированный белок) бета-1, киназа гликогенсинтазы 3 бета, протеинфосфатаза 2 и сама. Этот белок функционирует как негативный регулятор в семействе сайтов интеграции MMTV бескрылого типа, член 1 (WNT ) сигнальный путь и может вызывать апоптоз. Кристаллическая структура части этого белка, отдельно или в комплексе с другими белками, была решена. Мутации в этом гене были связаны с гепатоцеллюлярной карциномой, гепатобластомами, эндометриоидными аденокарциномами яичников и медуллобластомами. Для этого гена были идентифицированы два варианта транскрипта, кодирующие разные изоформы.[6]
Структура
Полноразмерный человеческий белок содержит 862 аминокислоты с (предсказанной) молекулярной массой 96 кДа. N-концевой домен RGS, пептид Axin1, взаимодействующий с киназой GSK3, и гомологи C-концевых доменов DIX были решены с атомарным разрешением. Большие центральные области, подавляющие WNT, были охарактеризованы как изначально неупорядоченные с помощью биофизических экспериментов и биоинформатического анализа.[7] Биофизическая дестабилизация свернутого домена RGS индуцирует образование наноагрегатов, которые обнажают и локально концентрируют внутренне неупорядоченные области, которые, в свою очередь, неправильно регулируют передачу сигналов Wnt. Многие другие крупные IDP (внутренне нарушенные белки) подвержены миссенс-мутациям, таким как BRCA1, Аденоматозный полипоз кишечной палочки, CREB-связывающий белок / (CBP) и могут быть затронуты аналогичным образом миссенс-мутациями их свернутых доменов.[8]
Взаимодействия
AXIN1 был показан взаимодействовать с:
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000103126 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000024182 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Цзэн Л., Фаготто Ф., Чжан Т., Хсу В., Васичек Т.Дж., Перри В.Л., Ли Дж.Дж., Тилгман С.М., Гумбинер Б.М., Костантини Ф. (август 1997 г.). «Локус Fused мыши кодирует Axin, ингибитор пути передачи сигналов Wnt, который регулирует формирование эмбриональной оси». Клетка. 90 (1): 181–92. Дои:10.1016 / S0092-8674 (00) 80324-4. PMID 9230313. S2CID 10565695.
- ^ "Entrez Gene: AXIN1 аксин 1".
- ^ Ноутсу М., Дуарте А.М., Анвариан З., Диденко Т., Минде Д.П., Купер И., де Риддер И., Ойкономоу С., Фридлер А., Боеленс Р., Рюдигер С.Г., Морис М.М. (2011). «Критические области каркаса опухолевого супрессора Axin1 изначально развернуты». Дж Мол Биол. 405 (3): 773–86. Дои:10.1016 / j.jmb.2010.11.013. PMID 21087614.
- ^ Анвариан З., Ноджима Х., ван Каппель Э.С., Мадл Т., Спит М, Виртлер М., Джорденс I, Лоу Т.Ю., ван Шерпензил Р.С., Купер I, Рихтер К., Хек А.Дж., Боеленс Р., Винсент Дж. П., Рюдигер С. Г., Морис М. М. ( 2016). «Раковые мутанты Axin образуют наноагрегаты, чтобы перепрограммировать сигнальную сеть Wnt». Нат Структ Мол Биол. 23 (4): 324–32. Дои:10.1038 / nsmb.3191. PMID 26974125. S2CID 30761541.
- ^ а б c Накамура Т., Хамада Ф., Ишидате Т., Анаи К., Кавахара К., Тоошима К., Акияма Т. (июнь 1998 г.). «Аксин, ингибитор пути передачи сигналов Wnt, взаимодействует с бета-катенином, GSK-3beta и APC и снижает уровень бета-катенина». Гены Клетки. 3 (6): 395–403. Дои:10.1046 / j.1365-2443.1998.00198.x. PMID 9734785. S2CID 10875463.
- ^ Хосевар Б.А., Мо Ф., Реннольдс Дж. Л., Моррис С. М., Купер Дж. А., Хоу PH (июнь 2003 г.). «Регулирование пути передачи сигналов Wnt с помощью disabled-2 (Dab2)». EMBO J. 22 (12): 3084–94. Дои:10.1093 / emboj / cdg286. ЧВК 162138. PMID 12805222.
- ^ а б c Чжан Ю., Цю В.Дж., Чан С.К., Хан Дж., Хе Икс, Лин С.К. (май 2002 г.). «Казеинкиназа I и казеинкиназа II по-разному регулируют функцию аксина в путях Wnt и JNK». J. Biol. Chem. 277 (20): 17706–12. Дои:10.1074 / jbc.M111982200. PMID 11884395.
- ^ а б Ким MJ, Чиа IV, Костантини Ф (ноябрь 2008 г.). «Сайты-мишени SUMOylation на С-конце защищают Axin от убиквитинирования и придают стабильность белка». FASEB J. 22 (11): 3785–94. Дои:10.1096 / fj.08-113910. ЧВК 2574027. PMID 18632848.
- ^ Li L, Yuan H, Weaver CD, Mao J, Farr GH, Sussman DJ, Jonkers J, Kimelman D, Wu D (август 1999). «Axin и Frat1 взаимодействуют с dvl и GSK, соединяя Dvl с GSK в Wnt-опосредованной регуляции LEF-1». EMBO J. 18 (15): 4233–40. Дои:10.1093 / emboj / 18.15.4233. ЧВК 1171499. PMID 10428961.
- ^ а б Мак BC, Такемару К., Kenerson HL, Moon RT, Yeung RS (февраль 2003 г.). «Комплекс туберин-гамартин отрицательно регулирует сигнальную активность бета-катенина». J. Biol. Chem. 278 (8): 5947–51. Дои:10.1074 / jbc.C200473200. PMID 12511557.
- ^ Мао Дж., Ван Дж., Лю Б., Пан В., Фарр Г. Х., Флинн С., Юань Х, Такада С., Кимелман Д., Ли Л., Ву Д. (апрель 2001 г.). «Белок-5, связанный с рецептором липопротеинов низкой плотности, связывается с Axin и регулирует канонический путь передачи сигналов Wnt». Мол. Клетка. 7 (4): 801–9. Дои:10.1016 / S1097-2765 (01) 00224-6. PMID 11336703.
- ^ Чжан Ю., Нео С.Ю., Хань Дж., Лин С.К. (август 2000 г.). «Выбор димеризации контролирует способность аксина и растрепанного активировать c-Jun N-концевую киназу / стресс-активируемую протеинкиназу». J. Biol. Chem. 275 (32): 25008–14. Дои:10.1074 / jbc.M002491200. PMID 10829020.
- ^ Ямамото Х., Хинои Т., Мичиуэ Т., Фукуи А., Усуи Х., Янссенс В., Ван Хоф С., Горис Дж., Асашима М., Кикучи А. (июль 2001 г.). «Ингибирование пути передачи сигнала Wnt субъединицей PR61 протеинфосфатазы 2A». J. Biol. Chem. 276 (29): 26875–82. Дои:10.1074 / jbc.M100443200. PMID 11297546.
дальнейшее чтение
- Сегдицас S, Томлинсон I (2007). «Колоректальный рак и генетические изменения пути Wnt». Онкоген. 25 (57): 7531–7. Дои:10.1038 / sj.onc.1210059. PMID 17143297.
- Флинт Дж., Томас К., Миклем Дж., Рейнхэм Х, Кларк К., Доггетт Н.А., Кинг А., Хиггс Д.Р. (1997). «Взаимосвязь между структурой хромосом и функцией в теломерной области человека». Nat. Genet. 15 (3): 252–7. Дои:10.1038 / ng0397-252. PMID 9054936. S2CID 20630444.
- Икеда С., Кишида С., Ямамото Х., Мураи Х., Кояма С., Кикучи А. (1998). «Аксин, отрицательный регулятор пути передачи сигналов Wnt, образует комплекс с GSK-3beta и бета-катенином и способствует GSK-3beta-зависимому фосфорилированию бета-катенина». EMBO J. 17 (5): 1371–84. Дои:10.1093 / emboj / 17.5.1371. ЧВК 1170485. PMID 9482734.
- Харт М.Дж., де лос Сантос Р., Альберт И.Н., Рубинфельд Б., Полакис П. (1998). «Подавление бета-катенина человеческим аксином и его связь с супрессором опухолей APC, бета-катенином и GSK3 бета». Curr. Биол. 8 (10): 573–81. Дои:10.1016 / S0960-9822 (98) 70226-X. PMID 9601641. S2CID 2863360.
- Накамура Т., Хамада Ф., Ишидате Т., Анаи К., Кавахара К., Тойошима К., Акияма Т. (1998). «Аксин, ингибитор пути передачи сигналов Wnt, взаимодействует с бета-катенином, GSK-3beta и APC и снижает уровень бета-катенина». Гены Клетки. 3 (6): 395–403. Дои:10.1046 / j.1365-2443.1998.00198.x. PMID 9734785. S2CID 10875463.
- Сюй В., Цзэн Л., Костантини Ф (1999). «Идентификация домена аксина, который связывается с серин / треониновой протеинфосфатазой 2A и самосвязывающимся доменом». J. Biol. Chem. 274 (6): 3439–45. Дои:10.1074 / jbc.274.6.3439. PMID 9920888.
- Китагава М., Хатакеяма С., Сиране М., Мацумото М., Исида Н., Хаттори К., Накамичи И., Кикучи А., Накаяма К., Накаяма К. (1999). «Белок F-бокса, FWD1, опосредует убиквитин-зависимый протеолиз бета-катенина». EMBO J. 18 (9): 2401–10. Дои:10.1093 / emboj / 18.9.2401. ЧВК 1171323. PMID 10228155.
- Фаготто Ф, Джо Э, Зенг Л., Курт Т., Джоос Т., Кауфманн К., Костантини Ф (1999). «Домены аксина, участвующие в белок-белковых взаимодействиях, ингибировании пути Wnt и внутриклеточной локализации». J. Cell Biol. 145 (4): 741–56. Дои:10.1083 / jcb.145.4.741. ЧВК 2133179. PMID 10330403.
- Кодама С., Икеда С., Асахара Т., Кишида М., Кикучи А. (1999). «Аксин напрямую взаимодействует с плакоглобином и регулирует его стабильность». J. Biol. Chem. 274 (39): 27682–8. Дои:10.1074 / jbc.274.39.27682. PMID 10488109.
- Джо Э, Ломвардас С., Костантини Ф (2000). «Сайт фосфорилирования GSK3beta в аксине модулирует взаимодействие с бета-катенином и экспрессию гена, опосредованную Tcf». Biochem. Биофиз. Res. Сообщество. 266 (1): 28–35. Дои:10.1006 / bbrc.1999.1760. PMID 10581160.
- Икеда С., Кишида М., Мацуура Ю., Усуи Н., Кикучи А. (2000). «GSK-3beta-зависимое фосфорилирование продукта гена аденоматозного полипоза coli может модулироваться бета-катенином и протеинфосфатазой 2A в комплексе с аксином». Онкоген. 19 (4): 537–45. Дои:10.1038 / sj.onc.1203359. PMID 10698523.
- Satoh S, Daigo Y, Furukawa Y, Kato T, Miwa N, Nishiwaki T, Kawasoe T, Ishiguro H, Fujita M, Tokino T, Sasaki Y, Imaoka S, Murata M, Shimano T, Yamaoka Y, Nakamura Y (2000) . «Мутации AXIN1 в гепатоцеллюлярной карциноме и подавление роста раковых клеток посредством вирус-опосредованного переноса AXIN1». Nat. Genet. 24 (3): 245–50. Дои:10.1038/73448. PMID 10700176. S2CID 27531668.
- Спинк К.Е., Полакис П., Вайс В.И. (2000). «Структурные основы взаимодействия Аксин-аденоматозный полипоз кишечной палочки». EMBO J. 19 (10): 2270–9. Дои:10.1093 / emboj / 19.10.2270. ЧВК 384355. PMID 10811618.
- Чжан И, Нео С.Ю., Хань Дж., Лин СК (2000). «Выбор димеризации контролирует способность аксина и растрепанного активировать c-Jun N-концевую киназу / стресс-активируемую протеинкиназу». J. Biol. Chem. 275 (32): 25008–14. Дои:10.1074 / jbc.M002491200. PMID 10829020.
- Дэниэлс Р.Дж., Педен Дж.Ф., Ллойд С., Хорсли С.В., Кларк К., Туфарелли С., Кирни Л., Пряжка В.Дж., Доггетт Н.А., Флинт Дж., Хиггс Д.Р. (2001). «Последовательность, структура и патология полностью аннотированного конца 2 Mb короткого плеча хромосомы 16 человека». Гм. Мол. Genet. 10 (4): 339–52. Дои:10.1093 / hmg / 10.4.339. PMID 11157797.
- Ямамото Х., Хинои Т., Мичиуэ Т, Фукуи А., Усуи Х., Янссенс В., Ван Хоф С., Горис Дж., Асашима М., Кикучи А. (2001). «Ингибирование пути передачи сигнала Wnt субъединицей PR61 протеинфосфатазы 2A». J. Biol. Chem. 276 (29): 26875–82. Дои:10.1074 / jbc.M100443200. PMID 11297546.
- Мао Дж., Ван Дж., Лю Б., Пан В., Фарр Г. Х., Флинн С., Юань Х, Такада С., Кимелман Д., Ли Л., Ву Д. (2001). «Белок-5, связанный с рецептором липопротеинов низкой плотности, связывается с Axin и регулирует канонический путь передачи сигналов Wnt». Мол. Клетка. 7 (4): 801–9. Дои:10.1016 / S1097-2765 (01) 00224-6. PMID 11336703.
- Фурухаши М., Яги К., Ямамото Х., Фурукава Й., Шимада С., Накамура Ю., Кикучи А., Миядзоно К., Като М. (2001). «Аксин способствует активации Smad3 в сигнальном пути трансформирующего фактора роста бета». Мол. Клетка. Биол. 21 (15): 5132–41. Дои:10.1128 / MCB.21.15.5132-5141.2001. ЧВК 87238. PMID 11438668.
- Рубинфельд Б., Тайс Д.А., Полакис П. (2001). «Аксин-зависимое фосфорилирование белка аденоматозного полипоза coli, опосредованное казеинкиназой 1-эпсилон». J. Biol. Chem. 276 (42): 39037–45. Дои:10.1074 / jbc.M105148200. PMID 11487578.