Антиароматичность - Antiaromaticity
Антиароматичность характеристика циклической молекулы с π электронная система который имеет более высокую энергию из-за присутствия в нем 4n делокализованных (π или неподеленных пар) электронов. В отличие от ароматный соединения, которые следуют Правило Хюккеля ([4п+2] π электронов)[1] и очень стабильны, антиароматические соединения очень нестабильны и обладают высокой реакционной способностью. Чтобы избежать нестабильности антиароматичности, молекулы могут менять форму, становясь неплоскими и, следовательно, нарушая некоторые π-взаимодействия. В отличие от диамагнитный кольцевой ток, присутствующий в ароматических соединениях, антиароматические соединения имеют парамагнитный кольцевой ток, который может быть наблюдается методом ЯМР-спектроскопии.

Примеры антиароматических соединений: пентален (А), бифенилен (B), циклопентадиенильный катион (C). Прототипный пример антиароматичности, циклобутадиен, является предметом споров, и некоторые ученые утверждают, что антиароматичность не является основным фактором, способствующим его дестабилизации.[2]
Циклооктатетраен является примером молекулы, принимающей неплоскую геометрию, чтобы избежать дестабилизации, которая возникает в результате антиароматичности. Если бы он был плоским, у него была бы одна восьмиэлектронная π-система вокруг кольца, но вместо этого оно принимает форму лодочки с четырьмя отдельными π-связями.[3] Поскольку антиароматические соединения часто недолговечны и с ними трудно работать экспериментально, энергия антиароматической дестабилизации часто моделируется путем моделирования, а не экспериментирования.[2]
Определение
Термин «антиароматичность» был впервые предложен Рональд Бреслоу в 1967 году как «ситуация, в которой циклическая делокализация электронов дестабилизирует».[4] В ИЮПАК критерии антиароматичности следующие:[5]
- Молекула должна быть циклической.
- Молекула должна быть плоской.
- Молекула должна иметь полную сопряженную π-электронную систему внутри кольца.
- В молекуле должно быть 4п π-электроны, где п - любое целое число в сопряженной π-системе.
Это отличается от ароматичность только по четвертому критерию: ароматические молекулы имеют 4п +2 π-электронов в сопряженной π-системе и поэтому следуют Правило Хюккеля. Неароматические молекулы либо нециклические, непланарные, либо не имеют полной сопряженной π-системы внутри кольца.
| Ароматный | Антиароматический | Неароматический | |
|---|---|---|---|
| Циклический? | да | да | Выйдет из строя хотя бы одно из этих |
| Имеет ли в кольце молекулы полностью сопряженную систему p-орбиталей? | да | да | |
| Планарный? | да | да | |
| Сколько π-электронов в сопряженной системе? | 4n + 2 (т.е. 2, 6, 10,…) | 4n (4, 8, 12,…) | Нет данных |
Наличие плоской кольцевой системы важно для максимального перекрытия между п орбитали, составляющие сопряженную π-систему. Это объясняет, почему плоская циклическая молекула является ключевой характеристикой как ароматических, так и антиароматических молекул. Однако в действительности сложно определить, полностью ли конъюгирована молекула, просто взглянув на ее структуру: иногда молекулы могут искажаться, чтобы снять напряжение, и это искажение может нарушить конъюгацию. Таким образом, необходимо предпринять дополнительные усилия, чтобы определить, действительно ли определенная молекула является антиароматической.[6]
Антиароматическое соединение может демонстрировать свои антиароматические свойства как кинетически, так и термодинамически. Как будет обсуждаться позже, антиароматические соединения обладают исключительно высокой химической реакционной способностью (высокая реакционная способность не является «признаком» антиароматического соединения, это просто предполагает, что соединение может быть антиароматическим). Антиароматическое соединение также можно распознать термодинамически путем измерения энергии циклической сопряженной π-электронной системы. В антиароматическом соединении количество энергии конъюгации в молекуле будет значительно выше, чем в соответствующем эталонном соединении.[7]
В действительности рекомендуется тщательно проанализировать структуру потенциально антиароматического соединения, прежде чем заявлять, что оно действительно является антиароматическим. Если экспериментально определенная структура рассматриваемой молекулы не существует, необходимо провести вычислительный анализ. В потенциальная энергия молекулы следует исследовать на предмет наличия различных геометрических форм, чтобы оценить любые искажения из-за симметричной плоской конформации.[6] Эта процедура рекомендуется, потому что в прошлом было множество случаев, когда молекулы, которые на бумаге казались антиароматическими, в действительности оказывались не такими. Самой известной (и активно обсуждаемой) из этих молекул является циклобутадиен, о чем будет сказано ниже.
Примеры антиароматических соединений: пентален (А), бифенилен (B), циклопентадиенильный катион (C). Прототипный пример антиароматичности, циклобутадиен, является предметом споров, и некоторые ученые утверждают, что антиароматичность не является основным фактором, способствующим его дестабилизации.[2] Циклооктатетраен на первый взгляд кажется антиароматическим, но является прекрасным примером молекулы, использующей неплоскую геометрию, чтобы избежать дестабилизации, которая является результатом антиароматичности.[3] Поскольку антиароматические соединения часто недолговечны и с ними трудно работать экспериментально, энергия антиароматической дестабилизации часто моделируется путем моделирования, а не экспериментирования.[2]
ЯМР-спектроскопия
Парамагнитный кольцевой ток, возникающий в результате делокализации электронов в антиароматических соединениях, можно наблюдать с помощью ЯМР. Этот кольцевой ток приводит к деэкранированию (сдвигу в слабое поле) ядер внутри кольца и экранированию (сдвигу в сильное поле) ядер вне кольца. [12] аннулен представляет собой антиароматический углеводород, достаточно большой, чтобы иметь протоны как внутри, так и за пределами кольца. В химический сдвиг для протонов внутри его кольца - 5,91 м.д., а для протонов вне кольца - 7,86 м.д. по сравнению с нормальным диапазоном 4,5-6,5 м.д. для неароматических алкенов. Этот эффект имеет меньшую величину, чем соответствующие сдвиги в ароматических соединениях.[8]
Многие ароматические и антиароматические соединения (бензол и циклобутадиен) слишком малы, чтобы иметь протоны внутри кольца, где эффекты экранирования и деэкранирования могут быть более полезными с диагностической точки зрения при определении того, является ли соединение ароматическим, антиароматическим или неароматическим. Анализ ядерно-независимого химического сдвига (NICS) - это метод вычисления кольцевого экранирования (или снятия защиты) в центре кольцевой системы для прогнозирования ароматичности или антиароматичности. Отрицательное значение NICS указывает на ароматичность, а положительное значение указывает на антиароматичность.[9]
Примеры
Хотя существует множество молекул, которые на бумаге могут показаться антиароматическими, на самом деле количество антиароматических молекул значительно меньше. Это усугубляется тем фактом, что обычно нельзя создавать производные антиароматических молекул, добавляя больше антиароматических углеводородных колец и т.д., потому что молекула обычно теряет либо свою планарную природу, либо свою сопряженную систему π-электронов и становится неароматической.[10] В этот раздел включены только неоспоримые примеры антиароматических соединений.

Пентален представляет собой антиароматическое соединение, которое десятилетиями хорошо изучалось как экспериментально, так и вычислительно. Он дициклический, плоский и имеет восемь π-электронов, что соответствует определению антиароматичности ИЮПАК. Дианионное и дикатионное состояния пенталена являются ароматическими, поскольку они следуют 4-му Хюккелю.п +2 π-электронное правило.[11]
Как его родственник [12] аннулен гексадегидро- [12] аннулен также является антиароматическим веществом. Его структура была исследована расчетно с помощью ab initio и теория функционала плотности расчетами и подтверждено как антиароматическое.[12]
Циклобутадиен
Циклобутадиен является классическим учебным примером антиароматического соединения. Принято считать, что он плоский, циклический и имеет 4 π-электрона (4п за п= 1) в сопряженной системе.

Однако давно ставится под вопрос, действительно ли циклобутадиен является антиароматическим веществом, и недавние открытия предполагают, что это не так. Циклобутадиен особенно дестабилизирован, и это первоначально приписывали антиароматичности. Однако циклобутадиен имеет более характерную двойную связь в двух своих параллельных связях, чем другие, и π-электроны не делокализованы между двумя связями, подобными двойным связям, что придает ему прямоугольную форму в отличие от правильного квадрата.[3] Таким образом, циклобутадиен ведет себя как два отдельных алкена, соединенных двумя одинарными связями, и поэтому является неароматическим, а не антиароматическим.
Несмотря на отсутствие этого эффекта π-антиароматической дестабилизации, ни один из его 4п Родственники π-электронов (циклооктатетраен и т. д.) имели даже почти такую же дестабилизацию, что позволяет предположить, что в случае циклобутадиена происходит нечто большее. Было обнаружено, что сочетание угловая деформация, скручивающая деформация, и Паули отталкивание приводит к крайней дестабилизации этой молекулы.[2]
Это открытие неудобно, поскольку противоречит основным учениям об антиароматичности. На данный момент предполагается, что циклобутадиен будет по-прежнему использоваться для введения концепции антиароматичности в учебниках для удобства, даже несмотря на то, что техническая классификация его как антиароматического может быть неточной.
Циклопентадиенильный катион
В циклопентадиенильный катион - еще один учебный пример антиароматического соединения. Принято считать, что он плоский, циклический и имеет 4 π-электрона (4п за п= 1) в сопряженной системе.
Однако уже давно ставится под сомнение, действительно ли циклопентадиенильный катион является антиароматическим, и недавние открытия предполагают, что это может быть не так. Самая низкая энергия синглетное состояние является антиароматическим, но с наименьшей энергией триплетное состояние ароматный благодаря Правило Бэрда, а исследования 2007 г. показали, что триплетное состояние является основное состояние.[13]
Циклооктатетраен
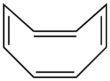
Еще один пример молекулы, которая не является антиароматической, хотя на первый взгляд может показаться таковой: циклооктатетраен. Циклооктатетраен принимает форму ванны (т. Е. Лодочки). Поскольку он не плоский, хотя у него 4п π-электроны, эти электроны не делокализованы и не сопряжены. Следовательно, молекула неароматическая.[3]
Влияние на реактивность
Антиароматические соединения, часто очень нестабильные, могут обладать высокой реакционной способностью, чтобы уменьшить антиароматическую дестабилизацию. Циклобутадиен, например, быстро димеризуется без потенциального энергетического барьера через реакцию циклоприсоединения 2 + 2 с образованием трициклооктадиена.[14] В то время как антиароматический характер циклобутадиена является предметом споров, уменьшение антиароматичности обычно рассматривается как движущая сила этой реакции.

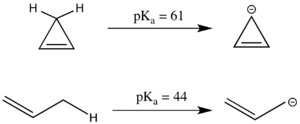
Антиароматичность также может оказывать значительное влияние на р.Kа. Линейное соединение пропена имеет pKа 44, что является относительно кислым для зр.3 углеродный центр, поскольку образующийся аллильный анион может быть стабилизирован резонансом. Аналогичная циклическая система, кажется, еще более стабилизирована по резонансу, поскольку отрицательный заряд может быть делокализован по трем атомам углерода вместо двух. Однако циклопропенильный анион имеет 4 π-электронов в циклической системе и фактически имеет существенно выше пKа чем 1-пропен, потому что он антиароматический и, следовательно, дестабилизирован.[3] Поскольку антиароматические соединения часто недолговечны и с ними трудно работать экспериментально, энергия антиароматической дестабилизации часто моделируется путем моделирования, а не экспериментирования.[2]
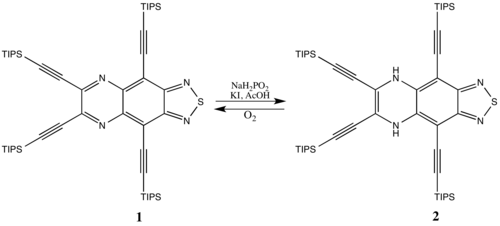
Некоторые антиароматические соединения стабильны, особенно большие циклические системы (в которых антиароматическая дестабилизация не так существенна). Например, ароматические виды 1 можно свести к 2 с относительно небольшим штрафом за формирование антиароматической системы. Антиароматический 2 возвращается к ароматическим видам 1 с течением времени за счет реакции с кислородом воздуха, потому что ароматичность предпочтительна.[15]
Потеря антиароматичности иногда может быть движущей силой реакции. В следующей таутомеризации кето-енола продукт енол более стабилен, чем исходный кетон, даже если кетон содержит ароматический бензольный фрагмент (синий). Однако есть также антиароматический лактонный фрагмент (зеленый). Облегчение антиароматической дестабилизации обеспечивает движущую силу, которая перевешивает даже потерю ароматического бензола.[16]

Рекомендации
- ^ «Золотая книга ИЮПАК: антиароматичность». Получено 27 октября 2013.
- ^ а б c d е ж Ву, Джуди И-Чиа; Мо, Иронг; Евангелиста, Франческо Альфредо; фон Раге Шлейер, Пол (2012). «Неужели циклобутадиен сильно дестабилизирован антиароматичностью?». Химические коммуникации. 48 (67): 8437–9. Дои:10.1039 / c2cc33521b. ISSN 1359-7345. PMID 22801355. S2CID 19920318.
- ^ а б c d е Анслин, Эрик В. (2006). Современная физико-органическая химия. Книги университетских наук. ISBN 978-1-891389-31-3.
- ^ Бреслоу, Рональд; Браун, Джон; Гаевский, Джозеф Дж. (Август 1967 г.). «Антиароматичность циклопропенильных анионов». Журнал Американского химического общества. 89 (17): 4383–4390. Дои:10.1021 / ja00993a023.
- ^ Moss, G.P .; Смит, П. А. С .; Тавернье, Д. (1995). «Глоссарий названий классов органических соединений и промежуточных продуктов реакционной способности на основе структуры». Чистая и прикладная химия. 67: 1307–1375. Дои:10.1351 / pac199567081307.
- ^ а б Podlogar, Brent L .; Уильям А. Глаузер; Уолтер Р. Родригес; Дуглас Дж. Рабер (1988). «Конформационный критерий ароматичности и антиароматичности». Журнал органической химии. 53 (9): 2127–2129. Дои:10.1021 / jo00244a059.
- ^ Бреслоу, Рональд (декабрь 1973 г.). «Антиароматичность». Отчеты о химических исследованиях. 6 (12): 393–398. Дои:10.1021 / ar50072a001.
- ^ Алькорта, Ибон; Розас, Изабель; Эльгеро, Хосе (июнь 1992 г.). «Неэмпирическое исследование свойств ЯМР (абсолютное экранирование и NICS) ряда важных ароматических и антиароматических соединений». Тетраэдр. 118 (28): 880–885. Дои:10.1016 / S0040-4020 (01) 00585-3.
- ^ Что такое ароматичность? Пол фон Раге Шлейер и Хайцзюнь Цзяо. Чистая и прикладная химия. Vol. 68, No. 2, pp. 209-218, 1996 Связь
- ^ Юселиус, Йонас; Дейдж Сандхольм (2008). «Полициклические антиароматические углеводороды». Физическая химия Химическая физика. 10 (44): 6630–6634. Bibcode:2008PCCP ... 10.6630J. Дои:10.1039 / b808082h. PMID 18989474. S2CID 8205257.
- ^ Лю, Биньяо; Вэй Шэнь; Сяохуа Се; Лидан Дэн; Мин Ли (август 2011 г.). «Теоретический анализ геометрии и электронного строения антиароматического пенталена и его N-замещенных производных: мономеров, олигомеров и полимеров». Журнал физической органической химии. 25 (4): 278–286. Дои:10.1002 / poc.1907.
- ^ Юселиас, Йонас; Дейдж Сандхольм (2001). «Ароматичность и антиароматичность дегидроаннуленов». Физическая химия Химическая физика. 3 (12): 2433–2437. Bibcode:2001PCCP .... 3.2433J. Дои:10.1039 / B101179K.
- ^ Wörner HJ; Merkt F (июль 2007 г.). «Бирадикалы, антиароматичность и эффект псевдо-Яна-Теллера: электронные и ровибронные структуры циклопентадиенильного катиона». Журнал химической физики. 127 (3): 034303. Bibcode:2007JChPh.127c4303W. Дои:10.1063/1.2748049. PMID 17655439.
- ^ Йи, Ли; К. Н. Хоук (июль 2001 г.). "Димеризация циклобутадиена. Теоретическое исследование ab Initio CASSCF". Журнал Американского химического общества. 57: 6043–6049. Дои:10.1016 / S0040-4020 (01) 00585-3.
- ^ Мяо, Шаобинь (2007). «N, N-дигидрохиноксалин, конденсированный с тиадиазолом: антиароматический, но выделяемый». Органические буквы. 9 (6): 1073–1076. Дои:10.1021 / ol070013i. PMID 17309273.
- ^ Лоуренс, Энтони Дж .; Хатчингс, Майкл Дж .; Кеннеди, Алан Р .; Макдуалл, Джозеф Дж. У. (2010). «Бензодифурантрион: стабильный фенилогенный енол». Журнал органической химии. 75 (3): 690–701. Дои:10.1021 / jo9022155. PMID 20055373.
