Спиновые изомеры водорода - Spin isomers of hydrogen

Молекулярный водород происходит в двух изомерный формы, одна с двумя протонами ядерные спины выровнен параллельно (ортоводород), другой с двумя его протонными спинами выровнен антипараллельно (параводород).[1] Эти две формы часто называют спиновыми изомерами.[2]
Параводород находится в более низком энергетическом состоянии, чем ортоводород. В комнатная температура и тепловое равновесие тепловое возбуждение приводит к тому, что водород состоит примерно на 75% из ортоводорода и на 25% из параводорода. Когда водород сжижается при низкой температуре, происходит медленный самопроизвольный переход к преимущественно пара-соотношению, при этом выделяемая энергия имеет значение для хранения. По существу чистая форма параводорода может быть получена при очень низких температурах, но невозможно получить образец, содержащий более 75% ортоводорода, путем нагревания.
Смесь или смесь орто- и параводорода в соотношении 50:50 может быть получена в лаборатории, пропуская ее через катализатор на основе оксида железа (III) при температуре жидкий азот температура (77 К)[3] или хранением водорода при 77 К в течение 2–3 часов в присутствии активированного угля.[4] В отсутствие катализатора параводороду в газовой фазе требуются дни, чтобы релаксировать до нормального водорода при комнатной температуре, тогда как в органических растворителях для этого требуются часы.[4]
Ядерные спиновые состояния H2
Эта секция может быть слишком техническим для большинства читателей, чтобы понять. Пожалуйста помогите улучшить это к сделать понятным для неспециалистов, не снимая технических деталей. (Май 2015 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Каждый водород молекула (ЧАС2) состоит из двух атомы водорода связаны Ковалентная связь. Если пренебречь небольшой долей дейтерий и тритий которые могут присутствовать, каждый атом водорода состоит из одного протон и один электрон. Каждому протону соответствует магнитный момент, что связано со спином протона 1/2. В H2 молекулы, спины двух ядер водорода (протонов) соединяются, образуя триплетное состояние известный как ортоводород, а синглетное состояние известный как параводород.
Состояние триплетного ортоводорода имеет полный ядерный спин I = 1, так что компонент вдоль определенной оси может иметь три значения Mя = 1, 0 или -1. Соответствующие волновые функции ядерного спина: , и . Это использует стандартные обозначение бюстгальтера; символ ↑ обозначает раскрутку вверх волновая функция а символ ↓ - волновая функция со спином вниз, поэтому ↑ ↓ означает, что первое ядро находится вверху, а второе - вниз. Тогда каждый энергетический уровень ортоводорода имеет (ядерный) спин вырождение трех, что означает, что он соответствует трем состояниям с одинаковой энергией (в отсутствие магнитного поля).[1] Синглетное параводородное состояние имеет квантовые числа ядерного спина I = 0 и Mя = 0, с волновой функцией . Поскольку существует только одна возможность, каждый уровень параводорода имеет вырождение спина, равное единице, и называется невырожденным.[1]
Допустимые уровни энергии вращения
Поскольку протоны имеют спин 1/2, они фермионы и пермутационная антисимметрия полной H2 волновая функция накладывает ограничения на возможные вращательные состояния, две формы H2.[1] Ортоводород с симметричными функциями ядерного спина может иметь только вращательные волновые функции, антисимметричные по отношению к перестановке двух протонов, соответствующие нечетным значениям вращательное квантовое число J; и наоборот, параводород с антисимметричной функцией ядерного спина может иметь только вращательные волновые функции, симметричные относительно перестановки двух протонов, соответствующие даже J.[1]
Пара-форма, нижний уровень которой J = 0, более устойчива на 1,455 кДж / моль.[5] [6] чем ортоформа, нижний уровень которой J = 1. Соотношение между числами орто- и пара-молекул составляет примерно 3: 1 при стандартная температура где много вращательных энергетических уровней заселены, что благоприятствует орто-форме за счет тепловой энергии. Однако при низких температурах заметно заселяется только уровень J = 0, так что параформа доминирует при низких температурах (примерно 99,8% при 20 K).[7] В теплота испарения составляет всего 0,904 кДж / моль. В результате орто-жидкий водород, уравновешенный параформой, выделяет достаточно энергии, чтобы вызвать значительные потери при кипении.[5]
Тепловые свойства
Эта секция требует дополнительных цитаты к вторичные или третичные источники (Май 2015 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Применяя жесткий ротор В приближении энергии и вырождения вращательных состояний даются как:[8][страница нужна ]
- .
Вращательный функция распределения условно записывается как:[нужна цитата ]
- .
Однако, пока два спиновых изомера не находятся в равновесии, более полезно записать отдельные статистические суммы для каждого:[нужна цитата ]
Множитель 3 в статистической сумме для ортоводорода учитывает вырождение спина, связанное со спиновым состоянием +1; когда возможно равновесие между спиновыми изомерами, то общая статистическая сумма, учитывающая эту разницу вырожденности, может быть записана как:[нужна цитата ]
Молярные энергии вращения и теплоемкости для любого из этих случаев выводятся из:[нужна цитата ]
Графики, показанные здесь, представляют собой молярные энергии вращения и теплоемкости для орто- и параводорода, а также "нормальных" орто / пара (3: 1) и равновесных смесей:[нужна цитата ]

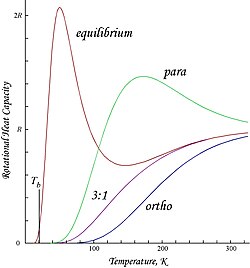
Из-за налагаемого антисимметрией ограничения на возможные вращательные состояния ортоводород имеет остаточную вращательную энергию при низкой температуре, при которой почти все молекулы находятся в состоянии J = 1 (молекулы в симметричном спин-триплетном состоянии не могут попасть в самое низкое, симметричное вращательное состояние. ) и обладает ядерным спином энтропия из-за трехкратного вырождения триплетного состояния.[нужна цитата ] Остаточная энергия важна, потому что уровни энергии вращения относительно широко разнесены в H2; разрыв между первыми двумя уровнями, выраженный в единицах температуры, вдвое превышает характеристику вращательная температура для ч2:[нужна цитата ]
- .
Это точка пересечения T = 0 в молярной энергии ортоводорода. Поскольку «нормальный» водород при комнатной температуре представляет собой орто: пара смесь 3: 1, его молярная остаточная энергия вращения при низкой температуре составляет (3/4) × 2Rθ.гнить ≈ 1091 Дж / моль,[нужна цитата ] что несколько больше, чем энтальпия испарения нормального водорода, 904 Дж / моль при температуре кипения, Тб ≈ 20,369 К.[9] Примечательно, что точки кипения параводорода и нормального (3: 1) водорода почти равны; для параводорода ∆Hvap ≈ 898 Дж / моль при Tб ≈ 20,277 К, и отсюда следует, что почти вся остаточная энергия вращения ортоводорода сохраняется в жидком состоянии.[нужна цитата ]
Однако ортоводород термодинамически нестабилен при низких температурах и самопроизвольно превращается в параводород.[10] В этом процессе отсутствует какой-либо естественный режим излучения девозбуждения, поэтому он протекает медленно в отсутствие катализатора, который может способствовать взаимному преобразованию синглетного и триплетного спиновых состояний.[11] При комнатной температуре водород содержит 75% ортоводорода, пропорцию, которую сохраняет процесс сжижения, если его проводят в отсутствие катализатор подобно оксид железа, Активированный уголь, платинированный асбест, редкоземельные металлы, соединения урана, оксид хрома, или некоторые соединения никеля для ускорения превращения жидкий водород в параводород. В качестве альтернативы можно использовать дополнительное холодильное оборудование для медленного поглощения тепла, которое фракция ортоводорода будет (более медленно) выделять, когда она самопроизвольно превращается в параводород.[нужна цитата ] Если ортоводород не удаляется из быстро сжиженного водорода без катализатора, тепло, выделяющееся при его распаде, может испарить до 50% исходной жидкости.
История
Необычная теплоемкость водорода была открыта в 1912 г. Арнольд Ойкен.[12] Две формы молекулярного водорода были впервые предложены Вернер Гейзенберг и Фридрих Хунд в 1927 году. Принимая во внимание эту теоретическую основу, чистый параводород был впервые синтезирован Пол Хартек и Карл Фридрих Бонхёффер в 1929 г.[13] Когда Гейзенбергу в 1932 году была присуждена Нобелевская премия по физике за создание квантовой механики, это открытие «аллотропных форм водорода» было выделено как наиболее примечательное ее применение.[14] Современное выделение чистого параводорода с тех пор было достигнуто с помощью быстрого осаждения в вакууме твердого параводорода толщиной в миллиметры (p – H2) образцы, которые отличаются превосходными оптическими качествами.[15]
Использование в ЯМР
Когда используется избыток параводорода во время гидрирование реакции (вместо обычной смеси ортоводорода с параводородом 3: 1) полученный продукт показывает гиперполяризованный сигналы в протоне ЯМР спектров, эффект, названный PHIP (параводородная поляризация) или, что эквивалентно, PASADENA (параводород и синтез позволяют значительно улучшить ядерное выравнивание); назван так в честь первого признания эффекта Бауэрсом и Вайтекампом из Калтех ),[16][нужна цитата ] явление, которое было использовано для изучения механизма реакций гидрирования.[17][18]
Усиление сигнала путем обратимого обмена (SABRE) - это метод гиперполяризовать образцы без их химического изменения. По сравнению с ортоводородом или органическими молекулами, гораздо большая часть ядер водорода в параводороде совмещена с приложенным магнитным полем. В SABRE металлический центр обратимо связывается как с исследуемой молекулой, так и с молекулой параводорода, облегчая целевую молекулу улавливать поляризацию параводорода.[19] Этот метод можно улучшить и использовать для широкого диапазона органических молекул, используя промежуточную «ретрансляционную» молекулу, такую как аммиак. Аммиак эффективно связывается с металлическим центром и улавливает поляризацию параводорода. Затем аммиак переносит другие молекулы, которые не связываются также с металлическим катализатором.[20] Этот усиленный сигнал ЯМР позволяет быстро анализировать очень небольшие количества материала.
Дейтерий
Двухатомный дейтерий (D2) имеет ядерные спиновые изомеры, такие как двухатомный водород, но с разными населенностями этих двух форм, поскольку ядро дейтерия (дейтрон) является бозон с ядерным спином, равным единице.[21] Существует шесть возможных волновых функций ядерных спинов, которые являются орто- или симметричными по отношению к обмену двух ядер, и три являются пара- или антисимметричными.[21] Орто-состояния соответствуют четным вращательным уровням с симметричными вращательными функциями, так что полная волновая функция является симметричной, как требуется для обмена двумя бозонами, а пара-состояния соответствуют нечетным вращательным уровням.[21] Основное состояние (J = 0), заселенное при низкой температуре, является орто, а при стандартной температуре соотношение орто: пара составляет 2: 1.[21]
Другие вещества со спиновыми изомерами
Другие молекулы и функциональные группы, содержащие два атома водорода, такие как воды и метилен, также имеют орто- и пара-формы (например, орто-вода и пара-вода), но это не имеет большого значения для их тепловых свойств.[22] Их орто-пара-отношения отличаются от соотношения дигидрогена.
Молекулярный кислород (О
2) также существует в трех триплетных состояниях с более низкой энергией и в одном синглетном состоянии, как парамагнитное состояние основного состояния. триплетный кислород и под напряжением высокореактивный диамагнитный синглетный кислород. Эти состояния возникают из-за спинов их неспаренные электроны а не их протоны или ядра.
Рекомендации
- ^ а б c d е П. Аткинс и Дж. Де Паула, Аткинс Физическая химия, 8-е издание (W.H.Freeman 2006), стр. 451–2 ISBN 0-7167-8759-8
- ^ Matthews, M.J .; Petitpas, G .; Асевес, С. (2011). «Исследование кинетики конверсии спиновых изомеров в сверхкритическом жидком водороде для технологий хранения криогенного топлива». Appl. Phys. Латыш. 99 (8): 081906. Bibcode:2011АпФЛ..99х1906М. Дои:10.1063/1.3628453.
- ^ Мацумото, Мицуру; Эспенсон, Джеймс Х. (2005). «Кинетика взаимного превращения параводорода и ортоводорода, катализируемого парамагнитными комплексными ионами». Журнал Американского химического общества. 127 (32): 11447–11453. Дои:10.1021 / ja0524292. ISSN 0002-7863. PMID 16089474.
- ^ а б Аруланда, Кристи; Старовойтова, Лариса; Кане, Даниэль (2007). «Продольная ядерная спиновая релаксация орто- и пара-водорода, растворенного в органических растворителях». Журнал физической химии A. 111 (42): 10615–10624. Bibcode:2007JPCA..11110615A. Дои:10.1021 / jp073162r. ISSN 1089-5639. PMID 17914761.
- ^ а б "Die Entdeckung des para-Wasserstoffs (Открытие пара-водорода)". Max-Planck-Institut für Biophysikalische Chemie (на немецком). Получено 9 ноября 2020.
- ^ Ривз, Роберт Б.; Хартек, Пол (1979). «Орто и параводород в межзвездном материале». Zeitschrift für Naturforschung A. 34а: 163–166. Получено 9 ноября 2020.
В этом источнике указано 0,34 ккал / моль (= 1,4 кДж / моль).
- ^ Рок, Питер А., Химическая термодинамика; принципы и приложения (Macmillan 1969) Таблица на стр. 478 показывает (Nо/ Nп)ЧАС2 = 0,002 при 20 К ISBN 1-891389-32-7
- ^ Ф. Т. Уолл (1974). Химическая термодинамика, 3-е издание. В. Х. Фриман и компания
- ^ «Теплофизические свойства жидкостных систем». Webbook.nist.gov. Получено 2015-05-14.
- ^ Миленко, Ю. Я .; Сибилева, Р. М .; Стржемечный, М.А. (01.04.1997). «Скорость естественной орто-пара конверсии в жидком и газообразном водороде». Журнал физики низких температур. 107 (1): 77–92. Дои:10.1007 / BF02396837. ISSN 1573-7357.
- ^ Миленко, Ю. Я .; Сибилева, Р. М .; Стржемечный, М.А. (01.04.1997). «Скорость естественной орто-пара конверсии в жидком и газообразном водороде». Журнал физики низких температур. 107 (1): 77–92. Дои:10.1007 / BF02396837. ISSN 1573-7357.
- ^ А. Ойкен, «Die Molekularwärme des Wasserstoffs bei tiefen Temperaturen.» Königlich Preußische Akademie der Wissenschaften (Берлин). Sitzungsberichte (1912): S. 141–151.
- ^ Майкл Поланьи и его поколение: истоки социального построения науки Мэри Джо Най, Чикагский университет Press (2011), стр.119 ISBN 0-226-61065-9
- ^ Вернер Гейзенберг - Факты Nobelprize.org
- ^ https://web.archive.org/web/20120831182954/http://www.stormingmedia.us/72/7208/A720893.html
- ^ Bowers, C. R .; Вайтекамп, Д. П. (1986). «Преобразование порядка симметризации в намагниченность ядерного спина путем химической реакции и ядерного магнитного резонанса» (PDF). Письма с физическими проверками. 57 (21): 2645–2648. Bibcode:1986ПхРвЛ..57.2645Б. Дои:10.1103 / Physrevlett.57.2645. PMID 10033824.
- ^ Duckett, S.B .; Мьюис (2013). Повышение чувствительности ЯМР и МРТ с помощью параводорода. Вершина. Curr. Chem. Темы современной химии. 338. С. 75–103. Дои:10.1007/128_2012_388. ISBN 978-3-642-39727-1. PMID 23138689.
- ^ Adams, R.W .; Агилар, Дж. А .; Аткинсон, К. Д .; Cowley, M. J .; Elliott, P. I .; Duckett, S.B .; Green, G.G .; Khazal, I.G .; Лопес-Серрано, Дж .; Уильямсон, Д. К. (2009). «Обратимые взаимодействия с параводородом повышают чувствительность ЯМР за счет передачи поляризации» (PDF). Наука. 323 (5922): 1708–11. Bibcode:2009Научный ... 323.1708А. Дои:10.1126 / science.1168877. PMID 19325111.
- ^ Эшуйс, Нан; Aspers, Ruud L.E.G .; van Weerdenburg, Bram J.A .; Feiters, Martin C .; Rutjes, Floris P.J.T .; Wijmenga, Sybren S .; Тессари, Марко (2016). «Определение дальнодействующих скалярных констант связи 1 H– 1 H, ответственных за передачу поляризации в SABRE». Журнал магнитного резонанса. 265: 59–66. Bibcode:2016JMagR.265 ... 59E. Дои:10.1016 / j.jmr.2016.01.012. ISSN 1090-7807. PMID 26859865.
- ^ Иали, Виссам; Райнер, Питер Дж .; Дакетт, Саймон Б. (2018). «Использование параводорода для гиперполяризации аминов, амидов, карбоновых кислот, спиртов, фосфатов и карбонатов». Достижения науки. 4 (1): eaao6250. Bibcode:2018SciA .... 4O6250I. Дои:10.1126 / sciadv.aao6250. ISSN 2375-2548. ЧВК 5756661. PMID 29326984.
- ^ а б c d Холлас, Дж. Майкл (1996). Современная спектроскопия (3-е изд.). Джон Уайли и сыновья. п. 115. ISBN 0-471-96523-5.
- ^ Шиницкий, Меир; Элицур, Авшалом С. (2006). «Орто-пара-спиновые изомеры протонов метиленовой группы». Хиральность. 18 (9): 754–756. Дои:10.1002 / chir.20319. PMID 16856167.
дальнейшее чтение
- Алин Леон, Эд. 2008 г., Водородная технология: мобильные и портативные приложения, стр. 93–101, Нью-Йорк, штат Нью-Йорк: Springer Science & Business, ISBN 3-540-69925-2, видеть [1], по состоянию на 10 мая 2015 г.
- Тихонов В. И., Волков А. А. (2002). «Разделение воды на орто- и пара-изомеры». Наука. 296 (5577): 2363. Дои:10.1126 / science.1069513. PMID 12089435.
- Марио Э. Фахардо; Саймон Тэм (1997). Быстрое осаждение из паровой фазы оптически прозрачных твердых образцов параводорода миллиметровой толщины для спектроскопии матричной изоляции. Эдвардс AFB (Западное управление двигательной установки): Исследовательская лаборатория ВВС США.CS1 maint: несколько имен: список авторов (связь)[страница нужна ]
- Bowers, C. R .; Вайтекамп, Д. П. (1986). «Преобразование порядка симметризации в намагниченность ядерного спина путем химической реакции и ядерного магнитного резонанса» (PDF). Phys. Rev. Lett. 57 (21): 2645–2648. Bibcode:1986ПхРвЛ..57.2645Б. Дои:10.1103 / Physrevlett.57.2645. PMID 10033824.
- А. Фаркаш (1935). Ортоводород, параводород и тяжелый водород. Кембриджская серия по физической химии. Кембридж, Великобритания:ЧАШКА.[страница нужна ]
- Bonhoeffer KF, Harteck P (1929). «Пара- и орто-водород». Zeitschrift für Physikalische Chemie B. 4 (1–2): 113–141.
- Oxford Instruments, дата неизвестна, «Повышение чувствительности ЯМР-спектроскопии с использованием параводорода»










