Туникамицин - Tunicamycin
 | |
| Имена | |
|---|---|
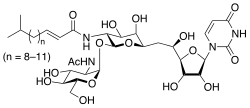
| Название ИЮПАК (E) -N - [(2S, 3R, 4R, 5R, 6R) -2 - [(2R, 3R, 4R, 5S, 6R) - 3-ацетамидо-4,5-дигидрокси-6- (гидроксиметил) оксан-2-ил] окси-6- [2 - [(2R, 3S, 4R, 5R) -5- (2,4-диоксопиримидин-1- ил) -3,4-дигидроксиоксолан-2-ил] -2-гидроксиэтил] -4,5-дигидроксиоксан- 3-ил] -5-метилгекс-2-енамид | |
| Другие имена NSC 177382 | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ECHA InfoCard | 100.115.295 |
| MeSH | Туникамицин |
PubChem CID | |
| UNII | |
| |
| Характеристики | |
| C39ЧАС64N4О16 | |
| Молярная масса | Нет данных |
| Опасности | |
| R-фразы (устарело) | 28 |
| S-фразы (устарело) | 28-37/39-45 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Эта статья может быть слишком техническим для большинства читателей, чтобы понять. Пожалуйста помогите улучшить это к Сделайте это понятным для неспециалистов, не снимая технических деталей. (Октябрь 2020) (Узнайте, как и когда удалить этот шаблон сообщения) |
Туникамицин представляет собой смесь гомологичный нуклеозид антибиотики который ингибирует семейство ферментов UDP-HexNAc: polyprenol-P HexNAc-1-P. У эукариот это включает фермент GlcNAc фосфотрансферазу (GPT), который катализирует перенос N-ацетилглюкозамин-1-фосфата из UDP-N-ацетилглюкозамин в долихолфосфат на первом этапе гликопротеин синтез. Блокады туникамицина N-связанное гликозилирование (N-гликаны) и лечение культивированных клеток человека с помощью туникамицина вызывает клеточный цикл арестовать в Фаза G1. Он используется как экспериментальный инструмент в биология, например побудить развернутый белковый ответ.[1] Туникамицин производится несколькими бактерии, включая Streptomyces clavuligerus и Streptomyces lysosuperificus.
Гомологи туникамицина имеют различную молекулярную массу из-за вариабельности конъюгатов боковых цепей жирных кислот.[2]
Биосинтез
Биосинтез туникамицинов изучался в Streptomyces chartreusis и был охарактеризован предлагаемый путь биосинтеза. Бактерии используют ферменты в тун кластер генов (TunA-N) для производства туникамицинов.[3]
TunA использует стартовый элемент уридиндифосфат-N-ацетил-глюкозамин (UDP-GlcNAc) и катализирует дегидратацию 6 ’гидроксильной группы. Во-первых, остаток Tyr в TunA отрывает протон от 4 ’гидроксильной группы, образуя кетон в этом положении. Затем гидрид отщепляется от 4 ’углерода с помощью НАД +, образуя НАДН. Кетон стабилизирован водородными связями из остатка Tyr и ближайшего остатка Thr. Затем остаток глутамата отрывает протон от 5 ’углерода, подталкивая электроны вверх, образуя двойную связь между 5’ и 6 ’углеродом. Близлежащий цистеин отдает протон гидроксильной группе, когда уходит в виде воды. НАДН отдает гидрид 4 ’углерода, преобразовывая гидроксид в этом положении и образуя UDP-6’-дезокси-5-6-ен-GlcNAc. Затем TunF катализирует эпимеризацию промежуточного соединения до UDP-6’-дезокси-5-6-ен-GalNAc, изменяя 4 ’гидроксил из экваториального в аксиальное положение.[4]
Другой стартовый элемент для туникамицина - уридин, который вырабатывается из уридинтрифосфата (UTP). TunN представляет собой нуклеотиддифосфатазу и катализирует удаление пирофосфата из UTP с образованием уридинмонофосфата. Последний фосфат удаляется предполагаемой монофосфатазой TunG.
Как только уридин и UDP-6’-дезокси-5-6-ен-GalNAc образуются, TunB катализирует их связывание на 6’-углеродном атоме UDP-6’-дезокси-5-6-ен-GalNAc. TunB использует S-аденилметионин (SAM) для образования радикала на 5 ’углероде рибозы урацила. Считается, что TunM катализирует образование новой связи между 5'-атомом углерода уридина и 6'-атомом углерода UDP-6'-дезокси-5-6-ен-GalNAc с использованием электрона от радикала уридина и одного из электронов. от двойной связи UDP-6'-дезокси-5-6-ен-GalNAc. Затем радикал UDP-6’-дезокси-5-6-ен-GalNAc гасится путем отвода водорода от SAM.[5] Полученная молекула представляет собой UDP-N-ацетилтуникамин. Затем TunH катализирует гидролиз UDP из UDP-N-ацетилтуникамина. Вводится другая молекула UDP-GlcNAc, и впоследствии образуется β-1,1-гликозидная связь, катализируемая TunD. Полученная молекула деацетилируется TunE. TunL и жирная ацил-ACP-лигаза используются для загрузки метаболических жирных кислот на белок-носитель ацила, TunK. Затем TunC присоединяет жирную кислоту к свободному амину, образуя туникамицин.
Смотрите также
- Гликозилирование - туникамицин блокирует все N-гликозилирование белков
- Гликопротеин
- Streptomyces род
Рекомендации
- ^ Белки оболочки вируса гепатита С регулируют СНОР путем индукции ...
- ^ [1] Подробная информация о продукте Тунамицина]
- ^ Вышинский, Филип; Хескет, Эндрю; Бибб, Мервин; Дэвис, Бенджамин (2010). «Рассечение биосинтеза туникамицина путем добычи генома: клонирование и гетерологичная экспрессия минимального кластера генов». Химическая наука. 1 (5): 581. Дои:10.1039 / c0sc00325e.
- ^ Вышинский, Филип; Ли, Сын; Ябэ, Томоаки; Ван, Хуа; Гомес-Эскрибано, Хуан Пабло; Бибб, Мервин (июль 2012 г.). «Биосинтез туникамициновых антибиотиков происходит через уникальные экзогликемические промежуточные соединения». Химия природы. 4 (7): 539–546. Дои:10.1038 / nchem.1351. PMID 22717438.
- ^ Гизе, Бернд (август 1989 г.). «Стереоселективность межмолекулярных свободнорадикальных реакций [Новые методы синтеза (78)]». Angewandte Chemie International Edition на английском языке. 28 (8): 969–980. Дои:10.1002 / anie.198909693.
внешняя ссылка
- Книжный раздел Основы гликобиологии (1999) Туникамицин: ингибирование сборки DOL-PP-GlcNAc
- Технический паспорт туникамицина подготовил студент Открытого университета, Великобритания
