Аминоаллильный нуклеотид - Aminoallyl nucleotide

Аминоаллильный нуклеотид представляет собой нуклеотид с модифицированным основанием, содержащий аллиламин. Они используются для пост-маркировки нуклеиновые кислоты к флуоресценция обнаружение в микрочип. Они реагируют с N-гидроксисукцинимид сложноэфирная группа, которая помогает прикрепить флуоресцентный краситель к первичной аминогруппе нуклеотида. Эти нуклеотиды известны как 5- (3-аминоаллил ) -нуклеотиды, поскольку аминоаллильная группа обычно присоединена к углероду 5 пиримидин кольцо урацил или цитозин. Главная амин группа в аминоаллильном фрагменте алифатический и, следовательно, более реакционноспособны по сравнению с аминогруппами, которые непосредственно присоединены к кольцам (ароматный ) баз. Общие названия аминоаллила нуклеозиды первоначально сокращенно обозначают aa- или AA- для обозначения аминоаллила. 5-углеродный сахар обозначается строчной буквой "d" или без нее. дезоксирибоза если включено или рибоза если не. Наконец азотистая основа и количество фосфаты указаны (т.е. aa-UTP = аминоаллил уридин трифосфат ).
История

Целью комбинирования флуоресценции и нуклеиновых кислот было обеспечение отсутствияизотопический тег, который можно обнаружить для изучения ДНК или РНК. Этот тип маркировки позволяет ученым изучать структуру, функцию или образование ДНК или РНК с другими нуклеиновыми кислотами.[2] Первая модификация основания для флуоресцентного мечения произошла в 1971 г. 4-тиуридин и 4-тиоурацил.[3] Это исследование, наряду с другими, включало различные виды прямого и непрямого маркирования посредством: аналоги, добавление с помощью ферментов или другие методы сделали маркировку нуклеотидов намного более безопасной для ученых при изучении ДНК.[2]
Поскольку приборы и технологии становятся все более продвинутыми в области Микрочип ДНК, для дальнейших научных исследований потребуются более совершенные реагенты и методы. Флуоресцентная маркировка Cy3 оказались более недостаточными и искаженными результатами; Вместо этого был выбран метод включения аминоаллильных нуклеотидов. Использование аминоаллильных нуклеотидов в качестве непрямого флуоресцентного мечения, по-видимому, сводило на нет проблемы чувствительности, наблюдаемые в цианиновая маркировка.[4]
Синтез
Аминоаллил нуклеозиды возможно синтезированный через Черт возьми как показано на изображении ниже.[5]
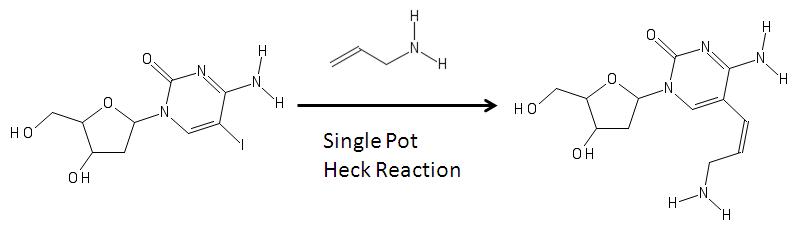
На изображении выше слева - модифицированный нуклеозид с йод (йод добавляется через электрофильное галогенирование ) в пятом углероде пиримидинового кольца. Его образование может быть связано с реакцией с аллиламином, и различные реагенты посредством чертовского сочетания способны удалить галоген группу от основания и добавьте аллиламин, чтобы получился аминоаллильный нуклеозид, показанный справа.[5] Затем продукт справа используется для молекулярная биология в синтезе РНК.[4][6][7]
Другие реакции включают использование одинарный синтез с другим галогены.[8]
Реакция
Первичный амин аминоаллильного нуклеотида реагирует с аминореактивными красителями. [9] например, цианин и запатентованные красители[10][11] которые содержат реактивную уходящую группу, такую как сукцинимидиловый эфир (NHS Аминные группы, непосредственно связанные с кольцом основания, не затрагиваются. Эти нуклеотиды используются для маркировки ДНК.[4][6][10][11][12]
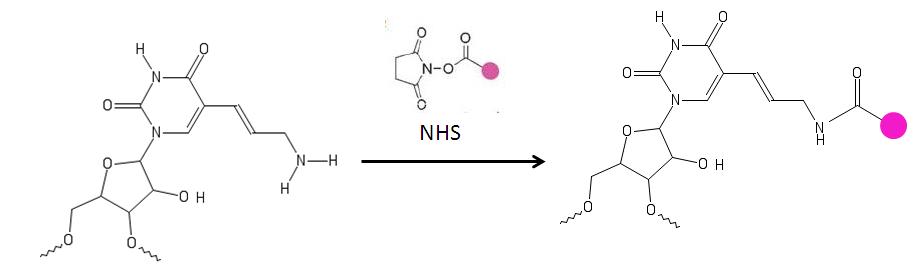
Использует
Аминоаллильные NTP используются для непрямого мечения ДНК в ПЦР, ник перевод, удлинители грунтовки и кДНК синтез.[13] Эти меченые NTP полезны, потому что они применяются в лабораториях молекулярной биологии, где они не могут работать с радиоактивными материалами. Например, 5- (3-аминоаллил) -уридин (AA-UTP) более эффективны для мечения ДНК с высокой плотностью, чем предварительное мечение ДНК. После ферментативного добавления NTP для обнаружения молекулы ДНК могут быть добавлены флуоресцентные красители с аминным реагентом.[7] При включении в молекулы ДНК или РНК ДНК / РНК полимераза, 5- (3-аминоаллил) -UTP обеспечивает реактивную группу для добавления других химических групп. Таким образом, аминоаллил-модифицированная ДНК или РНК может быть помечена любым соединением, которое имеет амино-реактивную группу. Aa-NTP, включенные в ДНК / РНК в комбинации с реагентами связывания вторичных красителей, могут использоваться для анализа матрицы.[6]
кДНК полагается на аминоаллильное мечение для целей обнаружения. Хотя прямое мечение dNTP является самым быстрым и дешевым методом флуоресцентного мечения, оно невыгодно, поскольку последовательность позволяет использовать только один модифицированный нуклеотид. Другой недостаток прямого мечения - это громоздкие нуклеотиды, однако его можно преодолеть путем непрямого мечения с использованием аминоаллил-модифицированных нуклеотидов.[14] Легкий способ проверить успешность маркировки - это цвет; Хорошая маркировка приведет к видимому синему (Cy5) или красному (Cy3) цвету в конечном материале.[15]

Другой процесс, в котором используется аминоаллильное мечение, - это НАСБА (Амплификация на основе нуклеиновых кислот), высокочувствительный метод амплификации РНК. В этом конкретном случае РНК, модифицированные aaUTP, были помечены флуоресцентным маркером Cy3. NASBA в сочетании с маркировкой аминоаллил-UTP очень полезен для многих различных областей микробной диагностики, включая мониторинг окружающей среды, обнаружение биологических угроз, мониторинг промышленных процессов и клиническую микробиологию.[16] ДНК-микрочипы - это еще один метод, в котором специально используется AA-NTP, что позволяет быстрее и дешевле проводить тестирование ДНК-микрочипов.[12]
Мечение после синтеза позволяет избежать проблем, обнаруженных при прямом ферментативном включении Cy-меченных дНТФ, путем создания зондов с одинаковой эффективностью мечения. При непрямой маркировке NTP, модифицированные амином, включаются во время обратная транскрипция, Амплификация РНК, или ПЦР. Аминоаллил-NTP встраиваются с такой же эффективностью, как и немодифицированные NTP, во время полимеризации.[17][18]
Проблемы с маркировкой: аминогруппа в аминоаллил-модифицированном нуклеотиде реагирует с красителями, такими как цианиновый ряд, или другими запатентованными красителями. Проблема возникает, когда красители реагируют с буферные агенты которые необходимы для правильного хранения нуклеотидов. Однако для решения этой проблемы можно использовать карбонатный буфер.[19]
Смотрите также
Рекомендации
- ^ Хоган, Дэниел Дж .; Riordan, Daniel P .; Гербер, Андре П .; Хершлаг, Даниэль; Браун, Патрик О. (2008). «Различные связывающие РНК белки взаимодействуют с функционально связанными наборами РНК, предлагая обширную регуляторную систему». PLOS Биология. 6 (10): e255. Дои:10.1371 / journal.pbio.0060255. ЧВК 2573929. PMID 18959479.
- ^ а б Kricka, LJ; Фортина, П. (апрель 2009 г.). «Аналитическое происхождение:« первые »в флуоресцентной маркировке нуклеозидов, нуклеотидов и нуклеиновых кислот». Клиническая химия. 55 (4): 670–83. Дои:10.1373 / Clinchem.2008.116152. PMID 19233914.
- ^ Secrist III, Джон А.; Хорхе Р. Баррио; Нельсон Дж. Леонард (3 декабря 1971 г.). «Присоединение флуоресцентной метки к 4-тиоурацилу и 4-тиоуридину». Сообщения о биохимических и биофизических исследованиях. 45 (5): 1262–1270. Дои:10.1016 / 0006-291x (71) 90154-9. PMID 4332594.
- ^ а б c Фаррелл, Роберт (22.07.2010). Методологии РНК: лабораторное руководство по выделению и характеристике. п. 597. ISBN 9780080454764.
- ^ а б Реддингтон, Марк; Дэниел Каннинган-Брайант (12 января 2011 г.). «Удобный синтез (E) -5-аминоаллил-2'-дезоксицитидина и некоторых родственных производных». Буквы Тетраэдра. 52 (2): 181–183. Дои:10.1016 / j.tetlet.2010.10.137.
- ^ а б c Биосистемы, прикладные. «Модифицированный нуклеотид 5- (3-аминоаллил) -UTP» (PDF).
- ^ а б Биотехнологии, Trilink. «Модифицированные нуклеотиды» (PDF).
- ^ Kore, Anilkumar R .; Бо Ян; Баласубраманиан Шринивасан (13 ноября 2013 г.). «Фторированный синтез (E) -5- [3-аминоаллил] -уридин-5'-трифосфата». Буквы Тетраэдра. 54 (46): 6264–6266. Дои:10.1016 / j.tetlet.2013.09.026.
- ^ ДеРизи, Джозеф. «Протокол связывания амино-аллилового красителя» (PDF). Получено 9 апреля 2014.
- ^ а б АнаСпек, Инк. "Брошюра Hiyte Fluor" (PDF). Архивировано из оригинал (PDF) 13 апреля 2014 г.. Получено 9 апреля 2014.
- ^ а б технологии жизни. «Аминоаллил дУТФ». Получено 24 марта 2014.
- ^ а б Сян, СС; Кожич О.А. Чен, М; Инман, JM; Phan, QN; Чен, Y; Браунштейн, MJ (июль 2002 г.). «Модифицированные амином случайные праймеры для мечения зондов для ДНК-микрочипов». Природа Биотехнологии. 20 (7): 738–42. Дои:10.1038 / nb0702-738. PMID 12089562.
- ^ Биотехнологии, Trilink. «Маркировка ДНК».
- ^ Гибриэль, Абдулла (17 апреля 2012 г.). «Доступные варианты маркировки образцов нуклеиновых кислот в методах обнаружения на основе микромассивов ДНК». Брифинги по функциональной геномике. II (4): 311–318. Дои:10.1093 / bfgp / els015. PMID 22510454.
- ^ Грин, Майкл. "Молекулярное клонирование - лабораторное руководство". Лабораторный пресс Колд-Спринг-Харбор.
- ^ Отт, Шелер; Барри Глинн (2009). «Флуоресцентная маркировка молекул тмРНК, амплифицированных NASBA для приложений микроматрицы». BMC Biotechnology.
- ^ 'т Хоэн, Пенсильвания; de Kort, F; van Ommen, GJ; ден Даннен, JT (1 марта 2003 г.). «Флуоресцентное маркирование кРНК для микрочипов». Исследования нуклеиновых кислот. 31 (5): e20. Дои:10.1093 / nar / gng020. ЧВК 149842. PMID 12595569.
- ^ Капоши-Новак, П; Ли, JS; Микаелян А; Патель, В; Торгейрссон, СС (октябрь 2004 г.). «Олигонуклеотидный микроматричный анализ аминоаллил-меченых кДНК-мишеней из линейной амплификации РНК». Биотехнологии. 37 (4): 580, 582–6, 588. Дои:10.2144 / 04374ST02. PMID 15517970.
- ^ Soundy, P; Wheeler, C .; Латам, Х. (2001). «Подготовка высоко флуоресцентных, равномерно меченных зондов для гибридизации микроматрицы с использованием аминоаллильного метода с CyScribe Post-Labeling Kit». Новости науки о жизни. 9: 17–19.
внешняя ссылка
- Пример протокола Авторы: Холли Беннет и Джо ДеРизи, созданная в Rosetta Informatics, модифицированная Крисом Зайделем.[1]
- ^ Зайдель, Крис. «Подготовка флуоресцентного зонда». Получено 24 марта 2014.
