Реакция Барбье - Barbier reaction
| Реакция Барбье | |
|---|---|
| Названный в честь | Филипп Барбье |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000084 |

В Реакция Барбье является металлоорганическая реакция между алкилгалогенид (хлорид, бромид, йодид), а карбонил группа и металл. Реакцию можно проводить с использованием магний, алюминий, цинк, индий, банка, самарий, барий или их соли. Продукт реакции бывает первичным, вторичным или третичным. алкоголь. Реакция похожа на Реакция Гриньяра но принципиальное отличие состоит в том, что металлоорганические соединения в реакции Барбье образуются на месте, тогда как реагент Гриньяра готовят отдельно перед добавлением карбонильного соединения.[1] В отличие от многих реактивов Гриньяра, металлоорганические соединения, образующиеся в реакции Барбье, нестабильны, что требует их немедленного использования. Реакции Барбье нуклеофильное присоединение реакции, в которых участвуют относительно недорогие, нечувствительные к воде металлы или соединения металлов. По этой причине во многих случаях можно провести реакцию в воде, что делает процедуру частью зеленая химия. Напротив, реактивы Гриньяра и литийорганические реагенты очень чувствительны к влаге и должны использоваться в инертной атмосфере без присутствия воды. Реакция Барбье названа в честь Виктор Гриньяр учитель Филипп Барбье.
Объем
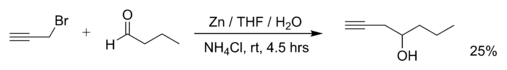
Примерами реакций Барбье являются реакция пропаргилбромида с бутаналем с металлическим цинком (реакцию проводят в ТГФ, насыщенный водный раствор хлорида аммония добавляют позже для гашения реакции):[2]
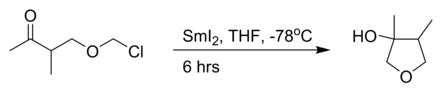
то внутримолекулярный Реакция Барбье с иодид самария (II):[3]
реакция аллил бромид с формальдегид в THF с индий порошок:[4]

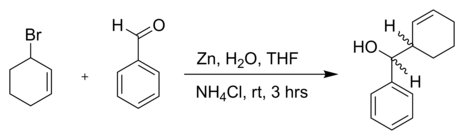
Реакция 3-бромциклогексена с бензальдегид и цинк порошок в воде:[5]
Асимметричные варианты
Синтез (+) - аспициллина начинается сначала с гидроборирования, затем трансметаллирования до цинка, который затем может присоединяться к альдегидному заместителю.[6]

Смотрите также
внешние ссылки
- Реакция Барбье @ Университет Коннектикута Интернет сайт
использованная литература
- ^ Барбье, П. (1899). "Synthèse du diéthylhepténol". Компт. Раздирать. 128: 110.
- ^ Артур Йыги и Уно Мяэорг (2001). "Zn-опосредованная региоселективная реакция Барбье пропаргиловых бромидов в THF / водном NH4Cl Раствор ». Молекулы. 6 (12): 964–968. Дои:10.3390/61200964.
- ^ Тор Скьерет и Тор Беннече (2001). «Получение оксозамещенных α-хлорэфиров и их реакция с дииодидом самария». Аркивок: КУ – 242А.
- ^ Джордж Д. Беннетт и Лео А. Пакетт. «Метил 3- (гидроксиметил) -4-метил-2-метиленпентаноат». Органический синтез.; Коллективный объем, 10, п. 77
- ^ Гэри В. Бретон; Джон Х. Шугарт; Кристин А. Хьюги; Брайан П. Конрад; Сюзанна М. Перала (2001). «Использование циклических аллильных бромидов в цинк-опосредованной водной реакции Барбье-Гриньяра». Молекулы. 6 (8): 655–662. Дои:10.3390/60800655.
- ^ Оппольцер, Вольфганг; Радинов, Румен Н .; Брабандер, Джеф Де (1995). «Полный синтез макролида (+) - аспицилина путем асимметрично катализируемой макроциклизации ω-сложного эфира алкинала». Буквы Тетраэдра. 36 (15): 2607–2610. Дои:10.1016 / 0040-4039 (95) 00351-C.
