Карбоксипептидаза - Carboxypeptidase

А карбоксипептидаза (Номер ЕС 3.4.16 - 3.4.18) является протеаза фермент который гидролизует (раскалывает) пептидная связь на карбокси-конце (С-конце) конце белок или же пептид. Это в отличие от аминопептидазы, которые расщепляют пептидные связи на N-конце белков. Люди, животные, бактерии и растения содержат несколько типов карбоксипептидаз, которые выполняют разнообразные функции, от катаболизма до созревания белка.
Механизм
Механизм производства карбоксипептидазы заключается в том, что вода, координирующая субстрат, заменяется субстратом из карбонильных (C = O) групп.
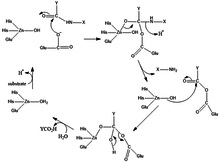
Функции
Первые исследованные карбоксипептидазы были вовлечены в пищеварение пищи (карбоксипептидазы поджелудочной железы A1, A2 и B). Однако большинство известных карбоксипептидаз не участвуют в катаболизм; они помогают созревать белки (например, Посттрансляционная модификация ) или регулируют биологические процессы. Например, биосинтез нейроэндокринный пептиды, такие как инсулин требуется карбоксипептидаза. Карбоксипептидазы также действуют в свертывание крови, фактор роста производство, лечение раны, воспроизведение, и многие другие процессы.
Классификации
По механизму активного сайта
Карбоксипептидазы обычно классифицируются в одно из нескольких семейств на основе механизма их активного сайта.
- Ферменты, которые используют металл в активном центре, называются «металлокарбоксипептидазами» (номер ЕС 3.4.17).
- Другие карбоксипептидазы, использующие активный сайт серин остатки называются «серинкарбоксипептидазами» (номер EC 3.4.16).
- Те, кто использует активный сайт цистеин называются «цистеинкарбоксипептидаза» (или «тиол карбоксипептидазы ») (номер ЕС 3.4.18).
Эти названия не относятся к селективности расщепляемой аминокислоты.
По предпочтению субстрата
Другая система классификации карбоксипептидаз связана с их предпочтением к субстрату.
- В этой системе классификации карбоксипептидазы, которые отдают предпочтение тем аминокислотам, которые содержат ароматный или же разветвленный углеводородные цепи называются карбоксипептидаза А (A для ароматических /алифатический ).
- Карбоксипептидазы, которые расщепляют положительно заряженные аминокислоты (аргинин, лизин ) называются карбоксипептидаза B (B для базовый ).
Металлокарбоксипептидаза, которая отщепляет С-концевой глутамат от пептида N-ацетил-L-аспартил-L-глутамата, называется "глутаматкарбоксипептидаза ".
Серинкарбоксипептидаза, которая отщепляет C-концевой остаток от пептидов, содержащих последовательность -Pro-Xaa (Pro - пролин, Xaa - любая аминокислота на C-конце пептида), называется "пролилкарбоксипептидаза ".
Активация
Некоторые, но не все карбоксипептидазы изначально продуцируются в неактивной форме; эта форма-предшественник упоминается как прокарбоксипептидаза. В случае карбоксипептидазы поджелудочной железы А неактивный зимоген форма - про-карбоксипептидаза A - превращается в свою активную форму - карбоксипептидазу A - ферментом трипсин. Этот механизм гарантирует, что клетки, в которых продуцируется про-карбоксипептидаза А, сами не перевариваются.
Смотрите также
- Карбоксипептидаза E
- Карбоксипептидаза А
- Категория ферментов Номер ЕС 3.4
- Ингибитор фибринолиза, активируемый тромбином иначе плазма карбоксипептидаза Би 2
- бактериальная транспептидаза, аланинкарбоксипептидаза
- брадикинин расщепляется среди других ферментов карбоксипептидаза N
- D-Ala карбоксипептидаза это пенициллин-связывающий белок
- Фенилаланин может препятствовать карбоксипептидаза А
- Марта Л. Людвиг[1]
Рекомендации
внешняя ссылка
- Карбоксипептидазы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Раздел Protease, книга Страйера '02
