Кротамин - Crotamine
| Кротамин | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Идентификаторы | |||||||
| Организм | ? | ||||||
| Символ | CRO2 | ||||||
| UniProt | Q9PWF3 | ||||||
| |||||||
Кротамин это токсин присутствует в яд из южноамериканец гремучая змея (Crotalus durissus terrificus ). Это длинный 42 остатка белок содержащие 11 основных остатков (9 лизины, 2 аргинины ) и 6 цистеины. Он также был выделен из яда североамериканской гремучей змейки, Crotalus viridis viridis. Впервые он был выделен и очищен бразильским ученым. Хосе Моура Гонсалвеш, а затем интенсивно изучался его группой сотрудников в Медицинская школа Рибейран-Прету из Университет Сан-Паулу.
Биологическая функция
Кротамин имеет ряд биологических действий: он действует на клеточные мембраны. натриевые каналы, немного обезболивающее и миотоксичен, т.е. проникает в клетки мышцы и продвигает некроз. Кротамин гомологичный с другим ядом миотоксины и аналогичен α-, β-дефенсины.
Биохимия и механизм
В аминокислота последовательность, YKQCHKKGGHCFPKEKICLPPSSDFGKMDCRWRWKCCKKGS — 0, а 3D молекулярная структура кротамина уже определены.
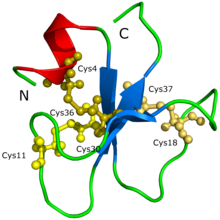
В белок структура кротамина не могла быть первоначально определена через кристаллизация белка ни дифракция рентгеновских лучей.[1] Было высказано предположение, что проблема заключалась в том, что кротамин имеет очень много изоформ, ведущих к образованию агрегатов и различных возможных конформаций белка. Структура и форма белка были предложены с помощью 3D-модели, созданной Siqueira et al. (2002) на основе компьютерных расчетов, которые были поддержаны интенсивным моделированием молекулярной динамики и процедурами моделирования гомологии. Впоследствии Nicastro et al. (2003) открыли структуру кротамина через спектроскопия ядерного магнитного резонанса. Кротамин имеет топологию, которая никогда прежде не наблюдалась у активных токсинов, нацеленных на ионные каналы; белок состоит из короткого N-конца альфа спираль, тип образования белка и небольшой антипараллельный трехцепочечный бета-лист, другой тип образования белка, организованный в топологии ab1b2b3. Кротамин имеет сходные структурные складки с человеческими. бета-дефенсин семья, а также идентичные дисульфидные мостики расположение.[1]
[Необходим рисунок]
В ген и хромосома места, ответственные за его синтез, были определены группой во главе с Ганди Радис-Баптиста, работая в Instituto Butantan в Сан-Паулу, Бразилия. В мРНК насчитывает около 340 нуклеотиды и кодифицирует прекротамин, включая сигнальный пептид, зрелый кротамин и последний лизин.
Ген кротамина был первым геном, нанесенным на хромосому змеи.[1]Ген, ответственный за кодирование белка кротамина, обозначен как Crt-p1, и длина его последовательности пары оснований составляет около 1,1 тыс. Пар оснований или 1100 пар оснований. Сообщалось, что ген кротамина был выделен дважды из двух разных образцов, один методом, в результате которого был получен размер гена 1,8 т.п.н., а в другом образце размер гена 1,1 т.п.н.[2] Ген был ранее выделен в C. durissus terrificus геном и сам белок принадлежит к группе небольших основных полипептид миотоксины (SBPM). Состав ядов Crotalus может варьироваться в зависимости от подвида и географического положения.[3] Ген Crt-p1, как описано Radis-Bastista et al. 2003, состоит из примерно трех экзонов, разделенных одним интроном короткой фазы-2 (140 п.н.) и одним длинным интроном фазы-1 (900 п.н.). Экзон 1 кодирует первые 19 аминокислот сигнального пептида и включает 5’-нетранслируемую область. Экзон 2 кодирует 39 аминокислот зрелого кротамина и три аминокислоты сигнального пептида. Экзон 3 кодирует концевой лизин и последние три аминокислоты зрелого токсина. Исследование аминокислотных последовательностей SBPM среди различных видов Crotalus выявило высокую степень сходства в диапазоне от 83% до 98%.[2]
Аминокислотный код белков семейства малых основных полипептидов миотоксинов, в которое входит кротамин, был секвенирован. Было обнаружено, что они похожи со средним расхождением 83%. Аминокислотную последовательность кротамина сравнивали с последовательностью клонированная ДНК миотоксина а (миотоксина, используемого для моделирования работы SBPM). Для сравнения, области, кодирующие экзоны, включая зрелый миотоксин и сигнальный пептид, были сходны на 98% и 100% соответственно. Нетранслируемые области для 5 ’и 3’ между образцом и кДНК миотоксина a составляли 60% и 80% соответственно. При сравнении аминокислотных последовательностей других белков, не входящих в семейство SBPM, обнаруженных в ядах змей, обычно наблюдается большое расхождение. Если посмотреть на белки SBPM, они имеют большое сходство между разными подвидами рода Crotalus и между разными особями одного и того же подвида. Это указывает, согласно Radis-Batista et al. Исследование 2003 года показало, что ген кротамина и другие гены SBPM эволюционировали недавно.
Рекомендации
- ^ а б c Oguiura N, Boni-Mitake M, Rádis-Baptista G (сентябрь 2005 г.). «Новый взгляд на кротамин, небольшой базовый полипептидный миотоксин из яда южноамериканской гремучей змеи». Токсикон. 46 (4): 363–70. Дои:10.1016 / j.toxicon.2005.06.009. PMID 16115660.
- ^ а б Самедзима Y, Аоки Y, Мебс Д. (1991). «Аминокислотная последовательность миотоксина из яда восточной гремучей змеи (Crotalus adamanteus)». Токсикон. 29 (4–5): 461–8. Дои:10.1016 / 0041-0101 (91) 90020-р. PMID 1862521.
- ^ Шенберг S (май 1959). «Географическая картина распределения кротамина в одном подвиде гремучей змеи». Наука. 129 (3359): 1361–3. Дои:10.1126 / science.129.3359.1361. PMID 13658964.
дальнейшее чтение
- Goncalves JM, Deutsch HF (февраль 1956 г.). «Исследование ядов некоторых кроталид с помощью ультрацентробежного и зонного электрофореза». Архивы биохимии и биофизики. 60 (2): 402–11. Дои:10.1016/0003-9861(56)90444-1. PMID 13292919.
- Giglio JR (ноябрь 1975 г.). «Аналитические исследования гидрохлорида кротамина». Аналитическая биохимия. 69 (1): 207–21. Дои:10.1016/0003-2697(75)90581-3. PMID 2030.
- Лауре CJ (февраль 1975 г.). «[Первичная структура кротамина (авторский перевод)]». Hoppe-Seyler's Zeitschrift für Physiologische Chemie (на немецком). 356 (2): 213–5. PMID 1176086.
- Де Лукка, Флорида, Имаидзуми М.Т., Хаддад А. (апрель 1974 г.). «Характеристика рибонуклеиновых кислот из ядовитых желез Crotalus durissus terrifucus (Ophidia, Reptilia) после ручного извлечения яда. Исследования активности матрицы и состава основы». Биохимический журнал. 139 (1): 151–6. Дои:10.1042 / bj1390151. ЧВК 1166261. PMID 4463939.
- Собственный С.Л., Кэмерон Д., Ту-АТ (октябрь 1976 г.). «Выделение миотоксического компонента из яда гремучей змеи (Crotalus viridis viridis). Электронно-микроскопический анализ повреждений мышц». Американский журнал патологии. 85 (1): 149–66. ЧВК 2032543. PMID 970437.
- Радис-Баптиста Г., Огиура Н., Хаяси М.А., Камарго М.Э., Грего К.Ф., Оливейра Э.Б., Ямане Т. (июль 1999 г.). «Нуклеотидная последовательность предшественников изоформы кротамина от одной южноамериканской гремучей змеи (Crotalus durissus terrificus)». Токсикон. 37 (7): 973–84. Дои:10.1016 / s0041-0101 (98) 00226-8. PMID 10484745.
- Керкис А., Керкис И., Радис-Баптиста Дж., Оливейра Э. Б., Вианна-Морганте А. М., Перейра Л. В., Ямане Т. (сентябрь 2004 г.). «Кротамин - новый проникающий в клетки белок из яда гремучей змеи Crotalus durissus terrificus». Журнал FASEB. 18 (12): 1407–9. Дои:10.1096 / fj.03-1459fje. PMID 15231729. S2CID 20510076.
- Радис-Баптиста Г., Кубо Т., Огиура Н., Прието да Силва А. Р., Хаяси М. А., Оливейра Э. Б., Ямане Т. (июнь 2004 г.). «Идентификация кротазина, связанного с кротамином гена Crotalus durissus terrificus». Токсикон. 43 (7): 751–9. Дои:10.1016 / j.toxicon.2004.02.023. PMID 15284009.
- Радис-Баптиста Г., Кубо Т., Огиура Н., Свартман М., Алмейда Т.М., Батистик Р.Ф. и др. (Декабрь 2003 г.). «Структура и хромосомная локализация гена кротамина, токсина южноамериканской гремучей змеи Crotalus durissus terrificus». Токсикон. 42 (7): 747–52. Дои:10.1016 / j.toxicon.2003.10.019. PMID 14757205.
- Никастро Дж., Франзони Л., де Кьяра С., Мансин А. С., Джильо Дж. Р., Списни А. (май 2003 г.). «Структура раствора кротамина, Na + канал, влияющий на токсин из яда Crotalus durissus terrificus». Европейский журнал биохимии. 270 (9): 1969–79. Дои:10.1046 / j.1432-1033.2003.03563.x. PMID 12709056. S2CID 20601072.
- Mouhat S, Jouirou B., Mosbah A, De Waard M, Sabatier JM (март 2004 г.). «Разнообразие складок в токсинах животных, действующих на ионные каналы». Биохимический журнал. 378 (Пт 3): 717–26. Дои:10.1042 / BJ20031860. ЧВК 1224033. PMID 14674883.
внешняя ссылка
- Нуклеотидная последовательность и трансляция кротазина. База данных Entrez. Национальный центр биотехнологической информации.
