Idebenone - Idebenone
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Катена, Раксон, Соврима |
| AHFS /Drugs.com | Международные названия лекарств |
| Данные лицензии | |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Биодоступность | <1% (высокий эффект первого прохода ) |
| Связывание с белками | >99% |
| Устранение период полураспада | 18 часов |
| Экскреция | Моча (80%) и кал |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
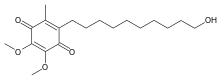
| Формула | C19ЧАС30О5 |
| Молярная масса | 338.444 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| (проверить) | |
Idebenone (произносится глаз-деб-э-известные торговые наименования Катена, Раксон, Соврима, среди прочих) является препарат, средство, медикамент который изначально был разработан Фармацевтическая компания Такеда для лечения Болезнь Альцгеймера и другие познавательный дефекты.[1] Это было встречено с ограниченным успехом. Швейцарская компания Santhera Pharmaceuticals начала исследовать его для лечения нервно-мышечные заболевания. В 2010 г. клинические испытания для лечения Атаксия Фридрейха[2] и Мышечная дистрофия Дюшенна[3] были завершены. По состоянию на декабрь 2013 г.[Обновить] препарат не одобрен для этих показаний в Северной Америке или Европе. Утверждено Европейское агентство по лекарствам (EMA) для использования в Наследственная оптическая нейропатия Лебера (LHON) и был назначен орфанный препарат в 2007.[4]
Химически идебенон является органическое соединение из хинон семья. Он также продвигается коммерчески как синтетический аналог из коэнзим Q10 (CoQ10).
Использует
Показания, одобренные или одобренные на некоторых территориях
Ноотропные эффекты и болезнь Альцгеймера
Идебенон улучшил обучаемость и память в экспериментах на мышах.[5] У людей оценка Суррогатные конечные точки любить электроретинография, слуховые вызванные потенциалы и визуальные аналоговые шкалы также предложил положительный ноотропный эффекты,[6] но отсутствуют более крупные исследования с твердыми конечными точками.
Исследования идебенона как потенциального средства лечения Болезнь Альцгеймера были непоследовательными, но может быть тенденция к небольшой выгоде.[7][8] В мае 1998 г. одобрение этого показания было отменено в Японии из-за отсутствия доказанных эффектов. В некоторых европейских странах препарат доступен для лечения отдельных пациентов в особых случаях.[1]
Атаксия Фридрейха (Sovrima)
Предварительные испытания, проведенные на людях, показали, что идебенон является безопасным средством лечения атаксии Фридрейха (FA), оказывая положительное влияние на сердечная гипертрофия и неврологическая функция.[9] Последнее было значительно улучшено только у молодых пациентов.[10] В другом эксперименте, одногодичном тесте на восьми пациентах, идебенон снижал скорость ухудшения сердечной функции, но без остановки прогрессирования атаксия.[11]
Препарат был одобрен для FA в Канаде в 2008 году при условиях, включая доказательство эффективности в дальнейших клинических испытаниях.[12] Однако 27 февраля 2013 г. Министерство здравоохранения Канады объявило, что с 30 апреля 2013 г. идебенон будет добровольно отозван его канадским производителем, Santhera Pharmaceuticals, из-за того, что препарат не продемонстрировал эффективность в дальнейших клинических испытаниях, которые проводились.[13] В 2008 г. Европейское агентство по лекарствам (EMA) отказала в разрешении на продажу по этому показанию.[1] По состоянию на 2013 год препарат не был одобрен для FA в Европе.[14] ни в США, где нет одобренного лечения.[15]
Наследственная оптическая нейропатия Лебера (Raxone)
Наследственная оптическая нейропатия Лебера (LHON) - митохондриально наследуемая (от матери для всех потомков) дегенерация ганглиозных клеток сетчатки (RGC) и их аксонов, которая приводит к острой или подострой потере центрального зрения; это поражает преимущественно молодых взрослых мужчин. Santhera завершила клинические испытания фазы III по этому показанию в Европе с положительными результатами.[16] и подала заявку на продажу препарата европейским регулирующим органам в июле 2011 года.[17] Он одобрен EMA для этого показания и был обозначен орфанный препарат в 2007.[4]
Показания исследуются
Мышечная дистрофия Дюшенна (Катена)
После экспериментов на мышах[18] и предварительные исследования на людях, идебенон вошел в фазу II клинических испытаний в 2005 г.[3] и III фаза испытаний в 2009 г.[19]
Другие нервно-мышечные заболевания
Клинические испытания фазы I и II для лечения МЕЛАС (митохондриальная энцефаломиопатия, лактоацидоз и инсультоподобные эпизоды)[20] и первичный прогрессирующий рассеянный склероз[21] продолжаются по состоянию на декабрь 2013 г.[Обновить].
Стиль жизни
Утверждается, что идебенон обладает свойствами, аналогичными CoQ.10 в его антиоксидант свойства, и поэтому был использован в против старения на основе свободнорадикальная теория. Клинические доказательства этого использования отсутствуют. Он был использован в актуальный приложения для лечения морщины.[22]
Фармакология
В клеточных и тканевых моделях идебенон действует как переносчик в электронная транспортная цепь из митохондрии и, таким образом, увеличивает производство аденозинтрифосфат (АТФ), который является основным источником энергии для клеток, а также подавляет липопероксид формирование. Положительное влияние на энергетику митохондрий также наблюдалось на животных моделях.[1][23] Клиническая значимость этих результатов не установлена.
Фармакокинетика
Идебенон хорошо всасывается из кишечника, но подвергается чрезмерному усвоению. первый проход метаболизм в печени, так что менее 1% попадает в кровоток. Этот показатель можно улучшить с помощью специальных составов (подвески ) идебенона и назначая его вместе с жирной пищей; но даже принимая эти меры биодоступность по-прежнему, кажется, значительно меньше 14% у людей. Более 99% циркулирующих лекарств связано с белки плазмы. Метаболиты идебенона включают: глюкурониды и сульфаты, которые в основном (~ 80%) выводятся с мочой.[1]
использованная литература
- ^ а б c d е «Отчет об оценке CHMP для Sovrima» (PDF). Европейское агентство по лекарствам. 20 ноября 2008 года: 6, 9–11, 67f. Цитировать журнал требует
| журнал =(Помогите) - ^ Номер клинического исследования NCT00229632 за «Идебенон для лечения атаксии Фридрейха» в ClinicalTrials.gov
- ^ а б Номер клинического исследования NCT00654784 на «Эффективность и переносимость идебенона у мальчиков с сердечной дисфункцией, связанной с мышечной дистрофией Дюшенна (DELPHI)» в ClinicalTrials.gov
- ^ а б «Раксон». www.ema.europa.eu. Получено 12 июля 2019.
- ^ Лю, XJ; Ву, В.Т. (1999). «Влияние лигустразина, таншинона II A, убихинона и идебенона на производительность мышей в водном лабиринте». Чжунго Яо Ли Сюэ Бао. 20 (11): 987–90. PMID 11270979.
- ^ Schaffler, K; Хадлер, Д; Старк, М. (1998). «Доза-эффект отношения идебенона в экспериментальной модели церебрального дефицита. Пилотное исследование на здоровых молодых добровольцах с пирацетамом в качестве препарата сравнения». Arzneimittel-Forschung. 48 (7): 720–6. PMID 9706371.
- ^ Gutzmann, H; Кюль, КП; Хадлер, Д; Рапп, Массачусетс (2002). «Безопасность и эффективность идебенона по сравнению с такрином у пациентов с болезнью Альцгеймера: результаты рандомизированного двойного слепого многоцентрового исследования в параллельных группах». Фармакопсихиатрия. 35 (1): 12–8. Дои:10.1055 / с-2002-19833. PMID 11819153.
- ^ Парнетти, L; Сенин, У; Mecocci, P (1997). «Когнитивная терапия при болезни Альцгеймера. Путь вперед». Наркотики. 53 (5): 752–68. Дои:10.2165/00003495-199753050-00003. PMID 9129864. S2CID 46987059.
- ^ Ди Просперо Н. А., Бейкер А., Джеффрис Н., Фишбек К. Х. (октябрь 2007 г.). «Неврологические эффекты высоких доз идебенона у пациентов с атаксией Фридрейха: рандомизированное плацебо-контролируемое исследование». Ланцет Нейрол. 6 (10): 878–86. Дои:10.1016 / S1474-4422 (07) 70220-X. PMID 17826341. S2CID 24749816.
- ^ Тонон С., Лоди Р. (сентябрь 2008 г.). «Идебенон при атаксии Фридрейха». Эксперт Opin Pharmacother. 9 (13): 2327–37. Дои:10.1517/14656566.9.13.2327. PMID 18710357. S2CID 73285881.
- ^ Buyse G, Mertens L., Di Salvo G, et al. (Май 2003 г.). «Лечение идебеноном при атаксии Фридрейха: неврологический, кардиологический и биохимический мониторинг». Неврология. 60 (10): 1679–81. Дои:10.1212 / 01.wnl.0000068549.52812.0f. PMID 12771265. S2CID 36556782.
- ^ "Информационный бюллетень Хит Канады - Катена". Архивировано из оригинал 19 июня 2014 г.
- ^ Добровольный вывод Catena с канадского рынка
- ^ Маргарет Уол для журнала Quest Magazine, 28 мая 2010 г. FA Research: Идебенон снова наносит удар
- ^ Информационный бюллетень NINDS
- ^ Клопшток, Т; и другие. (2011). «Рандомизированное плацебо-контролируемое исследование идебенона при наследственной оптической невропатии Лебера». Мозг. 134 (9): 2677–86. Дои:10.1093 / мозг / awr170. ЧВК 3170530. PMID 21788663.
- ^ Персонал (26 июля 2011 г.). "Santhera публикует основные результаты испытаний идебенона и идет на одобрение ЕС". Новости европейской биотехнологии. Архивировано из оригинал 17 февраля 2013 г.
- ^ Буйсе, GM; Ван дер Миерен, G; Эрб, М; D'hooge, J; Herijgers, P; Verbeken, E; Джара, А; Ван Ден Берг, А; и другие. (2009). «Долгосрочное слепое плацебо-контролируемое исследование SNT-MC17 / идебенона у мышей mdx с дефицитом дистрофина: сердечная защита и улучшенная работоспособность». Европейский журнал сердца. 30 (1): 116–24. Дои:10.1093 / eurheartj / ehn406. ЧВК 2639086. PMID 18784063.
- ^ Номер клинического исследования NCT01027884 для «Фаза III исследования идебенона при мышечной дистрофии Дюшенна (DMD) (DELOS)» в ClinicalTrials.gov
- ^ Номер клинического исследования NCT00887562 за «Изучение идебенона в лечении митохондриальной энцефалопатии, лактоацидоза и инсульта-подобных эпизодов (MELAS)» в ClinicalTrials.gov
- ^ Номер клинического исследования NCT00950248 для «Двойного слепого плацебо-контролируемого клинического испытания идебенона фазы I / II у пациентов с первичным прогрессирующим рассеянным склерозом (IPPoMS)» в ClinicalTrials.gov
- ^ МакДэниэл Д., Нойдекер Б., Динардо Дж., Льюис Дж., Майбах Х. (сентябрь 2005 г.). «Оценка клинической эффективности на фотоповрежденной коже 0,5% и 1,0% идебенона». J Cosmet Dermatol. 4 (3): 167–73. Дои:10.1111 / j.1473-2165.2005.00305.x. PMID 17129261.
- ^ Суно М., Нагаока А. (май 1988 г.). «[Влияние идебенона и различных ноотропных препаратов на перекисное окисление липидов в гомогенате головного мозга крысы в присутствии сукцината]». Ниппон Якуригаку Засши (по-японски). 91 (5): 295–9. Дои:10.1254 / fpj.91.295. PMID 3410376.
