Реакция Пикте – Шпенглера - Pictet–Spengler reaction
| Реакция Пикте-Шпенглера | |
|---|---|
| Названный в честь | Аме Пикте Теодор Шпенглер |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000059 |
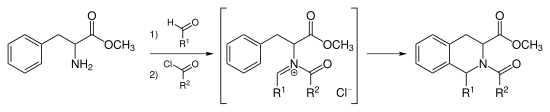
В Реакция Пикте – Шпенглера это химическая реакция в котором β-арилэтиламин подвергается конденсация с альдегид или же кетон с последующим закрытием кольца. Впервые реакция была открыта в 1911 г. Аме Пикте и Теодор Шпенглер (22 февраля 1886-18 августа 1965).[1] Традиционно кислотный катализатор в протонный растворитель использовался с обогревом,[2] однако было показано, что реакция работает в апротические СМИ с превосходной урожайностью, а иногда и без кислотный катализ.[3] Реакцию Пикте – Шпенглера можно рассматривать как частный случай Реакция Манниха, который следует аналогичному пути реакции. Движущей силой этой реакции является электрофильность из иминий ион, образующийся в результате конденсации альдегида и амина в кислых условиях. Это объясняет потребность в кислотном катализаторе в большинстве случаев, поскольку имин недостаточно электрофилен для замыкания кольца, но иминиевый ион способен подвергаться реакции.

Реакция Пикте-Шпенглера широко распространена как в промышленности, так и в биосинтезе. Это остается важной реакцией в области алкалоид и органический синтез с момента своего создания, где он использовался в разработке многих бета-карболины. Естественная реакция Пикте-Шпенглера обычно используется фермент, Такие как стриктозидинсинтаза. Продукты Pictet-Spengler могут быть изолированы от многих продуктов, изначально полученных от природы, включая такие продукты питания, как соевый соус и кетчуп. В таких случаях обычно можно найти аминокислота триптофан и различные альдозы используется как биологический сырье.
Нуклеофильный ароматный кольца, такие как индол или же пиррол дают продукты с высокими выходами и в мягких условиях, в то время как менее нуклеофильные ароматические кольца, такие как фенил группа дает более низкие урожаи или требует более высоких температур и сильной кислоты. Первоначальная реакция Пикте – Шпенглера была реакцией фенэтиламин и диметоксиметан, катализируемый соляная кислота формирование тетрагидроизохинолин.
Реакция Пикте – Шпенглера была применена к твердофазный комбинаторная химия с большим успехом.[4][5]
Аналогичная реакция с арил-β-этанолом называется окса-Пикте – Шпенглера реакция[6]
Механизм реакции
В механизм реакции происходит путем начального образования иона иминия (2) с последующим электрофильная добавка в положении 3, в соответствии с ожидаемой нуклеофильностью индолы, чтобы дать спироциклу 3. После миграции лучших мигрирующая группа, депротонирование дает продукт (5).

Вариации
Синтез тетрагидроизохинолина Пикте – Шпенглера.
Замена индола на 3,4-диметоксифенильную группу дает реакцию, названную синтезом тетрагидроизохинолина Пикте-Шпенглера. Условия реакции обычно жестче, чем для варианта индола, и требуют условий кипячения с сильными кислотами, такими как соляная кислота, трифторуксусная кислота или же суперкислоты.[7][8]

N-ацилиминий-ион реакция Пикте – Шпенглера
Вместо того, чтобы катализировать циклизацию Пикте-Шпенглера сильной кислотой, можно ацилат иминиевый ион, образующий промежуточное соединение N-ацилиминий ион. В N-ацилиминий-ион - очень мощный электрофил и большинство ароматических кольцевых систем будет циклизоваться в мягких условиях с хорошими выходами.[9]
Тадалафил синтезируется через N-ацилиминий реакция Пикте – Шпенглера.[10] Эту реакцию также можно катализировать AuCl3 и AgOTf.[11]
Асимметричная реакция Пикте – Шпенглера.
Когда реакция Пикте-Шпенглера проводится с альдегидом, отличным от формальдегид, создается новый хиральный центр. Несколько контролируемых субстратом или вспомогательными средствами диастереоселективный Были разработаны реакции Пикте – Шпенглера.[12][13] Кроме того, список и другие. опубликовали хиральный Кислота Бренстеда который катализирует асимметричные реакции Пикте – Шпенглера.[14]
Триптофаны: диастереоконтролируемая реакция
Реакция энантиочистка триптофан или его короткоцепочечный алкилсложные эфиры приводит к 1,2,3,4-тетрагидро-β-карболины в котором новый хиральный центр в C-1 принимает либо СНГ или же транс конфигурация в сторону C-3 карбоксил группа. В СНГ проводимость кинетически управляемый, т.е. выполняется при более низких температурах. При более высоких температурах реакция становится обратимой и обычно способствует рацемизация. 1,3-транс продукты с преобладанием Nб-бензилированный триптофаны, которые доступны восстановительное аминирование. Бензильная группа может быть удалена гидрогенолитически после. Как правило, 13C ЯМР сигналы для C1 и C3 смещены в слабое поле СНГ продукты относительно транс продукты (см. эффект стерической компрессии ).[3][15]
Смотрите также
Рекомендации
- ^ Pictet, A .; Шпенглер, Т. (1911). "Über die Bildung von Isochinolin-derivatedurch Einwirkung von Methylal auf Phenyl-äthylamin, Phenyl-alanin und Tyrosin". Berichte der Deutschen Chemischen Gesellschaft. 44 (3): 2030–2036. Дои:10.1002 / cber.19110440309.
- ^ Whaley, W. M .; Говиндачари, Т. Р. (1951). «Синтез Пикте-Шпенглера тетрагидроизохинолинов и родственных соединений». Орг. Реагировать. 6: 74.
- ^ а б Cox, E.D .; Кук, Дж. М. (1995). «Конденсация Пикте-Шпенглера: новое направление для старой реакции». Химические обзоры. 95 (6): 1797–1842. Дои:10.1021 / cr00038a004.
- ^ Nielsen, T. E .; Diness, F .; Мелдал, М. (2003). «Твердофазный синтез пирролоизохинолинов посредством внутримолекулярной реакции N-ацилиминия Пикте-Шпенглера». Curr. Мнение. Drug Discov. Dev. 6 (6): 801–814. PMID 14758752.
- ^ Nielsen, T. E .; Мелдал, М. (2005). «Твердофазный синтез пирролоизохинолинов посредством внутримолекулярной реакции N-ацилиминия Пикте-Шпенглера». J. Comb. Chem. 7 (4): 599–610. Дои:10.1021 / cc050008a. PMID 16004504.
- ^ Larghi, E.L .; Кауфман, Т. С. (2006). «Циклизация окса-Пикте-Шпенглера. Синтез изохроманов и родственных гетероциклов пиранового типа». Синтез (2): 187–210. Дои:10.1055 / с-2005-918502.
- ^ Ёкояма, Акихиро; Охвада, Томохико; Сюдо, Коичи (1999). "Прототип реакции Пикте-Шпенглера, катализируемый суперкислотами. Участие дикатионных суперэлектрофилов". J. Org. Chem. 64 (2): 611–617. Дои:10.1021 / jo982019e.
- ^ Quevedo, R .; Baquero, E .; Родригес, М. (2010). «Региоселективность в синтезе изохинолиновых алкалоидов». Буквы Тетраэдра. 51 (13): 1774–1778. Дои:10.1016 / j.tetlet.2010.01.115.
- ^ Б. Э. Марьянов; Х.-К. Чжан; Дж. Х. Коэн; И. Дж. Турчи; Марьянов К.А. (2004). «Циклизация ионов N-ацилиминия». Chem. Ред. 104 (3): 1431–1628. Дои:10.1021 / cr0306182. PMID 15008627.
- ^ Bonnet, D .; Ганесан, А. (2002). «Твердофазный синтез тетрагидро-β-карболингидантоинов посредством реакции N-ацилиминия Пикте-Шпенглера и циклического расщепления». J. Comb. Chem. 4 (6): 546–548. Дои:10.1021 / cc020026h. PMID 12425597.
- ^ Юн, С. В. (2006). "Развитие реакции Пикте-Шпенглера, катализируемой AuCl3/ AgOTf ". J. Org. Chem. 71 (6): 2521–2523. Дои:10.1021 / jo0524775. PMID 16526809.
- ^ Gremmen, C .; Willemse, B .; Wanner, M. J .; Кумен, Г.-Дж. (2000). «Enantiopure тетрагидро-β-карболины через реакции Пикте-Шпенглера с N-сульфинилтриптаминами». Орг. Lett. 2 (13): 1955–1958. Дои:10.1021 / ol006034t. PMID 10891200.
- ^ а) Межмолекулярная конденсация Пикте-Шпенглера с хиральными карбонильными производными в стереоселективном синтезе оптически активных изохинолиновых и индольных алкалоидов Энрике Л. Ларги, Марсела Индереро, Андреа Б. Дж. Бракка и Теодоро С. Кауфман Аркивок (RL-1554K) стр. 98–153 2005 (Онлайн-обзор[постоянная мертвая ссылка ]); б) Теодоро С. Кауфман «Синтез оптически активных изохинолина и индольных алкалоидов с использованием конденсации Пикте-Шпенглера со съемными хиральными вспомогательными веществами, связанными с азотом». в «Новые методы асимметричного синтеза гетероциклов азота»; Ред .: Дж. Л. Викарио. ISBN 81-7736-278-X. Исследование SignPost, Тривандрам, Индия. 2005. Глава 4, стр. 99–147.
- ^ Seayad, J .; Seayad, A.M .; Лист Б. (2006). «Каталитическая асимметричная реакция Пикте-Шпенглера». Варенье. Chem. Soc. 128 (4): 1086–1087. Дои:10.1021 / ja057444l. PMID 16433519.
- ^ Унгемах, Ф .; Soerens, D .; Weber, R .; Дипьерро, М .; Campos, O .; Mokry, P .; Cook, J.M .; Сильвертон, Дж. В. (1980). «Общий метод определения стереохимии 1,3-дизамещенных 1,2,3,4-тетрагидро-β-карболинов с помощью спектроскопии углерода-13». Варенье. Chem. Soc. 102 (23): 6976–6984. Дои:10.1021 / ja00543a012.
