Реакция Шмидта - Schmidt reaction
В Реакция Шмидта является органическая реакция в котором азид реагирует с карбонил производное, обычно альдегид, кетон или карбоновая кислота, в кислых условиях, чтобы дать амин или же амид, с выбросом азота.[1][2][3] Он назван в честь Карл Фридрих Шмидт (1887–1971), который впервые сообщил об этом в 1924 году, успешно преобразовав бензофенон и гидразойная кислота к бензанилид.[4] Удивительно, но внутримолекулярная реакция не сообщалось до 1991 г.[5] но стал важным в синтезе натуральных продуктов.[6]
| Реакция Шмидта | |
|---|---|
| Названный в честь | Карл Фридрих Шмидт |
| Тип реакции | Реакция перестановки |
| Идентификаторы | |
| Портал органической химии | реакция Шмидта |
| RSC ID онтологии | RXNO: 0000170 |

Реакция эффективна с карбоновые кислоты дать амины (см. выше), а с кетоны дать амиды (см. ниже).

Механизм реакции
Реакция тесно связана с Перестановка Курция за исключением того, что в этой реакции ацилазид получают реакцией карбоновой кислоты с азойной кислотой через протонированную карбоновую кислоту в процессе, похожем на Этерификация Фишера. Альтернатива, включающая образование иона ацилия, становится более важной, когда реакция происходит в концентрированной кислоте (> 90% серной кислоты).[7] (В перегруппировке Курциуса азид натрия и ацилхлорид объединяют для количественного образования промежуточного ацилазида, а остальная часть реакции протекает в нейтральных условиях.)
Реакция Шмидта с карбоновой кислотой начинается с ацилий ион 1 получен из протонирование и потеря воды. Реакция с гидразойная кислота образует протонированный азидокетон 2, который проходит через реакция перегруппировки с алкильной группой R, мигрирующей по связи C-N с вытеснением азота. Протонированный изоцианат подвергается воздействию воды, образующей карбамат 4, который после депротонирования теряет углекислый газ к амин.
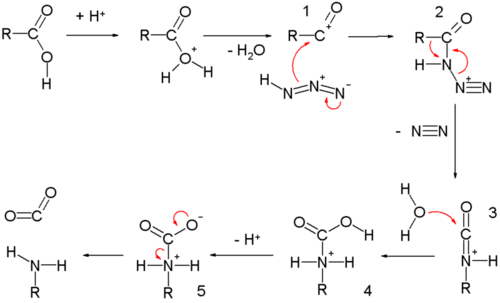
В механизме реакции Шмидта кетоны, карбонильная группа активируется протонированием на нуклеофильное присоединение азидом, образуя азидогидрин 3, который теряет воду в реакция элиминации в диазоиминий 5. Одна из алкильных или арильных групп мигрирует от углерода к азоту с потерей азота с образованием промежуточного нитрилия. 6, как в Перестановка Бекмана. Атака водных обращенных 6 к протонированной имидовой кислоте 7, который претерпевает потерю протона, чтобы добраться до имидовой кислоты таутомер финала амид. В альтернативном механизме миграция происходит при 9, непосредственно после протонирования промежуточного 3, аналогично Реакция Байера-Виллигера дать протонированный амид 10. Потеря протона снова дает амид. Было предложено, чтобы обезвоживание 3 давать 5 (и, следовательно, путь Бекмана) предпочитают неводные кислоты, такие как конц. ЧАС2ТАК4, а водные кислоты, такие как конц. HCl способствует миграции из 9 (тропа Байера-Виллигера). Эти возможности были использованы для объяснения того факта, что для некоторых субстратов, таких как α-тетралон, группа, которая мигрирует, может иногда изменяться, в зависимости от используемых условий, для доставки любого из двух возможных амидов.[8]

Реакции с участием алкилазидов
Объем этой реакции был расширен на реакции карбонилов с алкилом. азиды R-N3. Об этом расширении впервые сообщил J.H. Бойе в 1955 году [9] (отсюда и название Реакция Бойера), например, реакция м-нитробензальдегид с β-азидо-этанол:

Вариации, связанные с внутримолекулярными реакциями Шмидта, известны с 1991 года.[5] Это аннулирование реакции и есть некоторая полезность в синтезе натуральных продуктов;[6][10] Такие как лактамы[11] и алкалоиды.[12]

Смотрите также
Рекомендации
- ^ Plagens, Андреас; Лауэ, Томас М. (2005). Названные органические реакции (2-е изд.). Чичестер: Джон Уайли и сыновья. ISBN 0-470-01041-X.
- ^ Вольф, Ганс (2011). «Реакция Шмидта». Органические реакции: 307–336. Дои:10.1002 / 0471264180.or003.08. ISBN 978-0471264187.
- ^ Lang, S .; Мерфи, Дж. А. (2006). «Азидные перегруппировки в электронодефицитных системах». Chem. Soc. Rev. 35 (2): 146–156. Дои:10.1039 / B505080D. PMID 16444296.
- ^ Шмидт, К. Ф. (1924). «Убер ден Имин-Рест». Berichte der Deutschen Chemischen Gesellschaft (серии A и B). 57 (4): 704–723. Дои:10.1002 / cber.19240570423.
- ^ а б Джеффри Об и Грегори Л. Миллиган (1991). «Внутримолекулярная реакция Шмидта алкилазидов». Варенье. Chem. Soc. 113 (23): 8965–8966. Дои:10.1021 / ja00023a065.
- ^ а б Найфелер, Эрих; Рено, Филипп (24 мая 2006 г.). «Внутримолекулярная реакция Шмидта: применение в синтезе природных продуктов». Международный химический журнал CHIMIA. 60 (5): 276–284. Дои:10.2533/000942906777674714.
- ^ Колдобский, Г И; Островский Владимир А; Гидаспов Б.В. (1978-11-30). «Реакция Шмидта с альдегидами и карбоновыми кислотами». Российские химические обзоры. 47 (11): 1084–1094. Bibcode:1978RuCRv..47.1084K. Дои:10.1070 / rc1978v047n11abeh002294. ISSN 0036-021X.
- ^ Кросби, Ян Т .; Шин, Джеймс К .; Капуано, Бен (2010). «Применение реакции Шмидта и перегруппировки Бекмана к синтезу бициклических лактамов: некоторые механистические соображения». Австралийский химический журнал. 63 (2): 211. Дои:10.1071 / CH09402. ISSN 0004-9425.
- ^ Дж. Х. Бойер и Дж. Хамер (1955). «Катализируемая кислотой реакция алкилазидов на карбонильные соединения». Варенье. Chem. Soc. 77 (4): 951–954. Дои:10.1021 / ja01609a045.
- ^ Миллиган, Грегори Л .; Моссман, Крейг Дж .; Об, Джеффри (октябрь 1995). "Внутримолекулярные реакции Шмидта алкилазидов с кетонами: объем и стереохимические исследования". Журнал Американского химического общества. 117 (42): 10449–10459. Дои:10.1021 / ja00147a006.
- ^ Лей Яо и Джеффри Обе (2007). «Катион-π-контроль региохимии внутримолекулярных реакций Шмидта на пути к мостиковым бициклическим лактамам» (Коммуникация). Варенье. Chem. Soc. 129 (10): 2766–2767. Дои:10.1021 / ja068919r. ЧВК 2596723. PMID 17302421.
- ^ Вроблески, Аарон; Сахасрабудхе, Киран; Обе, Джеффри (май 2004 г.). «Асимметричный полный синтез дендробатидных алкалоидов: получение индолизидина 251F и его 3-десметилового аналога с использованием стратегии внутримолекулярной реакции Шмидта». Журнал Американского химического общества. 126 (17): 5475–5481. Дои:10.1021 / ja0320018. PMID 15113219.
