Селеномочевина - Википедия - Selenourea
| |||
| Идентификаторы | |||
|---|---|---|---|
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.010.119 | ||
| Номер ЕС |
| ||
| MeSH | C081959 | ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| CH4N2Se | |||
| Молярная масса | 123,02 г / моль | ||
| Внешность | Розовый / серый твердый | ||
| Температура плавления | 200 ° С (392 ° F, 473 К) | ||
| Точка кипения | 214 ° С (417 ° F, 487 К) | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
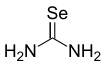
Селеномочевина это селенорганическое соединение с формулой SeC (NH2)2. Это белое твердое вещество. Это соединение представляет собой редкий пример стабильной, беспрепятственной двойной связи углерод-селен. Соединение используется в синтезе селена. гетероциклы. В сравнении с мочевина, оксо-аналог селеномочевины, было проведено несколько исследований этого соединения из-за нестабильности и токсичности селен соединения.[1] Селеномочевина токсична при вдыхании или употреблении.
Синтез
Соединение было впервые синтезировано в 1884 г. Огюст Верней по реакции селенид водорода и цианамид:[2]
- ЧАС2Se + NCNH2 → SeC (NH2)2
Хотя эта реакция даже нашла применение в промышленном синтезе селеномочевины,[3] более современные методы связаны с синтезом замещенных селеномочевин. Их можно синтезировать с использованием органических изоселеноцианатов и вторичных аминов:
- RN = C = Se + NHR′R ″ → Se = C (NRH) (NR′R ″ H)
В качестве альтернативы замещенный карбодиимид можно использовать следующим образом:[1]
- RN = C = NR ′ Se = C (NRH) (NR'H)
Характеристики
Рентгеновский кристаллографический измерения на кристаллы при -100 ° C средняя длина связи C = Se составляет 1,86Å, и 1,37 Å для C − N. Углы Se-C-N и N-C-N были измерены под углом 120 °, как и ожидалось для зр2-гибридизированный углерод. Благодаря этим же исследованиям существование Se − H водородная связь в кристаллическая решетка - предположено из водородных связей O-H и S-H, обнаруженных в кристаллах мочевина и тиомочевина -было подтверждено.[4]
Как укороченная длина связи N-C, так и более длинная связь Se = C предполагают делокализацию одинокая пара по аминам; Se = C π-соединение электроны тянутся к атому селена, в то время как неподеленная пара азота тянется к карбонил углерод. Аналогичный эффект наблюдается у мочевины и тиомочевины. При переходе от мочевины к тиомочевине к селеномочевине двойная связь более делокализована и длиннее, в то время как C − N σ связь сильнее и короче. С точки зрения резонансные структуры, то селенол форма (структуры II, III) более распространена по сравнению с аналогами мочевины и тиомочевины; однако неподеленная пара азот селеномочевины делокализует лишь немного больше, чем неподеленная пара на тиомочевине (в отличие от гораздо большей делокализации при переходе от мочевины к тиомочевине).[5] Эти незначительные различия предполагают, что свойства, возникающие из делокализованной неподеленной пары азота и дестабилизации π-связи C = S и C = Se в тиомочевине и селеномочевине, также будут аналогичными.
В отличие от мочевины и тиомочевины, которые были тщательно исследованы,[1] относительно небольшое количество исследований количественно характеризует селеномочевину. В то время как селоне было показано, что таутомер (I) является более стабильной формой,[6] в основном качественная и сравнительная информация о селеномочевине таутомеризация доступен.
Аналогично кетонам селоны также таутомеризуются:
Поскольку большая делокализация электронов неподеленной пары коррелирует с продуктом селона, положение равновесия селеномочевины, вероятно, имеет положение равновесия сравнимо с тиомочевиной (которая находится правее, чем мочевина). Было показано, что тиомочевина существует преимущественно в форме тиона при 42 ° C в разбавленном метанол, при этом тионольный таутомер почти не существует при нейтральной pH.[7]
Реактивность
Важным классом реакций селеномочевины является образование гетероциклы. Некоторые селенсодержащие гетероциклы проявляют противовоспалительное средство и противоопухолевый активность, среди других медицинских целей. Использование селеномочевины в качестве прекурсора считается наиболее эффективным способом селенсодержащего гетероциклического синтеза.[8]
Другой класс реакций - это комплексообразование селеномочевины с переходные металлы и металлоиды. Его способность действовать как эффективный лиганд объясняется электронодонорным эффектом аминогрупп и последующей стабилизацией селен-металлического π связь. В комплексах селеномочевины наблюдалась только связь селен – металл, в отличие от аналогов мочевины и тиомочевины, которые также связываются через атом азота.[9]
Рекомендации
- ^ а б c Koketsu, M .; Исихара, Х. (2006). «Тиомочевина и селеномочевина и их применение». Текущий органический синтез. 3 (4): 439–455. Дои:10.2174/157017906778699521.
- ^ Надежда, Х. (1964). «Синтез селеномочевины». Acta Chemica Scandinavica. 18: 1800. Дои:10.3891 / acta.chem.scand.18-1800.
- ^ Суворов, В .; и другие. (1996). «Производство селеномочевины высокой чистоты». Высокочистые Вещи. 3: 17–23.
- ^ Rutherford, J. S .; Кальво, К. (1969). «Кристаллическая структура селеномочевины». Zeitschrift für Kristallographie. 128 (3–6): 229–258. Дои:10.1524 / zkri.1969.128.3-6.229.
- ^ Hampson, P .; Матиас, А. (1968). «Химические сдвиги азота-14 в мочевинах». Журнал химического общества B. 1968: 673–675. Дои:10.1039 / J29680000673..
- ^ Rostkowska, H .; и другие. (2004). «Процессы переноса протона в селеномочевине: УФ-индуцированный селенон → фотореакция селенола и основное состояние селенол → туннелирование протонов селона». Химическая физика. 298 (1–3): 223–232. Дои:10.1016 / j.chemphys.2003.11.024.
- ^ Pramanick, D .; Чаттерджи, А. К. (1980). «Тиомочевина как переносчик радикальной полимеризации метилметакрилата в водном растворе при 42 °». Европейский Полимерный Журнал. 16 (9): 895–899. Дои:10.1016/0014-3057(80)90122-6.
- ^ Ninomiya, M .; и другие. (2010). «Селенсодержащие гетероциклы с использованием селенамидов, селеномочевин, селеназадиенов и изоселеноцианатов». Гетероциклы. 81 (9): 2027–2055. Дои:10.3987 / РЭВ-10-677.
- ^ Jones, P.G .; Тоне, К. (1991). «Получение, кристаллические структуры и реакции фосфиновых (селеномочевинных) комплексов золота (I)». Chemische Berichte. 124: 2725–2729. Дои:10.1002 / cber.19911241213.