Трет-бутилтиол - Tert-Butylthiol
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 2-метилпропан-2-тиол | |
| Другие имена т-Куст 2-метилпропан-2-тиол 2-метил-2-пропантиол терт-Бутилмеркаптан | |
| Идентификаторы | |
3D модель (JSmol ) | |
| Сокращения | TBM |
| ChemSpider | |
| ECHA InfoCard | 100.000.810 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C4ЧАС10S | |
| Молярная масса | 90.18 г · моль−1 |
| Внешность | Бесцветная прозрачная жидкость |
| Плотность | 0,8 г / мл |
| Температура плавления | -0,50 ° С (31,10 ° F, 272,65 К) |
| Точка кипения | От 62 до 65 ° C (от 144 до 149 ° F, от 335 до 338 K) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
терт-Бутилтиол, также известный как 2-метилпропан-2-тиол, 2-метил-2-пропантиол, терт-бутилмеркаптан (ТБМ), и т-Куст, представляет собой сероорганическое соединение формулы (CH3)3CSH. Этот тиол используется как одорант за натуральный газ, который в остальном не имеет запаха. Возможно, он также использовался в качестве ароматизатора.[1]
Подготовка
По крайней мере одна публикация внесла в список терт-бутилтиол как очень незначительный компонент вареного картофеля,[2] но потому что терт-бутильный фрагмент очень редко встречается в натуральных продуктах, другие источники сомневаются в существовании природных источников соединения[ВОЗ? ]. Впервые он был подготовлен в 1890 году Леонардом Доббином.[3] по реакции сульфида цинка и т-бутилхлорид.
Позднее соединение было получено в 1932 году реакцией Реактив Гриньяра, т-BuMgCl, с серой для получения соответствующего тиолата, с последующим гидролиз.[4] Этот препарат показан ниже:
- т-BuMgCl + S → т-BuSMgCl
- т-BuSMgCl + H2O → т-BuSH + Mg (OH) Cl
В настоящее время его получают в промышленных масштабах по реакции изобутилен с сероводород на глинистом (алюмосиликатном) катализаторе.[5]
Реакции
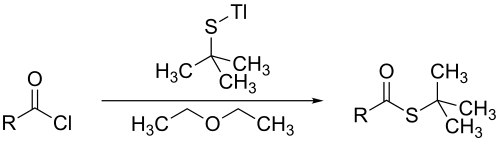
терт-Бутилтиол может реагировать с металлом алкоксиды и ацилхлориды с образованием эфиров тиолов, как показано в уравнении:[6]
В указанной выше реакции этоксид таллия (I) превращается в таллий (I). т-бутилтиолат. В присутствии диэтиловый эфир, таллий (Я) т-бутилтиолат реагирует с ацилхлориды с получением соответствующих трет-бутилтиоэфиров.[6] Как и другие тиоэфиры, при гидролизе он превращается в трет-бутилтиол.[7]
2-метилпропан-2-тиолат лития может быть получен обработкой терт-бутилтиол с гидрид лития в апротонном растворителе, таком как гексаметилфосфорамид (HMPA). Полученная тиолатная соль является полезным деметилирование реагент. Например, лечение 7-метилгуанозин дает гуанозин. Другой N-метилированные нуклеозиды в тРНК не являются деметилированный этим реагентом.[8]
Металлические комплексы
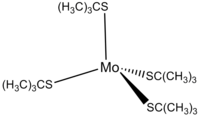
Анион, полученный из терт-бутилтиол образует комплексы с различными металлами. Один из примеров - тетракис (терт-бутилтиолато) молибден (IV), Mo (т-BuS)4. Этот комплекс был приготовлен обработкой MoCl4 с т-BuSLi:[9]
- MoCl4 + 4 т-BuSLi → Пн (т-BuS)4 + 4 LiCl
Пн (т-BuS)4 темно-красный диамагнитный комплекс, чувствительный к воздуху и влаге. В молибден центр имеет искаженную тетраэдрическую координацию с четырьмя атомами серы, с общим D2 симметрия.[9]
Безопасность
Даже в хорошо проветриваемых помещениях следует соблюдать особую осторожность при обращении с терт-бутилтиол, так как это химическое вещество с сильным запахом и порогом запаха <0,33 частей на миллиард.[10] Крайняя осторожность обусловлена не токсичностью, а сильным запахом и опасением, что этот запах может вызвать у людей, которые могут подвергнуться воздействию. В PEL для тиолов большинства типов - 500 частей на миллиард[нужна цитата ], в первую очередь из-за реакции тошноты на уровне 2–3 промилле.
Коммерческое использование
терт-Бутилтиол является основным ингредиентом многих смесей одорантов газов. Он всегда используется в виде смеси других соединений, обычно диметилсульфид, метилэтилсульфид, тетрагидротиофен или другие меркаптаны, такие как изопропилмеркаптан, сек-бутилмеркаптан и / или п-бутилмеркаптан, из-за его довольно высокой температуры плавления –0,5 ° C (31,1 ° F). Эти смеси используются только с природным газом, а не с пропаном, так как точки кипения этих смесей и пропана сильно различаются. Поскольку пропан подается в виде жидкости и испаряется в газ, когда он подается в прибор, равновесие пар-жидкость существенно снизит количество одоранта, смешанного с паром.
терт-Бутилтиол внесен в список Европейское агентство по безопасности пищевых продуктов (FL-№: 12.174) в качестве вкусовой добавки. Нет никаких указаний на то, в каких ароматизаторах он мог использоваться. Он был удален из этого списка.[11]
Смотрите также
- Бутантиол (бутилмеркаптан)
Рекомендации
- ^ «трет-бутилмеркаптан». thegoodscentscompany.com.
- ^ Gumbmann, M. R .; Берр, Х. К. (1964). «Пищевые ароматизаторы и запахи, летучие соединения серы в картофеле». Журнал сельскохозяйственной и пищевой химии. 12 (5): 404–408. Дои:10.1021 / jf60135a004.
- ^ Доббин, Леонард (1890). «На третичном бутил меркаптане». Журнал химического общества, Сделки. 57: 639–643. Дои:10.1039 / ct8905700639.
- ^ Рейнбольдт, Генрих; Мотт, Фридрих; Моцкус, Эрвин; А. Д. Макмастер; Б. М. Маттсон; С. Т. Мишель (1932). "Tertiäres Butylmercaptan". Journal für Praktische Chemie. 134 (9–12): 257–281. Дои:10.1002 / prac.19321340901.
- ^ Schulze, W.A .; Lyon, J.P. & Short, G.H. (1948). «Синтез третичных алкилмеркаптанов». Промышленная и инженерная химия. Американское химическое общество. 40 (12): 2308–2313. Дои:10.1021 / ie50468a019.
- ^ а б Спессард, Гэри О .; Чан, Ван Кит; Масамунэ, С. (1990). «Получение тиоловых эфиров: s-трет-бутилциклогексанкарботиоат и s-трет-бутил 3α, 7α, 12α-тригидрокси-5β-холан-24-тиоат». Органический синтез. 7: 87. Дои:10.1002 / 0471264180.os061.28. ISBN 0471264229.
- ^ «2-пропантиол, 2-метил-». Национальный институт стандартов и технологий.
- ^ Хо, Це-Лок; Физер, Мэри; Физер, Луи (2006). «Литий 2-метилпропан-2-тиолат». Реагенты Физера и Физера для органического синтеза. Дои:10.1002 / 9780471264194.fos06530. ISBN 0471264199.
- ^ а б Оцука, Сэй; Камата, Масато; Хироцу, Кен; Хигучи, Тайити (1981). «Новое тиолатное соединение молибдена, тетракис (трет-бутилтиолато) молибден (IV). Получение и кристаллическая и молекулярная структура». Журнал Американского химического общества. 103 (11): 3011–3014. Дои:10.1021 / ja00401a017.
- ^ Девос, М; Patte, F .; Rouault, J .; Lafort, P .; Ван Гемерт, Л. Дж. (1990). Стандартизованные обонятельные пороги человека. Оксфорд: IRL Press в Oxford University Press. п. 118. ISBN 0199631468.
- ^ «Научное заключение по оценке группы ароматизаторов 8, редакция 3 (FGE.08Rev3): Алифатические и алициклические моно-, ди-, три- и полисульфиды с дополнительными оксигенированными функциональными группами из химических групп 20 и 30 или без них». EFSA. Получено 15 апреля 2013.