Кислородный комплекс переходных металлов - Transition metal dioxygen complex
Кислородные комплексы находятся координационные соединения которые содержат O2 как лиганд.[1][2] Исследование этих соединений вдохновлено белками, переносящими кислород, такими как миоглобин, гемоглобин, гемеритрин, и гемоцианин.[3] Несколько переходные металлы образуют комплексы с O2, и многие из этих комплексов образуются обратимо.[4] Связывание O2 это первый шаг во многих важных явлениях, таких как клеточное дыхание, коррозия, и промышленная химия. Первый синтетический кислородный комплекс был продемонстрирован в 1938 году с комплексом кобальта (II), обратимо связанным O2.[5]
Моноядерные комплексы O2
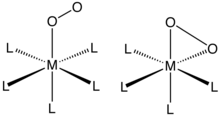
О2 связывается с одним металлическим центром либо «в конец» (η1- ) или «боком» (η2-). Связь и структуру этих соединений обычно оценивают методом монокристаллических соединений. Рентгеновская кристаллография, фокусируясь как на общей геометрии, так и на расстояниях O – O, которые выявляют ордер на облигации из O2 лиганд.
Комплексы η1-O2 лиганды

О2 аддукты происходит от кобальт (II) и утюг (II) комплексы порфирин (и родственные анионные макроциклические лиганды) демонстрируют этот способ связывания. Миоглобин и гемоглобин - известные примеры, и описаны многие синтетические аналоги, которые ведут себя аналогичным образом. Связывание O2 обычно описывается как действие перенос электронов из центра металла (II), чтобы дать супероксид (О−
2) комплексы металлических (III) центров. Как показали механизмы цитохром P450 и альфа-кетоглутарат-зависимая гидроксилаза, Fe-η1-O2 связывание способствует образованию оксоцентров Fe (IV). О2 может связываться с одним металлом биметаллического звена теми же способами, которые обсуждались выше для моноядерных комплексов. Хорошо известный пример - активный центр белка. гемеритрин, в котором есть diiron карбоксилат что связывает O2 в одном центре Fe. Диядерные комплексы также могут сотрудничать в связывании, хотя начальная атака O2 вероятно, происходит в одном металле.
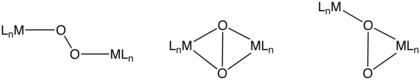
Комплексы η2-O2 лиганды
η2-связь - наиболее распространенный мотив в координационной химии дикислорода. Такие комплексы могут быть получены обработкой комплексов низковалентных металлов кислородом. Например, Васьковский комплекс обратимо связывает O2 (Ph = C6ЧАС5):
- IrCl (CO) (PPh3)2 + O2 ⇌ IrCl (CO) (PPh3)2О2
Преобразование описывается как 2 e− редокс процесс: Ir (I) преобразуется в Ir (III), поскольку кислород превращается в перекись. Поскольку O2 имеет триплетное основное состояние, а комплекс Васьки - синглет, реакция идет медленнее, чем когда синглетный кислород используется.[7]
Комплексы, содержащие η2-O2 лиганды довольно распространены, но большинство из них генерируются с использованием пероксид водорода, а не O2. Хромат ([CrO4)]2−) можно, например, превратить в тетрапероксид [Cr (O2)4]2−. Реакция пероксида водорода с водным раствором титана (IV) дает ярко окрашенный пероксисомплекс, который является полезным тестом для титана, а также пероксида водорода.[8]
Биядерные комплексы O2

Эти режимы привязки включают μ2-η2,η2-, μ2-η1,η1-, и μ2-η1,η2-. В зависимости от степени переноса электрона из диметаллического блока эти O2 лиганды снова можно описать как пероксо- или супероксо. Гемоцианин это O2-носитель, который использует мостиковый мотив связывания O2. В нем есть пара медь центры.[9]
.
Salcomine, комплекс кобальта (II) сален-лиганд первый синтетический O2 перевозчик.[11] Сольватированные производные твердого комплекса связывают 0,5 эквивалента O2:
- 2 Co (сален) + O2 → [Co (salen)]2О2
Связь с другими оксигенными лигандами и применениями
Кислородные комплексы являются предшественниками других семейств кислородных лигандов. Оксосоединения металлов возникают в результате разрыва связи O – O после комплексообразования. Гидропероксо комплексы образуются в процессе восстановления кислорода металлами. Уменьшение O2 металлическими катализаторами является ключевым полуреакция в топливные элементы.
Катализируемое металлами окисление с O2 протекают через посредство дикислородных комплексов, хотя действительные окислители часто являются оксопроизводными. Обратимое связывание O2 в комплексы металлов использовался как средство для очистки кислорода из воздуха, но криогенная перегонка жидкий воздух остается доминирующей технологией.
Рекомендации
- ^ Йи, Гереон М .; Толмен, Уильям Б. (2015). «Глава 5: Комплексы переходных металлов и активация диоксида». В Кронеке, Питер М. Х .; Соса Торрес, Марта Э. (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие кислород и другие жевательные газы. Ионы металлов в науках о жизни. 15. Springer. С. 131–204. Дои:10.1007/978-3-319-12415-5_5.
- ^ Холлеман, А. Ф .; Виберг, Э. (2001). Неорганическая химия. Сан-Диего, Калифорния: Academic Press. ISBN 0-12-352651-5.
- ^ Lippard, S.J .; Берг, Дж. М. (1994). Принципы биоинорганической химии. Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 0-935702-73-3.
- ^ Берри, Р. Э. (2004). «Реакционная способность и структура комплексов малых молекул: дикислород». Комплексная координационная химия II. Комплексная координационная химия II. 1. С. 625–629. Дои:10.1016 / B0-08-043748-6 / 01161-0. ISBN 9780080437484.
- ^ Цумаки, Токуичи (1938). "Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine" [Соединения с вторичным валентным кольцом. IV. О некоторых внутрикомплексных солях кобальта оксиальдимин ]. Бык. Chem. Soc. Jpn. 13 (2): 252–260. Дои:10.1246 / bcsj.13.252.
- ^ С. Дж. Липпард, Дж. М. Берг «Принципы биоинорганической химии» Университетские научные книги: Милл-Вэлли, Калифорния; 1994 г. ISBN 0-935702-73-3.
- ^ Selke, M .; Фут, С. С. (1993). «Реакции металлоорганических комплексов с синглетным кислородом. Фотоокисление комплекса Васьки». Варенье. Chem. Soc. 115 (3): 1166–1167. Дои:10.1021 / ja00056a061.
- ^ Greenwood, N. N .; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
- ^ Элвелл, Кортни Э .; Gagnon, Nicole L .; Neisen, Benjamin D .; Дхар, Дебанджан; Spaeth, Andrew D .; Йи, Гереон М .; Толмен, Уильям Б. (2017). «Возвращение к медно-кислородным комплексам: структура, спектроскопия и реакционная способность». Химические обзоры. 117: 2059-2107. Дои:10.1021 / acs.chemrev.6b00636. ЧВК 5963733.
- ^ М. Каллигарис, Г. Нардин, Л. Рандаччо, А. Рипамонти (1970). «Структурные аспекты синтетического кислородного носителя NN'-этиленбис (салицилидениминато) кобальта (II): структура соединения присоединения с кислородсодержащим диметилформамидом». J. Chem. Soc. А: 1069. Дои:10.1039 / j19700001069.CS1 maint: использует параметр авторов (связь)
- ^ Токуичи Цумаки (1938). "Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine". Бюллетень химического общества Японии. 13 (2): 252–260. Дои:10.1246 / bcsj.13.252.