Миоглобин - Википедия - Myoglobin
Миоглобин (символ МБ или же МБ) является утюг - и кислород переплет белок найдено в скелетный мышечная ткань позвоночных в целом и почти у всех млекопитающих.[5][6][7][8][9] Миоглобин отдаленно связан с гемоглобин. В сравнении с гемоглобин, Миоглобин имеет более высокое сродство к кислороду и не имеет кооперативная привязка кислородом, как гемоглобин.[8][10] Но по сути, это белок, связывающий кислород. красные кровяные тельца. У людей миоглобин обнаруживается в кровотоке только после мышечная травма.[11][12][13]
Высокая концентрация миоглобина в мышечных клетках позволяет организмам задерживать дыхание на более длительный период времени. У ныряющих млекопитающих, таких как киты и тюлени, есть мышцы с особенно высоким содержанием миоглобина.[13] Миоглобин содержится в мышцах типа I, типа II A и типа II B, но в большинстве текстов считается, что миоглобин не содержится в мышцах. гладкая мышца.[нужна цитата ]
Миоглобин был первым белком, трехмерная структура которого была обнаружена Рентгеновская кристаллография.[14] Об этом достижении сообщил в 1958 г. Джон Кендрю и соратники.[15] Для этого открытия Кендрю поделился Нобелевская премия по химии с Макс Перуц.[16] Несмотря на то, что это один из наиболее изученных белков в биологии, его физиологическая функция еще не установлена окончательно: мыши, генетически сконструированные с отсутствием миоглобина, могут быть жизнеспособными и фертильными, но демонстрируют множество клеточных и физиологических адаптаций для преодоления потери. Наблюдая за этими изменениями у мышей с истощенным миоглобином, было выдвинуто предположение, что функция миоглобина связана с повышенным транспортом кислорода к мышцам и с накоплением кислорода; также он служит мусорщиком активные формы кислорода.[17]
У человека миоглобин кодируется МБ ген.[18]
Миоглобин может принимать форму оксимиоглобина (MbO2), карбоксимиоглобин (MbCO) и метмиоглобин (met-Mb), аналогично гемоглобину, принимающему формы оксигемоглобина (HbO2), карбоксигемоглобин (HbCO) и метгемоглобин (мет-Hb).[19]
Отличия от гемоглобина
Как и гемоглобин, миоглобин - это цитоплазматический белок, который связывает кислород на гем группа. Он содержит только одну группу глобулинов, а гемоглобин - четыре. Хотя его гемовая группа идентична группе гемоглобина, Mb имеет более высокое сродство к кислороду, чем гемоглобин. Это различие связано с его другой ролью: в то время как гемоглобин транспортирует кислород, функция миоглобина заключается в хранении кислорода.
Цвет мяса
Миоглобин содержит гемы, пигменты отвечает за цвет красное мясо. Цвет мяса частично определяется степенью окисления миоглобина. В свежем мясе атом железа находится в степени окисления железа (+2). связан с молекулой кислорода (O2). Мясо приготовленное отличная работа коричневый, потому что атом железа теперь находится в степени окисления трехвалентного железа (+3), потеряв электрон. Если мясо подвергалось воздействию нитриты, он останется розовым, потому что атом железа связан с NO, оксид азота (верно, например, Солонина или вылечил окорока ). У жареного мяса может появиться розовое «кольцо дыма», которое возникает из-за связывания железа с молекулой монооксид углерода.[20] Сырое мясо, упакованное в атмосфере угарного газа, также имеет то же розовое «кольцо дыма» из-за тех же принципов. Примечательно, что поверхность этого сырого мяса также имеет розовый цвет, который в сознании потребителей обычно ассоциируется со свежим мясом. Этот искусственно вызванный розовый цвет может сохраняться до одного года.[21] Сообщается, что Hormel и Cargill используют этот процесс упаковки мяса, а мясо, обработанное таким образом, находится на потребительском рынке с 2003 года.[22]
Роль в болезни
Миоглобин выделяется из поврежденной мышечной ткани (рабдомиолиз ), который имеет очень высокие концентрации миоглобина.[23] Освободившийся миоглобин фильтруется почки но токсичен для эпителия почечных канальцев и поэтому может вызывать острая травма почек.[24] Токсичен не сам миоглобин (это протоксин ), но часть феррихемата, которая диссоциирует от миоглобина в кислой среде (например, кислая моча, лизосомы ).
Миоглобин является чувствительным маркером мышечных травм, что делает его потенциальным маркером острое сердечно-сосудистое заболевание у пациентов с грудная боль.[25] Однако повышенный миоглобин имеет низкое специфичность за острый инфаркт миокарда (ОИМ) и поэтому СК-МБ, сердечный тропонин, ЭКГ, и клинические признаки должны быть приняты во внимание, чтобы поставить диагноз.[26]
Структура и склеивание

Миоглобин относится к глобин суперсемейство белков, как и другие глобины, состоит из восьми альфа спирали связаны петлями. Миоглобин содержит 154 аминокислоты.[28]
Миоглобин содержит порфирин кольцо с утюгом в центре. А проксимальный гистидин группа (His-93) крепится непосредственно к железу, а дистальный Группа гистидина (His-64) парит возле противоположной грани.[28] Дистальный имидазол не связан с железом, но доступен для взаимодействия с субстратом O2. Это взаимодействие способствует связыванию O2, но не оксид углерода (CO), который все еще связывает примерно в 240 раз сильнее, чем O2.
Связывание O2 вызывает существенные структурные изменения в центре Fe, который сжимается по радиусу и перемещается в центр кармана N4. О2-связывание индуцирует "спаривание спинов": пятикоординатная форма дезокси железа высокое вращение а шестикоординатная кислородная форма - это низкоспиновая и диамагнитный.[нужна цитата ]

Синтетические аналоги
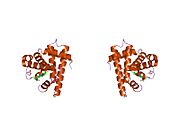
Многие модели миоглобина были синтезированы в рамках широкого интереса к дикислородные комплексы переходных металлов. Хорошо известным примером является штакетник из порфирина, который состоит из комплекса железа и пространственно объемного производного тетрафенилпорфирин.[29] При наличии имидазол лиганд, этот комплекс двухвалентного железа обратимо связывает O2. О2 Подложка имеет изогнутую геометрию, занимая шестую позицию в центре железа. Ключевым свойством этой модели является медленное образование μ-оксодимера, который находится в неактивном диферрическом состоянии. В природе такие пути дезактивации подавляются белковой матрицей, которая предотвращает близкое сближение ансамблей Fe-порфиринов.[30]
 Порфириновый комплекс Fe из штакетника с аксиальными координационными центрами, занятыми метилимидазолом (зеленый) и дикислород. Группы R фланкируют O2-обвязка сайта.
Порфириновый комплекс Fe из штакетника с аксиальными координационными центрами, занятыми метилимидазолом (зеленый) и дикислород. Группы R фланкируют O2-обвязка сайта.
Смотрите также
- Цитоглобин
- Гемоглобин
- Гемопротеин
- Нейроглобин
- Фитоглобин
- Миоглобинурия - Наличие миоглобина в моче
- Ишемически-реперфузионное повреждение аппендикулярно-мышечной системы
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000198125 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000018893 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Ordway GA, Гарри DJ (сентябрь 2004 г.). «Миоглобин: важный гемопротеин в поперечно-полосатой мышце». Журнал экспериментальной биологии. 207 (Pt 20): 3441–6. Дои:10.1242 / jeb.01172. PMID 15339940.
- ^ Вик MR, Хорник JL (2011). «Иммуногистология мягких тканей и костных новообразований». Диагностическая иммуногистохимия. Эльзевир. С. 83–136. Дои:10.1016 / b978-1-4160-5766-6.00008-х. ISBN 978-1-4160-5766-6.
Миоглобин - это белок массой 17,8 кДа, который находится исключительно в скелетных мышцах и образует комплексы с молекулами железа.
- ^ Фехер Дж (2017). «Транспорт кислорода и углекислого газа». Количественная физиология человека. Эльзевир. С. 656–664. Дои:10.1016 / b978-0-12-800883-6.00064-1. ISBN 978-0-12-800883-6.
Высокоокислительные мышечные волокна содержат много миоглобина. Он выполняет две функции в мышцах: накапливает кислород для использования во время тяжелых упражнений и усиливает диффузию через цитозоль перенося кислород. Связывая O2, миоглобин (Mb) обеспечивает второй путь диффузии O2 через цитозоль клетки.
- ^ а б Уилсон MT, Ридер Б.Дж. (2006). "МИОГЛОБИН". Энциклопедия респираторной медицины. Эльзевир. С. 73–76. Дои:10.1016 / b0-12-370879-6 / 00250-7. ISBN 978-0-12-370879-3.
Миоглобин (Mb) представляет собой гем-содержащий глобулярный белок, который в изобилии обнаружен в клетках миоцитов сердца и скелетных мышц.
- ^ Boncyk JC (2007). «Периоперационная гипоксия». Осложнения при анестезии. Эльзевир. С. 193–199. Дои:10.1016 / b978-1-4160-2215-2.50052-1. ISBN 978-1-4160-2215-2.
Миоглобин служит одновременно буфером O2 и хранит O2 в мышцах. Все известные миоглобины позвоночных и субъединицы β-гемоглобина похожи по структуре, но миоглобин связывает O2 более активно при низком Po2 (рис. 47-5), потому что он является мономером (т.е. он не претерпевает значительных конформационных изменений при оксигенации). Таким образом, миоглобин остается полностью насыщенным при напряжении O2 между 15 и 30 мм рт. Ст. И выгружает свой O2 в митохондрии мышц только при очень низком напряжении O2.
- ^ Hardison RC (декабрь 2012 г.). «Эволюция гемоглобина и его генов». Cold Spring Harb Perspect Med. 2 (12): a011627. Дои:10.1101 / cshperspect.a011627. ЧВК 3543078. PMID 23209182.
- ^ Чанг MJ, Brown DL (июль 2018 г.). «Диагностика острого инфаркта миокарда.». В Браун DL (ред.). Электронная книга по интенсивной терапии сердца. С. 91–98.e3. Дои:10.1016 / B978-0-323-52993-8.00009-6. ISBN 9780323529938.
Однако миоглобин неспецифичен для некроза миокарда, особенно при наличии повреждения скелетных мышц и почечная недостаточность.
- ^ Сехон Н, Павлин ВФ (2019). «Биомаркеры для помощи в оценке боли в груди». Биомаркеры сердечно-сосудистых заболеваний. Эльзевир. С. 115–128. Дои:10.1016 / b978-0-323-54835-9.00011-9. ISBN 978-0-323-54835-9.
миоглобин неспецифичен для гибели сердечных миоцитов, и его уровень может быть повышен в почечная болезнь а также повреждение скелетных мышц.
- ^ а б Нельсон Д.Л., Кокс М.М. (2000). Принципы биохимии Ленингера (3-е изд.). Нью-Йорк: Издательство Worth. п. 206. ISBN 0-7167-6203-X. (Ссылка на книги Google - издание 2008 г.)
- ^ (США) Национальный научный фонд: хронология банка данных по белкам (21 января 2004 г.). Проверено 3.17.2010
- ^ Кендрю Дж. К., Бодо Дж., Динцис Х. М., Пэрриш Р. Г., Вайкофф Х., Филлипс, округ Колумбия (март 1958 г.). «Трехмерная модель молекулы миоглобина, полученная методом рентгеновского анализа». Природа. 181 (4610): 662–6. Bibcode:1958Натура.181..662K. Дои:10.1038 / 181662a0. PMID 13517261. S2CID 4162786.
- ^ Нобелевская премия по химии 1962 г.
- ^ Гарри DJ, Канатус С.Б., Маммен П.П. (2007). «Молекулярное понимание функциональной роли миоглобина». Достижения экспериментальной медицины и биологии. 618: 181–93. Дои:10.1007/978-0-387-75434-5_14. ISBN 978-0-387-75433-8. PMID 18269197.
- ^ Акабоши Э. (1985). «Клонирование гена миоглобина человека». Ген. 33 (3): 241–9. Дои:10.1016/0378-1119(85)90231-8. PMID 2989088.
- ^ Харви JW (2008). «Метаболизм железа и его нарушения». Клиническая биохимия домашних животных. Эльзевир. С. 259–285. Дои:10.1016 / b978-0-12-370491-7.00009-х. ISBN 978-0-12-370491-7.
Миоглобин - это связывающий кислород белок, расположенный в основном в мышцах. Миоглобин служит локальным резервуаром кислорода, который может временно обеспечивать кислородом, когда доставка кислорода в кровь недостаточна в периоды интенсивной мышечной активности. Железо внутри гемовой группы должно быть в состоянии Fe + 2, чтобы связывать кислород. Если железо окисляется до состояния Fe + 3, образуется метмиоглобин.
- ^ Макги Х (2004). О еде и кулинарии: наука и знания о кухне. Нью-Йорк: Скрибнер. п. 148. ISBN 0-684-80001-2.
- ^ Fraqueza MJ, Barreto AS (сентябрь 2011 г.). «Использование газовых смесей для увеличения срока хранения мяса индейки при упаковке в модифицированной атмосфере: влияние окиси углерода». Птицеводство. 90 (9): 2076–84. Дои:10.3382 / пс.2011-01366. PMID 21844276.
- ^ «Мясные компании защищают использование окиси углерода». Бизнес. Миннеаполис Стар Трибьюн. Ассошиэйтед Пресс. 2007-10-30. Архивировано из оригинал на 2013-12-25. Получено 2013-02-11.
- ^ Берридж Б.Р., Ван Влит Дж.Ф., Герман Э. (2013). «Сердечные, сосудистые и скелетные мышечные системы». Справочник Хашека и Руссо по токсикологической патологии. Эльзевир. С. 1567–1665. Дои:10.1016 / b978-0-12-415759-0.00046-7. ISBN 978-0-12-415759-0.
Миоглобин - это низкомолекулярный связывающий кислород гем-белок, который содержится исключительно в клетках сердца и скелетных мышц. В крови миоглобин связывается в первую очередь с глобулинами плазмы, комплексом, который фильтруется почками. Если концентрация в плазме превышает связывающую способность плазмы (1,5 мг / дл у человека), миоглобин начинает появляться в моче. Высокие концентрации миоглобина могут изменить цвет мочи до темно-красно-коричневого цвета.
- ^ Нака Т., Джонс Д., Болдуин И., Фили Н., Бейтс С., Гоель Х., Моргера С., Ноймайер Х. Х., Белломо Р. (апрель 2005 г.). «Клиренс миоглобина путем гемофильтрации с сверхвысоким потоком в случае тяжелого рабдомиолиза: клинический случай». Критический уход. 9 (2): R90-5. Дои:10.1186 / cc3034. ЧВК 1175920. PMID 15774055.
- ^ Вебер М., Рау М., Мадленер К., Эльзессер А., Банкович Д., Митрович В., Хамм С. (ноябрь 2005 г.). «Диагностическая ценность новых иммуноанализов на сердечные маркеры cTnI, миоглобин и массу CK-MB». Клиническая биохимия. 38 (11): 1027–30. Дои:10.1016 / j.clinbiochem.2005.07.011. PMID 16125162.
- ^ Дасгупта А., Вахед А. (2014). «Кардиологические маркеры». Клиническая химия, иммунология и лабораторный контроль качества. Эльзевир. С. 127–144. Дои:10.1016 / b978-0-12-407821-5.00008-5. ISBN 978-0-12-407821-5.
Миоглобин - это гемовый белок, который содержится как в скелетных, так и в сердечных мышцах. Миоглобин обычно попадает в кровоток уже через 1 час после инфаркта миокарда ... Миоглобин имеет плохую клиническую специфичность из-за присутствия большого количества миоглобина в скелетных мышцах. Некоторые исследования предлагают добавить тест на миоглобин к тропонин I тест с целью повышения диагностической ценности [4]. Миоглобин, представляющий собой небольшой белок, выводится с мочой, а высокий уровень миоглобина в сыворотке крови встречается у пациентов с острой почечной недостаточностью (уремический синдром ). Острая почечная недостаточность также является осложнением рабдомиолиза, ...
- ^ Драго Р.С. (1980). «Свободнорадикальные реакции систем переходных металлов». Обзоры координационной химии. 32 (2): 97–110. Дои:10.1016 / S0010-8545 (00) 80372-0.
- ^ а б Регистрационный номер универсального белкового ресурса P02144 в UniProt.
- ^ Коллман Дж. П., Брауман Дж. И., Халберт Т. Р., Суслик К. С. (октябрь 1976 г.). «Природа связывания O2 и CO с металлопорфиринами и гемовыми белками». Труды Национальной академии наук Соединенных Штатов Америки. 73 (10): 3333–7. Bibcode:1976PNAS ... 73.3333C. Дои:10.1073 / пнас.73.10.3333. ЧВК 431107. PMID 1068445.
- ^ Липпард SJ, Берг JM (1994). Принципы биоинорганической химии. Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 0-935702-73-3.
дальнейшее чтение
- Коллман Дж. П., Булатов Р., Сандерленд С. Дж., Фу Л. (февраль 2004 г.). «Функциональные аналоги цитохром с оксидазы, миоглобина и гемоглобина». Химические обзоры. 104 (2): 561–88. Дои:10.1021 / cr0206059. PMID 14871135.
- Ридер Б.Дж., Свистуненко Д.А., Cooper CE, Wilson MT (декабрь 2004 г.). «Радикальная и окислительно-восстановительная химия миоглобина и гемоглобина: от исследований in vitro до патологии человека». Антиоксиданты и редокс-сигналы. 6 (6): 954–66. Дои:10.1089 / ars.2004.6.954. PMID 15548893.
- Schlieper G, Kim JH, Molojavyi A, Jacoby C, Laussmann T., Flögel U, Gödecke A, Schrader J (апрель 2004 г.). «Адаптация мышей с нокаутом миоглобина к гипоксическому стрессу». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология. 286 (4): R786-92. Дои:10.1152 / ajpregu.00043.2003. PMID 14656764. S2CID 24831969.
- Takano T (март 1977 г.). «Структура миоглобина уточнена с разрешением 2-0 A. II. Структура дезоксимиоглобина кашалота». Журнал молекулярной биологии. 110 (3): 569–84. Дои:10.1016 / S0022-2836 (77) 80112-5. PMID 845960.
- Рой А., Сен С., Чакраборти А.С. (февраль 2004 г.). «Неферментативное гликирование in vitro усиливает роль миоглобина как источника окислительного стресса». Свободные радикальные исследования. 38 (2): 139–46. Дои:10.1080/10715160310001638038. PMID 15104207. S2CID 11631439.
- Стюарт Дж. М., Блейкли Дж. А., Карпович П. А., Каланши Е., Тэтчер Б. Дж., Мартин Б. М. (март 2004 г.). «Необычно слабое связывание кислорода, физические свойства, частичная последовательность, скорость автоокисления и потенциальный сайт фосфорилирования миоглобина белухи (Delphinapterus leucas)». Сравнительная биохимия и физиология B. 137 (3): 401–12. Дои:10.1016 / j.cbpc.2004.01.007. PMID 15050527.
- Ву Г., Уэйнрайт Л. М., Пул Р. К. (2003). Микробные глобины. Успехи микробной физиологии. 47. С. 255–310. Дои:10.1016 / S0065-2911 (03) 47005-7. ISBN 9780120277476. PMID 14560666.
- Мирчета С., Синьор А. В., Бернс Дж. М., Коссинс А. Р., Кэмпбелл К. Л., Беренбринк М. (июнь 2013 г.). «Эволюция способности млекопитающих нырять, отслеживаемая чистым поверхностным зарядом миоглобина». Наука. 340 (6138): 1234192. Дои:10.1126 / наука.1234192. PMID 23766330. S2CID 9644255.. Также см Статья Proteopedia об этом открытии
внешняя ссылка
- Онлайн-менделевское наследование в человеке (OMIM): 160000 генетика человека
- Белок миоглобина
- RCSB PDB представленная молекула
- Какой вариант старше? (Это вопрос с подвохом) New York Times, 21 февраля 2006 г., статья об использовании в мясной промышленности угарного газа для сохранения красного цвета мяса.
- Магазины реагируют на отчеты о мясе New York Times, 1 марта 2006 г. Статья об использовании окиси углерода для придания мясу свежести.
- Обзор всей структурной информации, доступной в PDB за UniProt: P02144 (Человеческий миоглобин) в PDBe-KB.