Трис (диметиламино) метан - Tris(dimethylamino)methane
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК N,N,N′,N′,N″,N″ -Гексаметилметантриамин | |
| Другие имена N,N,N,N,N,N-гексаметилметантриамин [бис (диметиламино) метил] диметиламин | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ECHA InfoCard | 100.024.804 |
PubChem CID | |
| |
| |
| Характеристики | |
| C7ЧАС19N3 | |
| Молярная масса | 145.250 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Трис (диметиламино) метан (TDAM) - простейший представитель трис (диалкиламино) метанов общей формулы (R2N)3CH, в котором три из четырех атомов водорода метана заменены диметиламиногруппами (-N (CH3)2).[1] Трис (диметиламино) метан можно рассматривать как амин и ортоамид.
Трис (диметиламино) метан является сильным основанием и может использоваться в качестве формилирующий агент, так как реагент аминометиленирования и как источник основного бис (диметиламино)карбен формулы (R2N)2C∶.[2]
Подготовка
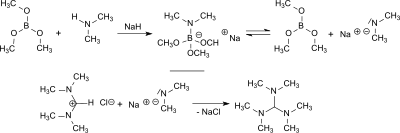
Трис (диметиламино) метан образуется в реакции N, N, N ', N'-Тетраметилформамидин хлорид (TMF-Cl)[1][3][4] или бис (диметиламино) ацетонитрил[5] с диметиламид лития или диметиламид натрия с доходностью от 55 до 84%.[2]
Из диметиламина и триметоксиборан диметиламид натрия образуется на месте в присутствии гидрид натрия который реагирует с N,N,N′,N'-Тетраметилформамидиния хлорид с выходом 84% до трис (диметиламино) метана и с бис (диметиламино) ацетонитрилом с выходом 77%.[6]
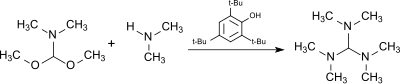
Реакция диметилформамида (ДМФ) диметилацеталь, HC (OCH3)2N (CH3)2, (из DMF–диметилсульфатный комплекс и метоксид натрия[7]) с диметиламин в присутствии кислотного катализатора 2,4,6-три-терт-бутилфенол (который в значительной степени устойчив к алкилирующий агент ) производит трис (диметиламино) метан.[8]
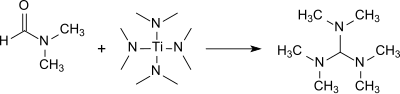
Трис (диметиламино) метан образуется с хорошим выходом (83%) в реакции ДМФА с тетракис (диметиламино) титан (IV).[9]
N,N,N′,N′,N″,N″ -Гексаметилгуанидиния хлорид (легко получается из диметиламина и N,N,N′,N'-Тетраметилхлорформамидиния хлорид, полученный из тетраметилмочевина и фосген[10]) образует трис (диметиламино) метан с выходом 53% под воздействием восстановителя натрия бис (2-метоксиэтокси) алюмогидрида (Red-Al).[11]
Гидрид натрия и триметилборат уменьшать N,N,N′,N′,N″,N″ -Гексаметилгуанидиния хлорид с выходом 80% до трис (диметиламино) метана.[6]
Характеристики
Трис (диметиламино) метан - прозрачная, бесцветная или бледно-желтая жидкость с сильным аммиачным запахом. Соединение легко смешивается со многими неполярными апротонными и безводными растворителями. Однако при нагревании трис (диметиламино) метан реагирует с протонные растворители (например, вода или спирты), но также со слабыми CH-азидными веществами, такими как ацетон или ацетонитрил.[2]
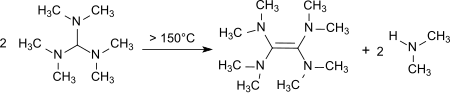
При нагревании до 150–190 ° С происходит разложение с образованием тетракис (диметиламино) этен,[12] сильный донор электронов.[13]
Приложения
Трис (диметиламино) метан диссоциирует на N,N,N′,NКатионы '-тетраметилформамидиния и анионы диметиламида, которые отрывают протоны от CH- и NH-кислотных соединений. Образованные таким образом анионы присоединяются к катионам формамидиния, которые, в свою очередь, устраняют диметиламин и реагируют с образованием диметиламинометиленовых соединений (= CH − N (CH3)2) или амидины путем аминометиленирования.[1]
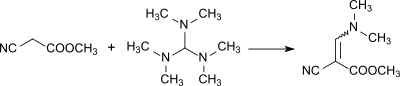
Реакция образования метил-α-циано-β-диметиламиноакрилата:
Реакция на форму N,N-диметил-N′-п-нитрофенилформамидин:
Аминометиленирование обеспечивает промежуточные соединения для синтеза гетероциклов, таких как пиримидины, пиразолы, 1,4-дигидропиридины и индолы.
N,N,N′,N′ -Тетраметилселеномочевина доступен при длительном нагревании трис (диметиламино) метана с селен в ксилол, бис (диметиламино) карбен предлагается в качестве промежуточного продукта.[14]
Рекомендации
- ^ а б c Bredereck, H .; Effenberger, F .; Брендл, Т. (1966). "Synthese und Reaktionen von Trisdimethylaminomethan" [Синтез и реакция трис (диметиламино) метана]. Angewandte Chemie (на немецком). 78 (2): 147–148. Дои:10.1002 / ange.19660780212.
- ^ а б c Кантленер, В. (2001). «Трис (диметиламино) метан». Энциклопедия реагентов для органического синтеза, 8 томов. Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rt403. ISBN 0471936235.
- ^ DE 1217391, Bredereck, H .; Effenberger, F. & Brendle, T., "Verfahren zur Herstellung von Tris-dimethylaminomethan", выпущенный 1966-12-08, передан Бредереку, Х.
- ^ Bredereck, H .; Effenberger, F .; Brendle, T .; Глушитель, Х. (1968). "Ортоамид. В. Синтез фон Трис-диалкиламино-метанен" [Ортоамиды. V. Синтез трис (диметиламино) метана. Chemische Berichte (на немецком). 101 (5): 1885–1888. Дои:10.1002 / cber.19681010541.
- ^ Kantlehner, W .; Maier, T .; Speh, P. (1979). «Трис (диалкиламино) метан и тетраалкилформамидиний-тиоцианат aus бис (диалкиламино) ацетонитрилен» [трис (диалкиламино) метаны и тетраалкилформамидиния тиоцианаты из бис (диалкиламино) ацетонитрилов]. Синтез (на немецком). 1979 (5): 342–343. Дои:10.1055 / с-1979-28671.
- ^ а б Kantlehner, W .; Штиглиц, Р .; Hauber, M .; Haug, E .; Регеле, К. (2000). "Ортоамид. LII. Beiträge zur Synthese von Orthocarbonsäureamiden" [Ортоамиды. LII. Статьи по синтезу ортоамидов карбоновых кислот. Journal für praktische Chemie (на немецком). 342 (3): 256–268. Дои:10.1002 / (SICI) 1521-3897 (200003) 342: 3 <256 :: AID-PRAC256> 3.0.CO; 2-G.
- ^ Bredereck, H .; Effenberger, F .; Симхен, Г. (1961). "Reaktionsfähige Säureamid-Dimethylsulfat-Komplexe" [Реактивные кислотно-амидно-диметилсульфатные комплексы]. Angewandte Chemie (на немецком). 73 (14): 493. Дои:10.1002 / ange.19610731407.
- ^ DE 2214497, Leimgruber, W. & Wick, A.E., "Verfahren zur Herstellung eines aminosubstituierten Methanderivates", выпущенный 1972-10-05, передан F. Hoffmann-La Roche & Co. AG
- ^ Weingarten, H .; Уайт, У.А. (1966). «Новая реакция аминирования производных карбоновой кислоты тетракис (диметиламино) титаном». Журнал Американского химического общества. 88 (4): 850. Дои:10.1021 / ja00956a049.
- ^ Kantlehner, W .; Haug, E .; Mergen, W. W .; Speh, P .; Maier, T .; Kapassakalidis, J. J .; Bräuner, H.J .; Хаген, Х. (1983). "Ein Herstellungsverfahren für N,N,N′,N′,N″,N″ -Гексаалкилгуанидиния-хлорид "[Процесс производства N,N,N′,N′,N″,N″ -Гексаалкилгуанидиния хлориды]. Синтез (на немецком). 1983 (11): 904–905. Дои:10.1055 / с-1983-30558.
- ^ Kantlehner, W .; Speh, P .; Бройнер, Х. Дж. (1983). "Eine einfache Synthese für Tris (dialkylamino) methane" [Простой синтез трис (диалкиламино) метанов]. Синтез (на немецком). 1983 (11): 905–906. Дои:10.1055 / с-1983-30559.
- ^ Bredereck, H .; Effenberger, F .; Бредерек, Х. Дж. (1966). "Eine neue Synthese von Tetra (dimethylamino) äthylen" [Новый синтез тетра (диметиламино) этилена]. Angewandte Chemie (на немецком). 78 (21): 984. Дои:10.1002 / ange.19660782113.
- ^ Wiberg, N .; Бухлер, Дж. У. (1962). «Тетракис (диметиламино) этилен: Ein starker Elektronendonator» [Тетракис (диметиламино) этилен: сильный донор электронов]. Angewandte Chemie (на немецком). 74 (14): 490–491. Дои:10.1002 / ange.19620741410.
- ^ Kantlehner, W .; Hauber, M .; Феттель, М. (1996). "Ортоамид. ИЛ. Umsetzungen von Orthoamid-Derivaten mit Schwefel und Selen, Synthesen von 1,3-Thiazol- und 1,3-Selenazolderivaten" [Ортоамиды. XLIX. Реакции производных ортоамида с серой и селеном, синтез производных 1,3-тиазола и 1,3-селеназола. Journal für praktische Chemie (на немецком). 338 (1): 403–413. Дои:10.1002 / prac.19963380180.