Винилциклопропановая перегруппировка - Vinylcyclopropane rearrangement
В винилциклопропановая перегруппировка или же винилциклопропан-циклопентеновая перегруппировка это реакция расширения кольца, превращая винилзамещенный циклопропан звонить в циклопентен звенеть.[1][2][3]

Интенсивные экспериментальные, а также компьютерные исследования показали, что механистически перегруппировку винилциклопропана можно рассматривать как двухступенчатый и / или контролируемый орбитальной симметрией перициклический процесс, опосредованный бирадикалами. Степень, с которой работает каждый из двух механизмов, сильно зависит от подложки.
Благодаря способности образовывать циклопентен В циклах винилциклопропановая перегруппировка несколько раз служила ключевой реакцией в синтезе сложных природных продуктов.
Происхождение и история
В 1959 году молодой химик-исследователь с Скромная нефть и нефтепереработка (Эссо, сейчас же Exxon ) названный Норман П. Нойрайтер получил указание найти новое применение излишкам бутадиен производится в результате одного из процессов нефтепереработки. Обсуждения о карбен химия с одним из самых уважаемых консультантов компании того времени, Уильям фон Эггерс Деринг, затем профессор в Йель, руководил молодым доктором философии. выпуститься из Северо-Западный университет следовать недавней процедуре, сочетающей карбены и бутадиен.[4]В частности, методика описывала реакцию 1,3-бутадиена с карбенами, образующимися при действии основания на хлороформ или же бромоформ, которые ранее были изучены Дерингом.[5] Затем Neureiter взял полученный 1,1-дихлор-2,2-диметилциклопропан и в условиях пиролиза (выше 400 ° C) обнаружил перегруппировку в 4,4-дихлорциклопентен, которая сегодня считается первой термической перегруппировкой винилциклопропан-циклопентен в истории. .[6]

Соответствующий полностью углеродный вариант реакции независимо сообщил Эмануэль Фогель.[7] и Overberger & Borchert всего через год после выхода публикации Neureiter.[8][9]Деринг, хотя и взаимодействовал с Humble Oil and Refining - а значит, и с Neureiter - в качестве консультанта, в публикации 1963 года заявил следующее: «Заслуга за открытие перегруппировки винилциклопропана в циклопентен принадлежит Овербергеру и Борхерту, а также Фогелю и др., Которые, кажется, независимо разработали несколько примеров перегруппировки».[10]Разработка дальнейших вариантов перегруппировки винилциклопропана не заняла много времени, как продемонстрировали Аткинсон и Рис в 1967 г.[11] Львовским в 1968 году.[12] и Paladini & Chuche в 1971 году.[13]
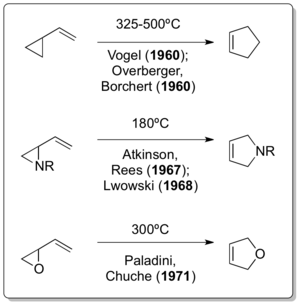
Примечательно, что классическая перегруппировка винилциклопропана была открыта после того, как два ее варианта с гетероатомом уже сообщались в течение почти 30 и 12 лет соответственно. Хотя считается, что перегруппировка винилцилкопропана должна была произойти во время Николай Демьянов получение винилциклопропана путем Устранение Хофмана при повышенных температурах в 1922 г.[14] Циклопропилимин-пирролиновая перегруппировка Клоком в 1929 г.[15] и перегруппировка циклопропилкарбальдегид-2,3-дигидрофурана Уилсона в 1947 г.[16] действительно являются единственными примерами винилциклопропан-подобных перегруппировок.

Этот последний тип реакции также известен как Перегруппировка Клока – Уилсона [17]
Механизм
Механистическая дискуссия о том, происходит ли перегруппировка винилциклопропана через двухступенчатый механизм, опосредованный бирадикалами, или через полностью согласованный механизм, управляемый орбитальной симметрией, ведется уже более полувека. Кинетические данные вместе с вторичными кинетическими изотопными эффектами, наблюдаемыми на винильном конце винилциклопропана, предполагают согласованный механизм, тогда как распределение продуктов указывает на ступенчато-бирадикальный механизм.[18]В 1960-х годах, вскоре после открытия перегруппировки, было установлено, что энергия активации винилциклопропановой перегруппировки составляет около 50 ккал / моль.[19] Кинетические данные, полученные для этой перегруппировки, согласуются с согласованным механизмом, при котором разрыв циклопропил-углерод-углеродной связи ограничивает скорость. Хотя согласованный механизм казался вероятным, вскоре было обнаружено, что энергия активации для разрыва углерод-углеродной связи в незамещенном циклопропане составляет 63 ккал / моль.[20] по энергии ровно на 13 ккал / моль выше, чем у исходной энергии активации, разница очень похожа на резонансную энергию аллильного радикала.[21] Сразу же люди начали ценить возможность образования бирадикального интермедиата в результате гомолитического расщепления слабой связи C1-C2-циклопропана в термических условиях.

Дискуссия о том, протекает ли перегруппировка винилциклопропана по полностью согласованному или двухступенчатому, несогласованному механизму, получила дальнейшее тщательное рассмотрение, когда Вудвард и Хоффманн использовали винилциклопропановую перегруппировку для иллюстрации [1,3] -сигматропных согласованных алкильных сдвигов в 1969 году.[22] Они выдвинули гипотезу, что, если бы согласованный механизм работал, последствия контролируемых факторов орбитальной симметрии позволили бы формировать только определенные продукты. Согласно их анализу винилциклопропана, замещенного тремя группами R, антарафациальный [1,3] -двиг связи 1,2 к C-5 с удерживанием на C-2, приводящий к ар циклопентен и супрафациальный [1,3] -двиг связи 1,2 к C-5 с инверсией в C-2, что приводит к циклопентену си допустимы симметрии, тогда как супрафациальный [1,3] -двиг связи 1,2 к C-5 с сохранением на C-2, приводящий к циклопентену SR и антарафациальный [1,3] -двиг связи 1,2 к C-5 с инверсией в C-2, приводящей к ай циклопентены запрещены по симметрии. Важно отметить, что Вудворд и Хоффманн основывали свой анализ исключительно на принципах сохранения теории орбитальной симметрии, не делая при этом никаких механистических или стереохимических предсказаний.

Внимание Вудворда и Хоффмана к винилциклопропановой перегруппировке как типичному примеру [1,3] -углеродных сдвигов явно повысило интерес к этой реакции. Кроме того, их анализ выявил потенциальные эксперименты, которые позволили бы различать согласованный или пошаговый механизм. Стереохимические последствия согласованного пути реакции на исход реакции предложили эксперимент, в котором можно было бы сопоставить полученную стереохимию реакции с предсказанной стереохимией реакции для модельного субстрата. Наблюдая за образованием ай- и SR-циклопентеновые продукты будут поддерживать идею о том, что действует пошаговый, несогласованный механизм, тогда как их отсутствие указывает на полностью согласованный механизм. Как оказалось, найти подходящий замещенный модельный субстрат для изучения стереохимического результата перегруппировки винилциклопропана было намного сложнее, чем предполагалось изначально, поскольку побочные реакции, такие как гомодиенильный [[[1,5] -водородный сдвиг]] и более термические стереомутации имеют тенденцию искажать стереохимические различия намного быстрее, чем перегруппировки приводят к циклопентеновым продуктам.

Несмотря на то, что деконволюция сложных кинетических сценариев, лежащих в основе этих перестроек, была сложной, было опубликовано несколько исследований, в которых была возможна точная и явная деконволюция кинетических и стереохимических исходных данных для учета стереохимических вкладов, возникающих в результате конкурентных стереомутаций.[18][23][24][25]
Таким образом, можно определить константы скорости для всех четырех стереохимически различных путей перегруппировки винилциклопропана.

Данные ясно показали, что механистические предпочтения перегруппировок зависят от системы. В то время как транс-винилциклопропаны имеют тенденцию к образованию большего количества допустимых симметрией ар- и си-циклопентены, поддерживающие согласованный механизм, СНГ-винилциклопропаны преимущественно дают запрещенный по симметрии ай- и SR- продукты, предполагающие более ступенчатый, бирадикальный механизм. Влияние эффектов заместителей на стереохимию реакции также становится очевидным из данных. Заместитель Во всех случаях, хотя все четыре продукта были сформированы, это указывает на то, что перициклические механизмы, контролируемые орбитальной симметрией, а также опосредованные бирадикалами двухступенчатые механизмы действуют в любом случае. Эти данные согласуются с образованием бирадикальных частиц на относительно плоской поверхности потенциальной энергии, допускающей ограниченную конформационную гибкость до образования продуктов. Степень конформационной гибкости и, следовательно, конформационная эволюция, доступная бирадикальным видам до образования продукта, зависит от строения поверхности потенциальной энергии. Это понятие также подтверждается вычислительной работой.[26] Обнаружено одно переходное состояние с сильным дирадикалоидным характером. Прослеживая поверхность потенциальной энергии пути реакции с наименьшей энергией, было обнаружено, что очень мелкий режим позволяет бирадикалам претерпевать конформационные изменения и реакции стереоизомеризации с незначительными энергетическими последствиями. Кроме того, было показано, что заместители могут способствовать стереоселективным путям, дестабилизируя частицы, которые позволяют стереохимическое скремблирование.
Разработка методологии
Возможно, самый большой недостаток перегруппировки винилциклопропана как синтетического метода - это присущий ей высокий активационный барьер, приводящий к очень высоким температурам реакции (500-600 ° C). Эти высокие температуры не только позволяют протекать побочным реакциям с аналогичной энергией активации, таким как гомодиенил - [[[1,5] -водородные сдвиги]], но также значительно ограничивают функциональные группы, допускаемые в субстратах. В химическом сообществе было хорошо известно, что для того, чтобы эта реакция стала полезным синтетическим методом, который, как мы надеемся, в какой-то момент применим в сложных природных продуктах, необходимо было провести некоторую разработку реакции. Некоторые из самых ранних попыток улучшить перегруппировку винилциклопропана как синтетический метод исходили от Кори группа в 1972 году.[27] Они обнаружили, что температура реакции может быть резко снижена, если циклопропановое кольцо содержит Дитиан группа. Несмотря на то, что дитиан-замещенные винилциклопропановые субстраты требовали двух этапов синтеза, начиная с соответствующих 1,3-диены метод хорошо зарекомендовал себя для синтеза различных замещенных циклопентены. Продукты немедленной перегруппировки могут быть легко преобразованы в соответствующие циклопентеноны.

Только год спустя Симпсон и его сотрудники продемонстрировали, что простые метоксизамещенные винилциклопропаны также демонстрируют значительно более высокие скорости реакции, что позволяет перегруппировке происходить при 220 ° C.[28]

Большое улучшение произошло в середине 1970-х годов с Барри М. Трост группа. Было обнаружено, что силоксивинилциклопропаны[29] а также аналогичные сульфинилвинилциклопропаны[30] можно использовать в качестве подложки для создания кольцевых циклопентен конструкции. Хотя эти реакции все еще требовали температуры реакции выше 300 ° C, они были способны производить полезные продукты, возникающие из аннулирование циклопентена в настоящую кольцевую систему.

Пакетт продемонстрировал, что перегруппировки винилциклопропана также могут опосредоваться фотохимически.[31][32] На особенно интригующем примере ему удалось показать, что винилциклопропаны, внедренные в циклооктан сердечник может быть преобразован в соответствующие [5-5] -плавленные кольцевые системы.

Дальнейшее улучшение реакции наступило, когда Худлики[33] и коричневый[34] доказано, что перегруппировки винилциклопропана поддаются переходный металл катализаторы. Используя катализатор ацетат Rh (I), они смогли ускорить перегруппировку от комнатной температуры до 80 ° C.

Аналогично ускорению скорости, наблюдаемому в анионно-кислороднойСправиться перестановкой Danheiser сообщил об очень похожем эффекте для винилциклопропановых субстратов, содержащих [алкокси] заместители.[35]

Еще один интригующий результат сообщил Ларсен в 1988 году.[36] Он смог способствовать перегруппировке винилциклопропана с помощью субстратов, таких как тот, который показан в реакции ниже, при температурах до -78 ° C. Подложки были созданы на месте при контакте с кольцом тиокарбонил Дильс-Альдер аддукты в основных условиях. Эта методология позволила образовать многочисленные высокофункциональные циклопентены в стереоселективный манера.

Другая низкотемпературная перегруппировка винилциклопропана была получена группой Худлики.[37] Объем этой конкретной методологии впечатляюще широк и позволяет формировать различные [5-5] - а также [5-6] -углеродные каркасы.

Использование в полном синтезе
Пятичленные углеродные кольца - это повсеместный структурный мотив в натуральных продуктах. В отличие от более крупного, полностью «согласного» циклогексан циклопентаны каркаса и их производные являются "диссонирующий "согласно Модель Лэпворта-Эванса переменной полярности. Диссонанс полярности явно ограничивает способы, которыми циклопентаны могут быть разъединены, что становится очевидным в уменьшении числа общих методов, доступных для создания пятичленных колец по сравнению с соответствующими шестичленными кольцами. Тем более, что нет Дильс-Альдер -эквивалент для синтеза пятичленных колец беспокоил химиков-синтетиков в течение многих десятилетий. Следовательно, после того, как примерно в 1960 году была обнаружена перегруппировка винилциклопропана, синтетическому сообществу не потребовалось много времени, чтобы осознать потенциал, присущий образованию циклопентенов посредством перегруппировки винилциклопропана. По мере развития методологии перегруппировки винилциклопропана и улучшения условий реакции в течение 1970-х годов, первые полные синтезы с использованием перегруппировки винилциклопропана начали появляться примерно в 1980 году. Ключевые цифры для применения этой реакции в полном синтезе были Барри М. Трост, Элиас Дж. Кори, Томас Худлики, Лео А. Пакетт,
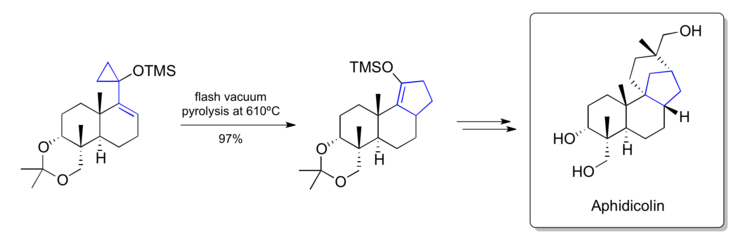
Синтез афидиколина Тростом (1979)
В 1979 году Трост сообщил о синтезе Афидиколин используя методологию перегруппировки винилциклопропана, разработанную в их собственной лаборатории.[38] На одном из своих ключевых шагов они смогли превратить силоксивинилциклопропан на поздней стадии в циклопентен, содержащий [6-6-5] -плавленный углеродный скелет, обнаруженный в природном продукте. Им удалось превратить переработанный продукт в натуральный продукт путем дальнейших манипуляций.
Синтез зизаена Пирсом (1979)
Синтез Пирса Zizaene - еще один ранний пример использования винилциклопропановой перегруппировки в качестве ключевого разрыва.[39]

Синтез Hudlicky хирстуэна (1980) и изокомена (1984)
Худлики был одной из ключевых фигур в продвижении перегруппировки винилциклопропана как метода и многократно использовался в синтезе сложных природных продуктов. Особенно изящная работа - это химия, разработанная для доступа как к линейным, так и к угловатым трихинанам, начиная с аналогичных предшественников. Он смог применить эту стратегию к гирсутин[40] и изокомен[41]

Синтез альфа-ветиспирена Пакеттом (1982)
Пакетт использовал перегруппировку винилциклопропана для построения спироциклический натуральный продукт альфа-ветиспирен 1982 г.[42]

Синтез Кори Антеридиоген-An (1985)
Элиас Дж. Кори внес большой вклад в развитие перегруппировки винилциклопропана как синтетического метода. В 1985 году Кори и его ученик, Эндрю Дж. Майерс, опубликовал впечатляющий синтез Антеридиоген -An с использованием перегруппировки винилциклопропана на поздней стадии, опосредованной кислотой Льюиса.[43]

Синтез биотина Нджардарсоном (2007)
Совсем недавно катализируемая медью перегруппировка гетероатом-винилциклопропан была использована для образования тетрагидротиофен ядро биотин и тиофен единица Плавикс соответственно.[44]

Синтез сальвиасперанола Мажетихом (2008)
В 2008 году кислотно-опосредованная перегруппировка винилциклопропана была использована для синтеза природного продукта сальвиасперанола.[45]

Смотрите также
Рекомендации
- ^ Мильвицкая, Э М; Тараканова, А В; Plate, Альфред Ф (1976). «Термические перегруппировки винилциклопропанов». Russ Chem. Rev. 45: 469–478. Дои:10.1070 / RC1976v045n05ABEH002675.
- ^ Goldschmidt, Z .; Краммер, Б. (1988). «Винилциклопропановые перегруппировки». Chem. Soc. Rev. 17: 229–267. Дои:10.1039 / CS9881700229.
- ^ Худлики, Томаш; Рид, Джозефин В. (2010). «От открытия до применения: 50 лет перегруппировки винилциклопропан-циклопентен и ее влияние на синтез натуральных продуктов». Angewandte Chemie International Edition. 49 (29): 4864–76. Дои:10.1002 / anie.200906001. PMID 20586104.
- ^ Вудворт, Роберт С.; Скелл, Филип С. (1957). «Реакции двухвалентного углерода. Добавление дигалокарбенов к 1,3-бутадиену». Варенье. Chem. Soc. 79 (10): 2542. Дои:10.1021 / ja01567a048.
- ^ Деринг, В. фон Э .; Хоффман, А. Кентаро (1954). «Добавление дихлоркарбена к олефинам». Варенье. Chem. Soc. 76 (23): 6162. Дои:10.1021 / ja01652a087.
- ^ Neureiter, Норман (1959). «Пиролиз 1,1-дихлор-2-винилциклопропана. Синтез 2-хлорциклопентадиена». J. Org. Chem. 24 (12): 2044. Дои:10.1021 / jo01094a621.
- ^ Фогель, Эмануэль (1960). "Кляйне Коленстофф-Ринге". Angewandte Chemie. 72: 4–26. Дои:10.1002 / ange.19600720103.
- ^ Overberger, C.G .; Борхерт, А. Э. (1960). «Новые термические перегруппировки, сопровождающие пиролиз ацетата в малых кольцевых системах». Варенье. Chem. Soc. 82 (4): 1007. Дои:10.1021 / ja01489a069.
- ^ Overberger, C.G .; Борхерт, А. Э. (1960). «Ионная полимеризация. XVI. Реакции 1-циклопропилэтанол-винилциклопропан». Варенье. Chem. Soc. 82 (18): 4896. Дои:10.1021 / ja01503a036.
- ^ Деринг, В. фон Э .; Ламберт, Дж. Б. (1963). «Термическая реорганизация a- и b-туджена: вырожденная перегруппировка типа винилциклопропана». Тетраэдр. 19 (12): 1989. Дои:10.1016/0040-4020(63)85013-9.
- ^ Аткинсон, Р. С .; Рис, К. В. (1967). «Перегруппировка винилазиридина в пирролин». Химические коммуникации (Лондон) (23): 1232a. Дои:10.1039 / C1967001232a.
- ^ Львовский, Вальтер; Райс, Сьюзен Н .; Львовский, Вальтер (1968). «Синглетные и триплетные нитрены. 111. Добавление карбетоксинитрена к 1,3-диенам». J. Org. Chem. 33 (22): 481. Дои:10.1021 / jo01266a001.
- ^ Паладини, Дж; Чуче, X. X. (1971). «Термическая перегруппировка эпоксидных винилов». Буквы Тетраэдра. 12 (46): 4383. Дои:10.1016 / S0040-4039 (01) 97447-7.
- ^ Демьянов, Н. Дж .; Дояренко, Мари (1922). "Убер-винилциклопропан, производное метилциклопропилкарбинолов и изомеризация циклопропановых колец". Бер. Dtsch. Chem. Ges. B. 55 (8): 2718. Дои:10.1002 / cber.19220550846.
- ^ Cloke, J. B .; Борхерт, А. Э. (1929). «Образование пирролинов из гамма-хлорпропил и циклопропилкетиминов». Варенье. Chem. Soc. 51 (18): 1174. Дои:10.1021 / ja01379a028.
- ^ Wilson, C.L .; Борхерт, А. Э. (1947). «Реакции фурановых соединений. VII. Термическое взаимопревращение 2,3-дигидрофурана и циклопропанового альдегида». Варенье. Chem. Soc. 69 (18): 3002. Дои:10.1021 / ja01204a020.
- ^ Органический синтез на основе именных реакций: практическое руководство по 750 трансформациям Альфред Хасснер, Ириши Намбутири Эльзевьер, 2012 г.
- ^ а б Болдуин, Джон Э. (2003). «Термические перегруппировки винилциклопропанов в циклопентены». Химические обзоры. 103 (4): 1197–212. Дои:10.1021 / cr010020z. PMID 12683781.
- ^ Цветы, М. С .; Рабинович, Б. С. (1960). «Термическая мономолекулярная изомеризация винилциклопропана в циклопентен». J. Chem. Soc. 82 (23): 3547. Дои:10.1021 / ja01508a008.
- ^ Schlag, E.W .; Рабинович, Б. С. (1960). «Кинетика реакций термической мономолекулярной изомеризации циклопропана-d2». Варенье. Chem. Soc. 82 (23): 5996. Дои:10.1021 / ja01508a008.
- ^ Egger, K. W .; Голден, Дэвид М .; Бенсон, Сидней В. (1964). «Катализируемая йодом изомеризация олефинов. 11. Резонансная энергия аллильного радикала и кинетика позиционной изомеризации 1-бутена». Варенье. Chem. Soc. 86 (24): 5420. Дои:10.1021 / ja01078a011.
- ^ Woodward, R. B .; Хоффманн, Р. (1969). «Сохранение орбитальной симметрии». Энгью. Chem. Int. Эд. 8 (11): 781. Дои:10.1002 / anie.196907811.
- ^ Gajewski, Joseph J .; Сквиччиарини, Майкл П. (1989). «Доказательства согласия в перегруппировке винилциклопропана. Повторное исследование пиролиза транс-1-метил-2- (1-трет-бутилэтенил) циклопропана». Журнал Американского химического общества. 111 (17): 6717. Дои:10.1021 / ja00199a035.
- ^ Gajewski, Joseph J .; Олсон, Лейф П. (1991). «Доказательства доминирующего пути супрафациальной инверсии в тепловом мономолекулярном винилциклопропане в циклопентен 1,3-сигматропный сдвиг». Журнал Американского химического общества. 113 (19): 7432. Дои:10.1021 / ja00019a056.
- ^ Gajewski, Joseph J .; Olson, Leif P .; Уиллкотт, М. Роберт (1996). "Свидетельства для концерта в термическом мономолекулярном винилциклопропане в сигматропный 1,3-сдвиг циклопентена". Журнал Американского химического общества. 118 (2): 299. Дои:10.1021 / ja951578p.
- ^ Houk, K. N .; Нендель, Майя; Уист, Олаф; Сторер, Джои В. (1997). «Винилциклопропан-циклопентен перегруппировка: прототип термической перегруппировки с участием конкурирующих бирадикалов, согласованных и ступенчатых механизмов». Журнал Американского химического общества. 119 (43): 10545. Дои:10.1021 / ja971315q.
- ^ Кори, Э. Дж .; Валинский, С. В. (1972). «Реакция 1,3-дитиения фторбората с 1,3-диенами. Синтез .DELTA.3-циклопентен-1-онов». Журнал Американского химического общества. 94 (25): 8932. Дои:10.1021 / ja00780a063.
- ^ Симпсон, Джон М .; Ричи, Герман Г. (1973). «Влияние метоксильных и фенильных заместителей на термические перегруппировки винилциклопропана». Буквы Тетраэдра. 14 (27): 2545. Дои:10.1016 / S0040-4039 (01) 96201-X.
- ^ Трост, Барри М .; Богданович, Митчелл Дж. (1973). «Новые синтетические реакции. IX. Простой синтез оксаспиропентанов, универсальных синтетических промежуточных продуктов». Журнал Американского химического общества. 95 (16): 5311. Дои:10.1021 / ja00797a036.
- ^ Трост, Барри М .; Кили, Дональд Э. (1976). «Новые синтетические методы. Стереоуправляемый подход к аннелированию циклопентана». Журнал Американского химического общества. 98: 248–250. Дои:10.1021 / ja00417a048.
- ^ Paquette, Leo A .; Михан, Джордж V .; Хензель, Ричард П .; Эйзембер, Ричард Ф. (1973). «Фотохимия сопряженных цис-бицикло [5.1.0] октенонов, цис- и транс-бицикло [5.2.0] нон-2-ен-4-онов и их метиленовых аналогов». Журнал органической химии. 38 (19): 3250. Дои:10.1021 / jo00959a004.
- ^ Paquette, Leo A .; Хензель, Ричард П .; Эйзембер, Ричард Ф. (1973). «Термохимическое поведение сопряженных цис-бицикло [5.1.0] октенонов, цис- и транс-бицикло [5.2.0] нон-2-ен-4-онов и их метиленовых аналогов». Журнал органической химии. 38 (19): 3257. Дои:10.1021 / jo00959a005.
- ^ Худлики, Томаш; Koszyk, Francis F .; Кутчан, Тони М .; Шет, Джагдиш П. (1980). «Аннулирование циклопентена путем внутримолекулярного присоединения диазокетонов к 1,3-диенам. Приложения к синтезу циклопентаноидных терпенов». Журнал органической химии. 45 (25): 5020. Дои:10.1021 / jo01313a003.
- ^ Браун, Ванесса; Браун, Джон М .; Conneely, John A .; Голдинг, Бернард Т .; Уильямсон, Дэвид Х. (1975). «Синтез и термолиз родиевых и иридиевых комплексов эндо-6-винилбицикло [3.1.0] гекс-2-ена. Металл-промотированный винилциклопропан в циклопентеновую перегруппировку». Журнал химического общества, Perkin Transactions 2 (1): 4. Дои:10.1039 / P29750000004.
- ^ Danheiser, Рик Л.; Мартинес-Давила, Карлос; Морен, Джон М. (1980). «Синтез 3-циклопентенолов путем алкокси-ускоренной перегруппировки винилциклопропана». Журнал органической химии. 45 (7): 1340. Дои:10.1021 / jo01295a045.
- ^ Ларсен, Скотт Д. (1988). «Стереоселективный синтез функционализированных циклопентенов через индуцированное основанием сокращение кольца тиокарбонильных аддуктов Дильса-Альдера». Журнал Американского химического общества. 110 (17): 5932–5934. Дои:10.1021 / ja00225a072.
- ^ Худлики, Томаш; Heard, Nina E .; Флеминг, Элисон (1990). «4-Силокси-.альфа-бромокротонат: новый реагент для [2 + 3] аннелирования, приводящего к оксигенированным циклопентенам при низких температурах». Журнал органической химии. 55 (9): 2570. Дои:10.1021 / jo00296a004.
- ^ Trost, B.M .; Нисимура, Йошио; Ямамото, Кагетоши (1979). «Полный синтез афидиколина». Варенье. Chem. Soc. 101 (5): 1328. Дои:10.1021 / ja00499a071.
- ^ Пирс, Э. (1979). "Аннелирование пятичленного кольца посредством термической перегруппировки a-циклопропил-ab-ненасыщенных кетонов: новый полный синтез (&) - зизаена". J. Chem. Soc. Chem. Commun. (24): 1138. Дои:10.1039 / C39790001138.
- ^ Худлики, Т .; Кутчан, Тони М .; Уилсон, Стивен Р .; Мао, Дэвид Т. (1980). «Полный синтез (рац) -гирсутин». Варенье. Chem. Soc. 102 (20): 6351. Дои:10.1021 / ja00540a036.
- ^ Худлики, Т .; Кавка, Миша; Хиггс, Лесли А .; Худликил, Томас (1984). «Стереоконтролируемый полный синтез изокомен сесквитерпенов». Tetrahedron Lett. 25 (23): 2447. Дои:10.1016 / S0040-4039 (01) 81201-6.
- ^ Пакетт, Л. А. (1982). «Краткий синтез (рац) -альфа-ветиспирена». Tetrahedron Lett. 23: 3227. Дои:10.1016 / s0040-4039 (00) 87576-0.
- ^ Кори, Э. Дж .; Майерс, Эндрю Г. (1985). «Полный синтез (rac) -антеридий-индуцирующего фактора (AAn, 2) папоротниковой анемии pbylfitidis. Уточнение стереохимии». Варенье. Chem. Soc. 107 (19): 5574. Дои:10.1021 / ja00305a067.
- ^ Njardarson, J. T .; Араки, H; Баторий, Л.А.; Макиннис, CE; Нджардарсон, JT (2007). «Высокоселективное расширение цикла винилтиранов, катализируемое медью: применение для синтеза биотина и гетероциклического ядра плавикса». Варенье. Chem. Soc. 129 (10): 2768–9. Дои:10.1021 / ja069059h. PMID 17302422.
- ^ Majetich, G .; Zou, G; Роща, Дж (2008). «Полный синтез (-) - сальвиасперанола». Орг. Латыш. 10 (1): 85–7. Дои:10.1021 / ol701743c. PMID 18052176.
