Семейство bcl-2 - Bcl-2 family
| Белки-регуляторы апоптоза, семейство Bcl-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
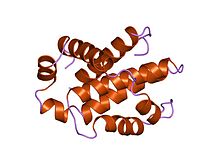 Структура человеческого Bcl-xL, ингибитора запрограммированной гибели клеток.[1] | |||||||||
| Идентификаторы | |||||||||
| Символ | Bcl-2 | ||||||||
| Pfam | PF00452 | ||||||||
| ИнтерПро | IPR002475 | ||||||||
| УМНАЯ | SM00337 | ||||||||
| PROSITE | PDOC00829 | ||||||||
| SCOP2 | 1маз / Объем / СУПФАМ | ||||||||
| OPM суперсемейство | 40 | ||||||||
| Белок OPM | 2l5b | ||||||||
| Мембранома | 232 | ||||||||
| |||||||||
Семейство Bcl-2 (ТК № 1.A.21 ) состоит из ряда эволюционно сохраненный белки, которые разделяют Bcl-2 гомология (BH) домены. Семейство Bcl-2 наиболее известно их регулированием апоптоз, форма запрограммированной гибели клеток, при митохондрия. Белки семейства Bcl-2 состоят из членов, которые либо способствуют, либо ингибируют апоптоз и контролируют апоптоз, управляя проницаемость внешней мембраны митохондрий (MOMP), который является ключевым этапом внутреннего пути апоптоза. К 2008 г. было идентифицировано 25 генов семейства Bcl-2.[2]
Структура
Белки семейства Bcl-2 имеют общую структуру, состоящую из гидрофобный α-спираль окружены амфипатическими α-спиралями. У некоторых членов семьи трансмембранные домены на их c-конце, которые в первую очередь функционируют, чтобы локализовать их в митохондрии.
Bcl-x (L) имеет длину 233 аминоацильных остатка (aas) и демонстрирует один очень гидрофобный предполагаемый трансмембранный α-спиральный сегмент (остатки 210-226), когда он находится в мембране. Гомологи Bcl-x включают белки Bax (крыса; 192 аминокислотных остатка) и Bak (мышь; 208 аминокислотных остатков), которые также влияют на апоптоз. Структура высокого разрешения мономерной растворимой формы человеческого Bcl-x (L) была определена с помощью рентгеновской кристаллографии и ЯМР.[4]
Структура состоит из двух центральных преимущественно гидрофобных α-спиралей, окруженных амфипатическими спиралями. Расположение α-спиралей в Bcl-X (L) похоже на то, что для дифтерийный токсин и колицины. Токсин дифтерии образует трансмембранную пору и перемещает токсичный каталитический домен в цитоплазму животных клеток. Колицины также образуют поры в липидных бислоях. Следовательно, структурная гомология предполагает, что члены семейства Bcl-2, которые содержат домены BH1 и BH2 (Bcl-X (L), Bcl-2 и Bax), действуют аналогичным образом.
Домены
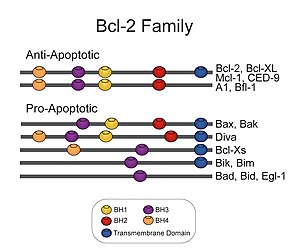
Члены семейства Bcl-2 разделяют одну или несколько из четырех характеристик домены из гомология названные домены гомологии Bcl-2 (BH) (названные BH1, BH2, BH3 и BH4) (см. рисунок). Известно, что домены BH имеют решающее значение для функционирования, поскольку удаление этих доменов посредством молекулярного клонирование влияет на выживаемость / скорость апоптоза. Белки против апоптоза Bcl-2, такие как Bcl-2 и Bcl-xL, сохраняют все четыре домена BH. Домены BH также служат для подразделения проапоптотических белков Bcl-2 на белки с несколькими доменами BH (например, Bax и Bak) или на те белки, которые имеют только домен BH3 (например, Бим Делать ставку и ПЛОХО )
Все белки, принадлежащие к семейству Bcl-2[5] содержат домен BH1, BH2, BH3 или BH4. Все антиапоптотические белки содержат домены BH1 и BH2, некоторые из них содержат дополнительный N-концевой Домен BH4 (Bcl-2, Bcl-x (L) и Bcl-w), который также наблюдается в некоторых проапоптотических белках, таких как Bcl-x (S), Diva, Bok-L и Bok-S. С другой стороны, все проапоптотические белки содержат домен BH3, необходимый для димеризации с другими белками семейства Bcl-2 и критический для их киллинговой активности, некоторые из них также содержат домены BH1 и BH2 (Bax и Bak). Домен BH3 также присутствует в некоторых антиапоптотических белках, таких как Bcl-2 или Bcl-x (L). Три функционально важных области гомологии Bcl-2 (BH1, BH2 и BH3) находятся в непосредственной пространственной близости. Они образуют удлиненную щель, которая может обеспечивать сайт связывания для других членов семейства Bcl-2.
Функция

Регулируемая гибель клеток (апоптоз ) вызвано такими событиями, как фактор роста синдром отмены и токсины. Он контролируется регуляторами, которые либо оказывают ингибирующее действие на запрограммированную гибель клеток (антиапоптотические), либо блокируют защитный эффект ингибиторов (проапоптотические).[6][7] Многие вирусы нашли способ противодействовать защитному апоптозу, кодируя свои собственные антиапоптозные гены, не позволяя своим клеткам-мишеням умирать слишком рано.
Bcl-x является доминирующим регулятором запрограммированной гибели клеток в клетках млекопитающих.[8][9] Полная форма (Bcl-x (L), проявляет активность репрессора гибели клеток, но короткая изоформа (Bcl-x (S)) и β-изоформа (Bcl-xβ) способствуют гибели клеток. Bcl-x (L), Bcl-x (S) и Bcl-xβ - три изоформы полученный альтернативный сплайсинг РНК.
Существует ряд теорий относительно того, как семейство генов Bcl-2 проявляет про- или антиапоптотический эффект. В важном говорится, что это достигается путем активации или деактивации внутреннего митохондриальная проницаемость переходная пора, который участвует в регулировании матрицы Ca2+, pH, и напряжение. Также считается, что некоторые белки семейства Bcl-2 могут индуцировать (проапоптотические члены) или ингибировать (антиапоптотические члены) высвобождение цитохром с в цитозоль который, оказавшись там, активирует каспазу-9 и каспазу-3, что приводит к апоптозу. Хотя Zamzami et al. предполагают, что высвобождение цитохрома с косвенно опосредуется порой PT на внутренней митохондриальной мембране,[10] веские доказательства предполагают более раннее значение MAC поры на внешней мембране.[11][12]
Другая теория предполагает, что Ро белки играют роль в активации Bcl-2, Mcl-1 и Bid. Ингибирование Rho снижает экспрессию антиапоптотических белков Bcl-2 и Mcl-1 и увеличивает уровни проапоптотических белков Bid, но не влияет на уровни Bax или FLIP. Ингибирование Rho вызывает каспазу-9 и каспазу-3-зависимый апоптоз культивируемых эндотелиальных клеток человека.[13]
Место действия
Эти белки локализованы на внешней митохондриальной мембране животной клетки, где, как считается, они образуют комплекс с порином зависимого от напряжения анионного канала (VDAC). Взаимодействие Bcl-2 с VDAC1 или пептидами, полученными из VDAC3, защищает от гибели клеток, ингибируя высвобождение цитохрома c. Было продемонстрировано прямое взаимодействие Bcl-2 с двухслойно восстановленным очищенным VDAC, при этом Bcl-2 уменьшал проводимость канала.[14]
Внутри митохондрий находятся апоптогенные факторы (цитохром с, Smac /Гомолог Diablo, Оми), которые, если их отпустить, активируют исполнителей апоптоза, каспасы.[15] В зависимости от их функции, после активации белки Bcl-2 либо способствуют высвобождению этих факторов, либо удерживают их в митохондриях. В то время как активированные проапоптотические Bak и / или Bax будут образовывать MAC и опосредует высвобождение цитохрома с, антиапоптотический Bcl-2 блокирует его, возможно, за счет ингибирования Bax и / или Bak.[16]
Белки семейства Bcl-2 также присутствуют в перинуклеарная оболочка и широко распространены во многих тканях организма. Их способность образовывать олигомерные поры в искусственных липидных бислоях была документально подтверждена, но физиологическое значение порообразования неясно. Каждый из этих белков обладает отличительными свойствами, включая некоторую степень ионной селективности.[17]
Транспортная реакция
Обобщенная транспортная реакция, предложенная для заключенных в мембрану олигомерных членов семейства Bcl-2:
- цитохром с (митохондриальное межмембранное пространство) ⇌ цитохром с (цитоплазма)
Семья только для BH3
Подмножество BH3-only белков семейства Bcl-2 содержит только один BH3-домен. Члены, содержащие только BH3, играют ключевую роль в развитии апоптоза. Члены семейства только для BH3 - это Bim, Bid, BAD и другие. Различные апоптотические стимулы вызывают экспрессию и / или активацию определенных членов семейства, содержащих только BH3, которые перемещаются в митохондрии и инициируют Bax / Bak-зависимый апоптоз.[18]
Примеры
Белки, которые, как известно, содержат эти домены, включают Bcl-2 позвоночных (альфа- и бета-изоформы) и Bcl-x (изоформы Bcl-x (L).
Смотрите также
- Ингибитор Bcl-2, противораковые препараты, нацеленные на это семейство белков
- База данных BCL-2, справочная база данных по белкам BCL-2
Рекомендации
- ^ Muchmore SW, Sattler M, Liang H, et al. (Май 1996 г.). «Рентгеновские лучи и структура ЯМР человеческого Bcl-xL, ингибитор запрограммированной гибели клеток». Природа. 381 (6580): 335–41. Bibcode:1996Натура.381..335М. Дои:10.1038 / 381335a0. PMID 8692274. S2CID 4279148.
- ^ Юл, Ричард Дж .; Штрассер, Андреас (2008). «Семейство белков BCL-2: противоположные действия, которые опосредуют гибель клеток». Обзоры природы Молекулярная клеточная биология. 9 (1): 47–59. Дои:10.1038 / nrm2308. PMID 18097445. S2CID 7033834.
- ^ Чао Д. Т., Корсмейер С. Дж. (1998). «Семейство BCL-2: регуляторы клеточной гибели». Анну. Преп. Иммунол. 16: 395–419. Дои:10.1146 / annurev.immunol.16.1.395. PMID 9597135.
- ^ Muchmore, S. W .; Sattler, M .; Liang, H .; Meadows, R.P .; Harlan, J. E .; Yoon, H. S .; Nettesheim, D .; Chang, B.S .; Томпсон, К. Б. (1996-05-23). «Рентгеновские лучи и структура ЯМР человеческого Bcl-xL, ингибитор запрограммированной гибели клеток». Природа. 381 (6580): 335–341. Bibcode:1996Натура.381..335М. Дои:10.1038 / 381335a0. ISSN 0028-0836. PMID 8692274. S2CID 4279148.
- ^ Рид Дж. К., Чжа Х, Эйме-Семпе С., Такаяма С., Ван Х. Г. (1996). Структурно-функциональный анализ белков семейства Bcl-2. Регуляторы запрограммированной гибели клеток. Adv. Exp. Med. Биол. Успехи экспериментальной медицины и биологии. 406. С. 99–112. Дои:10.1007/978-1-4899-0274-0_10. ISBN 978-1-4899-0276-4. PMID 8910675.
- ^ Vaux DL (1993). «Время бума некробиологии». Curr. Биол. 3 (12): 877–878. Дои:10.1016 / 0960-9822 (93) 90223-Б. PMID 15335822. S2CID 9638716.
- ^ Миллиман С.Л., Корсмейер С.Дж., Ван К., Инь Х.М., Чао Д.Т. (1996). «BID: новый агонист смерти, содержащий только домен BH3». Genes Dev. 10 (22): 2859–2869. Дои:10.1101 / gad.10.22.2859. PMID 8918887.
- ^ Boise, L.H .; González-García, M .; Postema, C.E .; Ding, L .; Lindsten, T .; Турка, Л. А .; Мао, X .; Nuñez, G .; Томпсон, К. Б. (27 августа 1993 г.). «bcl-x, ген, родственный bcl-2, который функционирует как доминантный регулятор апоптотической гибели клеток» (PDF). Клетка. 74 (4): 597–608. Дои:10.1016 / 0092-8674 (93) 90508-н. HDL:2027.42/30629. ISSN 0092-8674. PMID 8358789. S2CID 13542617.
- ^ Tsujimoto, Y .; Симидзу, С. (21 января 2000 г.). «Семейство Bcl-2: не на жизнь, а на смерть». Письма FEBS. 466 (1): 6–10. Дои:10.1016 / s0014-5793 (99) 01761-5. ISSN 0014-5793. PMID 10648802. S2CID 29229869.
- ^ Замзами Н., Бреннер С., Марзо И., Сусин С.А., Кремер Г. (апрель 1998 г.). «Субклеточный и субмитохондриальный механизм действия Bcl-2-подобных онкопротеинов». Онкоген. 16 (17): 2265–82. Дои:10.1038 / sj.onc.1201989. PMID 9619836.
- ^ Кинналли К.В., Антонссон Б. (май 2007 г.). «Рассказ о двух митохондриальных каналах, MAC и PTP, в апоптозе». Апоптоз. 12 (5): 857–68. Дои:10.1007 / s10495-007-0722-z. PMID 17294079.
- ^ Мартинес-Кабальеро С., Дежан Л. М., Йонас Е. А., Кинналли К. В. (июнь 2005 г.). «Роль митохондриального апоптоза канала MAC в высвобождении цитохрома с». J. Bioenerg. Биомер. 37 (3): 155–64. Дои:10.1007 / s10863-005-6570-z. PMID 16167172. S2CID 27152003.
- ^ Hippenstiel S, Schmeck B., N'Guessan PD, Seybold J, Krüll M, Preissner K, Eichel-Streiber CV, Suttorp N (октябрь 2002 г.). «Инактивация белка Rho индуцировала апоптоз культивируемых эндотелиальных клеток человека». Являюсь. J. Physiol. Lung Cell Mol. Физиол. 283 (4): L830–8. Дои:10.1152 / ajplung.00467.2001. PMID 12225960.
- ^ Арбель, Нир; Шошан-Бармац, Варда (26 февраля 2010 г.). «Пептиды на основе зависимого от напряжения анионного канала 1 взаимодействуют с Bcl-2 для предотвращения антиапоптотической активности». Журнал биологической химии. 285 (9): 6053–6062. Дои:10.1074 / jbc.M109.082990. ISSN 1083-351X. ЧВК 2825399. PMID 20037155.
- ^ Фесик С.В., Ши Й. (2001). «Управление каспасами». Наука. 294 (5546): 1477–1478. Дои:10.1126 / science.1062236. PMID 11711663. S2CID 11392850.
- ^ Дежан Л. М., Мартинес-Кабальеро С., Манон С., Кинналли К. В. (февраль 2006 г.). «Регулирование митохондриального канала, индуцированного апоптозом, MAC, белками семейства BCL-2». Биохим. Биофиз. Acta. 1762 (2): 191–201. Дои:10.1016 / j.bbadis.2005.07.002. PMID 16055309.
- ^ Antonsson, B .; Montessuit, S .; Lauper, S .; Eskes, R .; Мартину, Дж. К. (2000-01-15). «Олигомеризация Bax необходима для формирования каналов в липосомах и для запуска высвобождения цитохрома с из митохондрий». Биохимический журнал. 345 (2): 271–278. Дои:10.1042/0264-6021:3450271. ISSN 0264-6021. ЧВК 1220756. PMID 10620504.
- ^ Майкл Кастан; Abeloff, Martin D .; Армитаж, Джеймс О .; Нидерхубер, Джон Э. (2008). Клиническая онкология Абелова (4-е изд.). Филадельфия: Черчилль Ливингстон / Эльзевьер. ISBN 978-0-443-06694-8.
По состоянию на это редактирование, в этой статье используется контент из "1.A.21 Семейство Bcl-2 (Bcl-2)", который лицензирован таким образом, чтобы разрешить повторное использование в соответствии с Creative Commons Attribution-ShareAlike 3.0 Непортированная лицензия, но не под GFDL. Все соответствующие условия должны быть соблюдены.
