BglII - Википедия - BglII
Эта статья может быть слишком техническим для большинства читателей, чтобы понять. Пожалуйста помогите улучшить это к Сделайте это понятным для неспециалистов, не снимая технических деталей. (Февраль 2012 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Эндонуклеаза рестрикции BglII | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 структура эндонуклеазы рестрикции BstYI связан с неродственной ДНК | |||||||||
| Идентификаторы | |||||||||
| Символ | Эндонук-BglII | ||||||||
| Pfam | PF09195 | ||||||||
| Pfam клан | CL0236 | ||||||||
| ИнтерПро | IPR015278 | ||||||||
| SCOP2 | 1dfm / Объем / СУПФАМ | ||||||||
| |||||||||
BglII ограничение типа II эндонуклеаза изолированы от определенных штаммов Bacillus globigii.
Основная функция рестрикционных ферментов - защита генома хозяина от чужеродных ДНК, но они также могут принимать участие в рекомбинация и транспозиция.[1]
Как и большинство рестрикционных ферментов типа II, BglII состоит из двух идентичных субъединиц, образующих гомодимер вокруг двойной спирали ДНК. Каждый мономер состоит из 223 аминокислот и симметрично связывает обе стороны уникального палиндромный нуклеотидная последовательность AGATCT, расщепляющая подвижную фосфодиэфирную связь между первыми нуклеотидами аденина и гуанина на обеих цепях молекулы ДНК, создавая липкие концы с 5'-выступами на концах.
Будучи ферментом рестрикции типа II, BglII не требует АТФ (аденозинтрифосфат ) для его ферментативной функции, но требует только ассоциации с двухвалентный катион металла, скорее всего Mg2+. В отличие от других рестрикционных ферментов этого класса, BglII, как было показано, обладает некоторыми уникальными структурными характеристиками, такими как субдомен β-сэндвича, и, по-видимому, претерпевает уникальные конформационное изменение при димеризации,[2] но его общая структура и механизм катализа остаются совместимыми с другими ферментами рестрикции типа II.
Эндонуклеазы рестрикции играют очень важную роль в современных молекулярное клонирование техники. Благодаря уникальным сайтам распознавания / разрезания рестрикционные ферменты можно использовать для точного разрезания ДНК в определенных местах предсказуемым образом. После разрезания ДНК (обычно) обладает так называемым "липкие концы ", что затем может позволить фрагменту ДНК скрещивать в Вектор ДНК. Лигирующие ферменты используются для ковалентного связывания желаемого фрагмента с вектором для последующего клонирования ДНК.
| Идентификаторы | |
| Имя | BglII эндонуклеаза рестрикции |
| Entrez | 6173168 |
| PDB | 1ДФМ |
| ПРИСОЕДИНЕНИЕ № | Q45488 |
| Номер ЕС | 3.1.21.4 |
Механизм
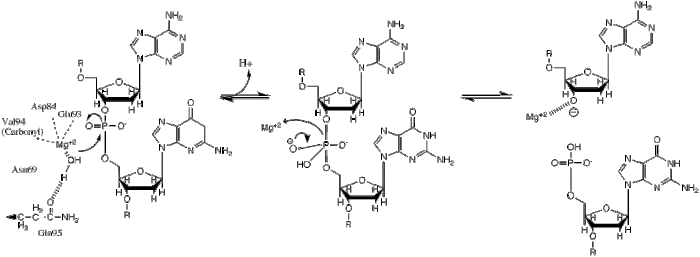 | Этот перенос фосфорила происходит путем нуклеофильной атаки иона гидрида на подвижный фосфат, что приводит к образованию тригонально-бипирамидного промежуточного фосфорного соединения. Затем фосфор замещается, и 3'-0- запускается как уходящая группа. |
BglII катализирует фосфодиэфирная связь расщепление в основной цепи ДНК за счет переноса фосфорила в воду.[1] Исследования механизма рестрикционных ферментов выявили несколько общих особенностей, которые кажутся верными почти во всех случаях, хотя реальный механизм для каждого фермента, скорее всего, представляет собой некоторую вариацию этого общего механизма. Этот механизм требует базы для генерации гидроксид-ион из воды, которая будет действовать как нуклеофил и атакуют фосфор в фосфодиэфирной связи. Также требуется кислота Льюиса для стабилизации дополнительного отрицательного заряда пентакоординированных переходное состояние фосфор, а также общий ион кислоты или металла, который стабилизирует уходящую группу (3’-O−).
Структура

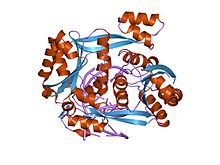
Хотя эндонуклеазы рестрикции демонстрируют небольшое сходство последовательностей, кристаллические структуры показывают, что все они имеют очень похожее ядро α / β, состоящее из шестицепочечного β-лист в окружении пяти α-спирали, два из которых опосредуют димеризацию.[1] Это ядро несет активный центр (каталитический центр) и остатки, которые контактируют с ДНК в большая канавка. BglII уникален тем, что его ядро α / β дополнено субдоменом β-сэндвича, который имеет несколько выступов, выходящих наружу для захвата ДНК, что позволяет BglII, чтобы полностью окружить молекулу ДНК. Эта нетипичная особенность BglII предполагает уникальное шарнирное движение для связывания и высвобождения ДНК.[2]Сравнительные структурные исследования свободного фермента и BglКомплекс II-ДНК показал, что фермент открывается резким ножничным движением, сопровождающимся полной перестройкой α-спиралей на границе раздела димеров. Эти структурные исследования также показали, что в каждом мономере набор остатков понижается или повышается, альтернативно секвестрируя или обнажая остатки активного сайта. Эти резкие различия в структуре свободного и связанного ферментов еще предстоит наблюдать в какой-либо другой эндонуклеазе рестрикции и, возможно, представляют собой новый механизм захвата ДНК, который может распространяться на другие белки, которые окружают ДНК.[2][3]
Активный сайт
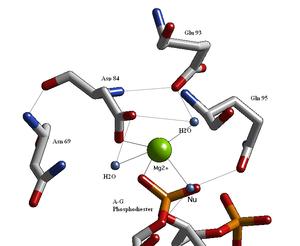
Структурные исследования эндонуклеаз выявили аналогичную архитектуру активного сайта с остатками, следующими за слабой консенсусной последовательностью Glu / Asp- (X)9-20-Glu / Asp / Ser-X-Lys / Glu. BglАктивный сайт II аналогичен активному сайту других эндонуклеаз, следуя последовательности Asp- (X)9-Glu-X-Gln. В его активном центре находится катион двухвалентного металла, скорее всего, Mg.2+, который взаимодействует с Asp-84, Val-94, фосфорильным кислородом и тремя молекулами воды. Одна из этих молекул воды способна действовать как нуклеофил из-за ее близости к подвижному фосфорилу (ее ориентация фиксируется водородной связью с амидным кислородом боковой цепи Gln-95.[1][4]) и его контакт с катионом металла (что снижает его pKа, способствуя нуклеофильности воды).
Смотрите также
- BamHI, фермент нуклеазы из 'Bacillus amyloliquefaciens..
- FokI, фермент нуклеазы из Flavobacterium okeanokoites
- EcoRI, фермент нуклеазы из 'Кишечная палочка.
Рекомендации
- ^ а б c d е ж Лукач К.М., Кучера Р., Шильдкраут И., Аггарвал А.К. (февраль 2000 г.). «Понимание неизменности рестрикционных ферментов: кристаллическая структура BglII и его ДНК-субстрата с разрешением 1,5 A». Структурная биология природы. 7 (2): 134–40. Дои:10.1038/72405. PMID 10655616.
- ^ а б c Лукач С.М., Кучера Р., Шильдкраут И., Аггарвал А.К. (февраль 2001 г.). «Структура свободного BglII обнаруживает беспрецедентное движение ножниц для открытия эндонуклеазы». Структурная биология природы. 8 (2): 126–30. Дои:10.1038/84111. PMID 11175900.
- ^ Гальбурт Э.А., Стоддард Б.Л. (февраль 2000 г.). «Эндонуклеазы рестрикции: одно из этих вещей не похоже на другие». Структурная биология природы. 7 (2): 89–91. Дои:10.1038/72450. PMID 10655603.
- ^ а б Pingoud A, Jeltsch A (сентябрь 2001 г.). «Структура и функция эндонуклеаз рестрикции II типа». Исследования нуклеиновых кислот. 29 (18): 3705–27. Дои:10.1093 / nar / 29.18.3705. ЧВК 55916. PMID 11557805.