ELK1 - ELK1
ETS Like-1 протеин Elk-1 это белок что у людей кодируется ELK1.[5] Elk-1 функционирует как активатор транскрипции. Он классифицируется как тройной комплексный фактор (TCF), подкласс Семья ETS, который характеризуется общим белковый домен что регулирует ДНК связывание с целевыми последовательностями. Elk1 играет важную роль в различных контекстах, в том числе Долгосрочная память формирование наркотическая зависимость, Болезнь Альцгеймера, Синдром Дауна, рак молочной железы, и депрессия.
Структура

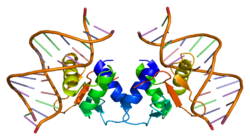
Как показано на рисунке 1, белок Elk1 состоит из нескольких доменов. Расположенный в N-концевой области, A-домен необходим для связывания Elk1 с ДНК. В этом регионе также есть сигнал ядерной локализации (NLS) и сигнал ядерного экспорта (NES), которые отвечают за ядерный импорт и экспорт соответственно. Домен B позволяет Elk1 связываться с димером своего кофактора, фактор ответа сыворотки (SRF). Расположенный рядом с B-доменом, R-домен участвует в подавлении транскрипционной активности Elk1. Этот домен содержит остатки лизина, которые могут подвергаться СУМОилирование, посттрансляционное событие, которое усиливает ингибирующую функцию домена R. Домен D играет ключевую роль в связывании активных Митоген-активированные протеинкиназы (МАРК). Расположенный в C-концевой области Elk1, домен C включает аминокислоты что на самом деле стало фосфорилированный компанией MAPKs. В этом регионе серины 383 и 389 являются ключевыми сайтами, которые необходимо фосфорилированный для прохождения транскрипции, опосредованной Elk1. Наконец, домен DEF специфичен для взаимодействия активированных киназа, регулируемая внеклеточными сигналами (Erk), разновидность MAPK, с Elk1.[6]
Выражение
Учитывая его роль фактор транскрипции, Elk1 экспрессируется в ядрах ненейрональных клеток. Белок присутствует в цитоплазме, а также в ядре зрелых нейронов.[6] В постмитотических нейронах вариант Elk1, sElk1, экспрессируется исключительно в ядре, потому что он лишен сайта NES, присутствующего в полноразмерном белке.[7] Более того, хотя Elk1 широко экспрессируется, фактические уровни варьируются в зависимости от тканей. Например, мозг крысы чрезвычайно богат Elk1, но белок экспрессируется исключительно в нейронах.[8]
Варианты сращивания
Помимо полноразмерного белка, ген Elk1 может давать две укороченные версии Elk1: ∆Elk1 и sElk1. Альтернативная сварка производит ∆Elk1. В этом варианте отсутствует часть ДНК-связывающего домена, которая позволяет взаимодействовать с SRF.[9] С другой стороны, sElk1 имеет интактную область, которая связывается с SRF, но в нем отсутствуют первые 54 аминокислоты, содержащие NES. Обнаруженный только в нейронах, sElk1 создается с помощью внутреннего сайта начала трансляции.[10] И ∆Elk1, и sElk1, усеченные версии полноразмерного белка, способны связываться с ДНК и индуцировать различные клеточные сигналы. Фактически, sElk1 противодействует Elk1 в дифференцировке нейронов и регуляции фактор роста нервов /ERK сигнализация.[8]
Сигнализация

Следующей мишенью Elk1 является сывороточный ответный элемент (SRE) c-fos протоонкоген.[11][12] Производить c-fos, белок, кодируемый Fos ген, Elk1 должен быть фосфорилированный MAPK на его C-конце.[13][14] MAPK - финальные эффекторы путей передачи сигнала, которые начинаются в плазматическая мембрана.[15] Фосфорилирование посредством MAPKs приводит к конформационному изменению Elk1.[16] Как видно на рисунке 2, Раф киназа действует перед MAPK, чтобы активировать их фосфорилирование и тем самым активируя киназы MEK или MAPK или ERK.[17][18][19][20] Сам Raf активируется Ras, который связан с рецепторами факторов роста с тирозинкиназа активность через Grb2 и СОС.[21] Grb2 и Sos могут стимулировать Ras только после связывания факторы роста к их соответствующим рецепторам. Однако активация Raf не зависит исключительно от Ras. Протеинкиназа С, которая активируется сложные эфиры форбола, может выполнять ту же функцию, что и Ras.[22] Киназа MEK (MEKK) также может активировать MEK, которые затем активируют MAPK, что иногда делает ненужным Raf.[23] Следовательно, различные пути передачи сигнала проходят через MEK и MAPK и приводят к активации Elk1. После стимуляции Elk1, SRF, который позволяет Elk1 связываться с c-fos промоутер, должен быть принят на работу. Связывание Elk1 с SRF происходит из-за белок-белкового взаимодействия между B-доменом Elk1 и SRF и взаимодействия белок-ДНК через A-домен.[6]
Вышеупомянутые белки подобны рецептам для определенного сигнального выхода. Если один из этих ингредиентов, например SRF, отсутствует, выводится другой результат. В этом случае отсутствие SRF приводит к активации Elk1 другого гена.[16] Таким образом, Elk1 может независимо взаимодействовать с сайтом связывания ETS, как в случае lck протоонкоген на рисунке 2.[16] Более того, расстояние и относительная ориентация сайта связывания Elk1 с SRE довольно гибкие,[24] предполагая, что SRE-регулируемые ранние гены, кроме c-fos могут быть целями Elk1. egr-1 является примером цели Elk1, которая зависит от взаимодействия SRE.[16] В конечном счете, фосфорилирование Elk1 может приводить к продукции многих белков, в зависимости от других вовлеченных факторов и их специфического взаимодействия друг с другом.
При изучении сигнальных путей мутации могут дополнительно подчеркнуть важность каждого компонента, используемого для активации нижестоящей мишени. Например, нарушение C-концевого домена Elk1, который MAPK фосфорилаты вызывает торможение c-fos активация.[16] Точно так же дисфункциональный SRF, который обычно привязывает Elk1 к SRE, приводит к Fos не транскрибируется.[21] В то же время без Elk1 SRF не может вызвать c-fos транскрипция после стимуляции MAPK.[16] По этим причинам Elk1 представляет собой важное звено между путями сигнальной трансдукции и инициацией транскрипции гена.
Клиническое значение
Долгосрочная память
Формирование Долгосрочная память может зависеть от Elk1. Ингибиторы МЕК блок Elk1 фосфорилирование и, таким образом, ослабление приобретенного условного отвращения к вкусу. Более того, обучение избеганию, при котором субъект узнает, что конкретная реакция ведет к предотвращению аверсивного стимула, коррелирует с определенным увеличением активации Erk, Elk1 и c-fos в гиппокамп. Эта область мозга участвует в краткосрочном и долгосрочном хранении информации. Когда связывание Elk1 или SRF с ДНК блокируется в гиппокампе крысы, только секвестрация SRF препятствует долгосрочному пространственная память. Хотя взаимодействие Elk1 с ДНК может не быть существенным для формирования памяти, его конкретная роль все еще нуждается в изучении. Это связано с тем, что активация Elk1 может запускать другие молекулярные события, которые не требуют, чтобы Elk1 связывался с ДНК. Например, Elk1 участвует в фосфорилирование из гистоны усиление взаимодействия с SRF и рекрутирование основного транскрипционного аппарата, все из которых не требуют прямого связывания Elk1 с ДНК.[6]
Наркотическая зависимость
Активация Elk1 играет центральную роль в наркотическая зависимость. После того, как мышам дают кокаин, сильное и мгновенное гиперфосфорилирование Erk и Elk1 наблюдается в полосатом теле. Когда этим мышам дают Ингибиторы МЕК, Elk1 фосфорилирование отсутствует. Без активного Elk1, c-fos производство и вызванные кокаином предпочтение условного места показаны заблокированными. Кроме того, острый этиловый спирт проглатывание приводит к чрезмерному фосфорилирование Elk1 в миндалина. Также было обнаружено, что заглушение активности Elk1 снижает клеточные ответы на сигналы отмены и длительное лечение опиоиды, один из старейших известных наркотиков в мире. В целом, эти результаты подчеркивают, что Elk1 является важным компонентом наркозависимости.[6]
Патофизиология
Наращивание бета-амилоид (Aβ) пептиды вызывают и / или запускают Болезнь Альцгеймера. Aβ мешает BDNF -индуцированный фосфорилирование из Elk1. Поскольку активация Elk1 затруднена на этом пути, регуляция генов, управляемая SRE, приводит к повышенной уязвимости нейронов. Elk1 также ингибирует транскрипцию пресенилин 1 (PS1), который кодирует белок, необходимый для последней стадии последовательного протеолитического процессинга белок-предшественник амилоида (ПРИЛОЖЕНИЕ). APP создает варианты Aβ (полипептид Aβ42 / 43). Более того, PS1 генетически связан с большинством ранних случаев семейной болезни Альцгеймера. Эти данные подчеркивают интригующую связь между Aβ, Elk1 и PS1.[6]
Еще одно условие, связанное с Elk1, - это Синдром Дауна. У эмбриональных и старых мышей с этим патофизиологическим заболеванием наблюдается снижение активности кальциневрин, основная фосфатаза для Elk1. У этих мышей также есть возрастные изменения активации ERK. Более того, выражение SUMO3, который подавляет активность Elk1, увеличивается у взрослых пациентов с синдромом Дауна. Следовательно, синдром Дауна коррелирует с изменениями в путях ERK, кальциневрина и SUMO, все из которых действуют антагонистически на активность Elk1.[6]
Elk1 также взаимодействует с BRCA1 варианты сплайсинга, а именно BRCA1a и BRCA1b. Это взаимодействие усиливает опосредованное BRCA1 подавление роста у рак молочной железы клетки. Elk1 может быть нижестоящей мишенью BRCA1 в его пути контроля роста. Недавняя литература показывает, что c-fos активность промотора подавляется, в то время как избыточная экспрессия BRCA1a / 1b снижает MEK-индуцированную активацию SRE. Эти результаты показывают, что один из механизмов подавления роста и опухоли белками BRCA1a / 1b действует через репрессию экспрессии следующих генов-мишеней Elk1, таких как Fos.[25]
Депрессия был связан с Elk1. Снижение Erk-опосредованного Elk1 фосфорилирование наблюдается в гиппокампе и префронтальная кора вскрытия головного мозга суицидальных людей. Несбалансированная передача сигналов Erk коррелирует с депрессией и суицидальным поведением. Будущие исследования покажут точную роль Elk1 в патофизиологии депрессии.[6]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000126767 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000009406 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Рао В.Н., Хюбнер К., Исобе М., Рушди А., Кроче С.М., Редди Е.С. (1989). «лося, тканеспецифические гены, связанные с ets, на хромосомах X и 14 вблизи точек разрыва транслокации». Наука. 244 (4900): 66–70. Дои:10.1126 / science.2539641. PMID 2539641.
- ^ а б c d е ж грамм час Беснард А., Галан-Родригес Б., Ванхаутте П., Кабоче Дж. (2011). «Elk-1 - фактор транскрипции с множеством аспектов в головном мозге». Front Neurosci. 5: 35. Дои:10.3389 / фнин. 2011.00035. ЧВК 3060702. PMID 21441990.
- ^ Sgambato V, Vanhoutte P, Pagès C, Rogard M, Hipskind R, Besson MJ, Caboche J (январь 1998 г.). «Экспрессия in vivo и регуляция Elk-1, мишени внеклеточного регулируемого сигнального пути киназы, в мозге взрослой крысы». J. Neurosci. 18 (1): 214–26. Дои:10.1523 / JNEUROSCI.18-01-00214.1998. ЧВК 6793414. PMID 9412502.
- ^ а б Янкнехт Р., Зинк Р., Эрнст У.Х., Нордхайм А (апрель 1994 г.). «Функциональное рассечение фактора транскрипции Elk-1». Онкоген. 9 (4): 1273–8. PMID 8134131.
- ^ Рао В. Н., Редди Е. С. (январь 1993 г.). «Delta elk-1, вариант elk-1, не может взаимодействовать с фактором ответа сыворотки и связывается с ДНК с модулированной специфичностью». Рак Res. 53 (2): 215–20. PMID 8417810.
- ^ Ванхаутте П., Ниссен Дж. Л., Бругг Б., Гаспера Б. Д., Бессон М. Дж., Хипскинд Р. А., Кабош Дж. (Февраль 2001 г.). «Противоположные роли Elk-1 и его специфической для мозга изоформы, короткого Elk-1, в дифференцировке PC12, индуцированной фактором роста нервов». J. Biol. Chem. 276 (7): 5189–96. Дои:10.1074 / jbc.M006678200. PMID 11050086.
- ^ Hipskind RA, Rao VN, Mueller CG, Reddy ES, Nordheim A (1991). «Ets-родственный белок Elk-1 гомологичен c-fos регуляторному фактору p62TCF». Природа. 354 (6354): 531–4. Bibcode:1991Натура.354..531H. Дои:10.1038 / 354531a0. PMID 1722028. S2CID 4305708.
- ^ Далтон С., Трейсман Р. (февраль 1992 г.). «Характеристика SAP-1, белка, завербованного фактором ответа сыворотки на элемент ответа сыворотки c-fos». Клетка. 68 (3): 597–612. Дои:10.1016 / 0092-8674 (92) 90194-Н. PMID 1339307. S2CID 26274460.
- ^ Gille H, Kortenjann M, Strahl T, Shaw PE (март 1996). «Зависимое от фосфорилирования образование четвертичного комплекса на c-fos SRE». Мол. Клетка. Биол. 16 (3): 1094–102. Дои:10.1128 / mcb.16.3.1094. ЧВК 231092. PMID 8622654.
- ^ Zinck R, Hipskind RA, Pingoud V, Nordheim A (июнь 1993 г.). «Активация и репрессия транскрипции c-fos коррелируют во времени со статусом фосфорилирования TCF». EMBO J. 12 (6): 2377–87. Дои:10.1002 / j.1460-2075.1993.tb05892.x. ЧВК 413468. PMID 8389697.
- ^ Маркс Дж (февраль 1993 г.). «Исследования клеточной смерти дают ключи к разгадке рака». Наука. 259 (5096): 760–1. Bibcode:1993Наука ... 259..760М. Дои:10.1126 / science.8430327. PMID 8430327.
- ^ а б c d е ж Janknecht R, Ernst WH, Pingoud V, Nordheim A (декабрь 1993 г.). «Активация тройного комплексного фактора Elk-1 MAP-киназами». EMBO J. 12 (13): 5097–104. Дои:10.1002 / j.1460-2075.1993.tb06204.x. ЧВК 413771. PMID 8262053.
- ^ Дент П., Хазер В., Хейстед Т.А., Винсент Л.А., Робертс TM, Стерджилл Т.В. (сентябрь 1992 г.). «Активация митоген-активированной киназы протеинкиназы с помощью v-Raf в клетках NIH 3T3 и in vitro». Наука. 257 (5075): 1404–7. Bibcode:1992Наука ... 257.1404D. Дои:10.1126 / science.1326789. PMID 1326789.
- ^ Хоу Л.Р., Ливерс С.Дж., Гомес Н., Накельни С., Коэн П., Маршалл С.Дж. (октябрь 1992 г.). «Активация пути киназы MAP протеинкиназой raf». Клетка. 71 (2): 335–42. Дои:10.1016 / 0092-8674 (92) 90361-Ф. PMID 1330321. S2CID 6640043.
- ^ Kyriakis JM, App H, Zhang XF, Banerjee P, Brautigan DL, Rapp UR, Avruch J (июль 1992 г.). «Raf-1 активирует киназу-киназу МАР». Природа. 358 (6385): 417–21. Bibcode:1992Натура.358..417K. Дои:10.1038 / 358417a0. PMID 1322500. S2CID 4335307.
- ^ Ву Дж., Харрисон Дж. К., Дент П., Линч К. Р., Вебер М. Дж., Стерджилл Т. В. (август 1993 г.). «Идентификация и характеристика новой митоген-активируемой протеинкиназы киназы млекопитающих, MKK2». Мол. Клетка. Биол. 13 (8): 4539–48. Дои:10.1128 / mcb.13.8.4539. ЧВК 360070. PMID 8393135.
- ^ а б Moodie SA, Willumsen BM, Weber MJ, Wolfman A (июнь 1993 г.). «Комплексы Ras.GTP с Raf-1 и митоген-активированной протеинкиназой киназой». Наука. 260 (5114): 1658–61. Bibcode:1993Научный ... 260.1658М. Дои:10.1126 / science.8503013. PMID 8503013.
- ^ Колч В., Хайдекер Дж., Кохс Дж., Хаммель Р., Вахиди Х., Мишак Х, Финкенцеллер Дж., Марме Д., Рапп У. Р. (июль 1993 г.). «Протеинкиназа С-альфа активирует RAF-1 путем прямого фосфорилирования». Природа. 364 (6434): 249–52. Bibcode:1993Натура.364..249K. Дои:10.1038 / 364249a0. PMID 8321321. S2CID 4368316.
- ^ Lange-Carter CA, Pleiman CM, Gardner AM, Blumer KJ, Johnson GL (апрель 1993 г.). «Расхождение в регуляторной сети MAP-киназы, определяемой киназой MEK и Raf». Наука. 260 (5106): 315–9. Bibcode:1993Научный ... 260..315Л. Дои:10.1126 / science.8385802. PMID 8385802. S2CID 40484420.
- ^ Трейсман Р., Марэ Р., Винн Дж. (Декабрь 1992 г.). «Пространственная гибкость тройных комплексов между SRF и его вспомогательными белками». EMBO J. 11 (12): 4631–40. Дои:10.1002 / j.1460-2075.1992.tb05565.x. ЧВК 557039. PMID 1425594.
- ^ Чай Й., Чипицына Г., Цуй Дж., Ляо Б., Лю С., Айсола К., Ездани М., Редди Е. С., Рао В. Н. (март 2001 г.). «Регулятор онкогена c-Fos Elk-1 взаимодействует с вариантами сплайсинга BRCA1 BRCA1a / 1b и усиливает опосредованное BRCA1a / 1b подавление роста в клетках рака груди». Онкоген. 20 (11): 1357–67. Дои:10.1038 / sj.onc.1204256. PMID 11313879.