Гексол - Википедия - Hexol
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Трис [тетраммин-μ-дигидроксокобальт (III)] ион кобальта (III) | |
| Идентификаторы | |
3D модель (JSmol ) | |
| |
| Характеристики | |
| Co4ЧАС42N12О18S3 | |
| Молярная масса | 830.31 г · моль−1 |
| Умеренно растворим в воде [1] | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
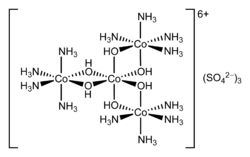
Гексол это название различных солей координационный комплекс это имеет историческое значение. Соли были первыми синтетическими неуглеродистыми хиральный соединения.[2] Сульфатная соль имеет формулу {[Co (NH3)4(ОЙ)2]3Co} (SO4)3.
Подготовка и оптическое разрешение
Соли гексола впервые были описаны Йоргенсен.[3] Соль получают нагреванием [Co (NH3)4(ЧАС2O)2]3+ с разбавленной основой, такой как аммиак с последующим осаждением сульфатной соли:
- 4 [Co (NH3)4(ЧАС2O)2]3+ → {[Co (NH3)4(ОЙ)2]3Co}6+ + 4 NH4+ + 2 часа+ + 2 часа2О
В зависимости от условий получают 9-гидрат, 6-гидрат и 4-гидрат. Эти соли существуют в виде темно-коричнево-фиолетовых или черных таблитчатых кристаллов. Соли плохо растворяются в воде. Катион может быть количественно осажден из желто-серого хромат и гексахлороплатинат соли. При обработке концентрированным соляная кислота, гексол превращается в СНГ-диакотетрамминкобальта (III) сульфат. В кипящем растворе серная кислота, гексол разлагается с выделением кислорода и азота.[1]
Оптическое разрешение
В исторической серии экспериментов Альфред Вернер полученный хиральное разрешение к фракционная кристаллизация из диастереомерный D- (+) - бромкамфорсульфонат соль. Этот ион имеет высокий удельное вращение 2640 °.[4][неудачная проверка ] Более эффективные методы включают использование соли бис (тартрато) диантимоната (III).[5]
«Второй гексол»
Вернер также описал второй ахиральный гексол (незначительный побочный продукт при производстве Соль фреми ), которую он неправильно определил как линейный тетрамер. Второй гексол является гексаноядерным (содержит шесть центров кобальта в каждом ионе), а не четырехъядерным.[6]
Рекомендации
- ^ а б Кауфман, Джордж Б .; Пиннелл, Роберт П. (1960). Трис [тетраммин-μ-дигидроксо-кобальт (III)] кобальт (III) сульфат 4-гидрат. Неорганические синтезы. 6. С. 176–179. Дои:10.1002 / 9780470132371.ch56. ISBN 9780470132371.
- ^ Мисслер Г. Л. и Тарр Д. А. Неорганическая химия, 3-е изд., Издательство Pearson / Prentice Hall, ISBN 0-13-035471-6.
- ^ Йоргенсен, С. М. (1898). "Zur Konstitution der Kobalt-, Chrom- und Rhodiumbasen". Zeitschrift für Anorganische Chemie. 16: 184–197. Дои:10.1002 / zaac.18980160116.
- ^ Вернер, А. (1907). "Über mehrkernige Metallammoniake" [Полиядерные металлы-амины]. Бер. Dtsch. Chem. Ges. (на немецком). 40 (2): 2103–2125. Дои:10.1002 / cber.190704002126.
- ^ Ясуи, Такадзи; Ама, Томохару; Кауфман, Джордж Б. (1992). Разрешение иона додекаамминегекса-μ-гидроксо-тетракобальта (III). Неорганические синтезы. 29. С. 169–174. Дои:10.1002 / 9780470132609.ch41. ISBN 9780470132609.
- ^ Джексон, В. Грегори; McKeon, Josephine A .; Зендер, Маргарета; Нойбергер, Маркус; Фаллаб, Сильвио (2004). «Повторное открытие второго гексола Альфреда Вернера». Химические коммуникации (20): 2322–2323. Дои:10.1039 / B408277J. PMID 15490001.
внешняя ссылка
- Hexol Molecule of the Month Сентябрь 1997 г. Интернет сайт
- Национальный реестр загрязнителей - информационный бюллетень по кобальту

