Домен гистидин-фосфотрансфера - Википедия - Histidine phosphotransfer domain
| Домен гистидин-фосфотрансфера | |||||||||
|---|---|---|---|---|---|---|---|---|---|
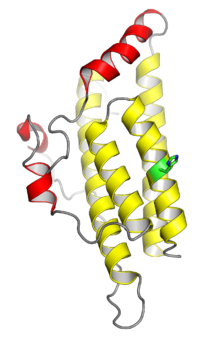 В Кристальная структура белка гистидинфосфотрансферазы дрожжей Ypd1. Четыре спирали, показанные желтым цветом, составляют сохраненную четырехспиральный пучок типичны для мономерных доменов HPt; Спирали, показанные красным, представляют собой вставки, специфичные для Ypd1. Сайт фосфорилирования гистидина показан зеленым цветом. Из PDB: 1C02.[1] | |||||||||
| Идентификаторы | |||||||||
| Символ | Hpt | ||||||||
| Pfam | PF01627 | ||||||||
| ИнтерПро | IPR008207 | ||||||||
| УМНАЯ | HPT | ||||||||
| PROSITE | PS50894 | ||||||||
| |||||||||
| Гистидинфосфотрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллическая структура Caulobacter crescentus белок гистидинфосфотрансферазы ChpT в димерной форме. Четыре спирали, показанные желтым, составляют консервативный четырехспиральный пучок, при этом сайты фосфорилирования гистидина выделены зеленым. Домены, показанные красным и коричневым, являются доменами псевдо-СА, которые напоминают АТФ-связывающие домены гистидинкиназ, но не связывают и не гидролизуют АТФ. Из PDB: 4FMT.[2] | |||||||||
| Идентификаторы | |||||||||
| Символ | HPTransfase | ||||||||
| Pfam | PF10090 | ||||||||
| ИнтерПро | IPR018762 | ||||||||
| |||||||||
Домены гистидинового фосфопереноса и гистидинфосфотрансферазы (оба часто сокращаются HPt) находятся белковые домены участвует в "фосфорелейной" форме двухкомпонентные системы регулирования. Эти белки обладают фосфорилируемый гистидин остаток и несут ответственность за передачу фосфорильная группа из аспартат остаток на промежуточном "приемнике" домен, как правило, часть гибрида гистидинкиназа, аспартату в финале регулятор реакции.
Функция
В ортодоксальной двухкомпонентной сигнализации гистидинкиназа белок аутофосфорилаты на гистидин остаток в ответ на внеклеточный сигнал, а фосфорильная группа впоследствии передается аспартат остаток на приемной области регулятор реакции. В фосфорилах «гибридная» гистидинкиназа содержит внутренний аспартатсодержащий приемный домен, на который переносится фосфорильная группа, после чего белок HPt, содержащий фосфорилируемый гистидин, получает фосфорильную группу и, наконец, передает ее регулятору ответа. Таким образом, система ретрансляции развивается в порядке His-Asp-His-Asp, причем второй His вносится Hpt.[3][4][5] В некоторых случаях фосфорелейная система сконструирована из четырех отдельных белков, а не из гибридной гистидинкиназы с внутренним доменом-приемником, а в других примерах как домены-приемники, так и домены HPt присутствуют в полипептидной цепи гистидинкиназы.[6]:198 Перепись двухкомпонентной архитектуры системных доменов показала, что домены HPt у бактерий чаще встречаются как домены более крупных белков, чем как отдельные белки.[4]
Регулирование
Повышенная сложность фосфорелейной системы по сравнению с ортодоксальной двухкомпонентной передачей сигналов предоставляет дополнительные возможности для регуляции и улучшает специфичность ответа.[6]:192[7] Хотя существует очень мало перекрестных помех между ортодоксальными двухкомпонентными системами, фосфореле позволяют более сложные пути передачи сигналов; примеры включают раздвоенный путь с несколькими выходами ниже по потоку, как в случае Caulobacter crescentus ChpT HPt участвует в клеточный цикл регулирование[2] или, альтернативно, пути, в которых более чем одна гистидинкиназа контролирует единственный регулятор ответа, такой как спороношение путь в Bacillus subtilis, что может привести к сложным временным изменениям.[8] В некоторых известных случаях существует дополнительная форма регулирования фосфогистидина. фосфатаза ферменты, которые действуют на HPt, такие как кишечная палочка белок SixA какие цели ArcB.[6]:206
Структура

Функция гистидин-фосфотрансфера может выполняться белками, по крайней мере, с двумя разными архитектурами, оба из которых состоят из четырехспиральный пучок но различаются по способу сборки. Наиболее структурно охарактеризованные белки HPt, такие как домен Hpt из кишечная палочка белок ArcB и Saccharomyces cerevisiae белок Ypd1, образуют пучок в виде мономеров.[5][2] В менее распространенном типе, таком как Bacillus subtilis спороношение фактор Spo0B или Caulobacter crescentus белок ChpT, жгут собирается в виде димер белка, со сходством со структурой гистидинкиназ.[7][2] Мономерные домены HPt имеют только один фосфорилируемый остаток гистидина и взаимодействуют с одним регулятором ответа, тогда как димеры имеют два сайта фосфорилирования и могут взаимодействовать с двумя регуляторами ответа одновременно. Мономерные домены HPt не имеют ферментативный самостоятельной деятельности и действуют исключительно как фосфатные челноки,[10][4] в то время как димерный Spo0B является каталитическим; скорость его фосфопереноса к регулятору ответа реципиента резко возрастает по сравнению с гистидинфосфатом.[11] Несмотря на наличие второго домена, немного похожего на АТФаза доменов, димерные белки HPt, как было показано, не связывают или гидролизуют АТФ и не имеют ключевых остатков, присутствующих в других АТФазах.[2]
Мономерная и димерная формы не обнаруживаются. сходство последовательностей и, скорее всего, не связаны эволюционно; они вместо этого являются примерами конвергентная эволюция.[2] Хотя димерные HPts, вероятно, происходят из вырожденных гистидинкиназ, возможно, что мономерные HPts имеют несколько различных источников, поскольку существует несколько эволюционных ограничений на структуру.[3]
Распределение
В бактерии, где двухкомпонентная передача сигналов чрезвычайно распространена, около 25% известных гистидинкиназ относятся к гибридному типу. Двухкомпонентные системы встречаются гораздо реже. археи и эукариоты, и встречаются у низших эукариот и растений, но не у многоклеточные животные. Среди известных примеров большинство, если не все эукариотические двухкомпонентные системы, представляют собой гибридные киназные фосфореллы.[3]
А биоинформатический перепись бактериального геномы обнаружили большие вариации в количестве (мономерных) доменов HPt, идентифицированных у разных бактериальных тип, причем некоторые геномы вообще не кодируют HPts. По сравнению с количеством гистидинкиназы и регуляторов ответа, присутствующих в геноме, у эукариот больше идентифицируемых доменов HPt, чем у бактерий.[12] В грибы геномный инвентарь белков HPt варьируется в зависимости от нитчатые грибы обычно обладают большим количеством белков HPt, чем дрожжи; только один закодирован в хорошо охарактеризованном Saccharomyces cerevisiae геном. Установки обычно имеют более одного HPt, но меньше HPt, чем регуляторов реакции.[4][10]
Рекомендации
- ^ Song HK, Lee JY, Lee MG, Moon J, Min K, Yang JK, Suh SW (ноябрь 1999 г.). «Понимание эукариотической многоступенчатой фосфорелейной передачи сигнала, выявленной кристаллической структурой Ypd1p из Saccharomyces cerevisiae». Журнал молекулярной биологии. 293 (4): 753–61. Дои:10.1006 / jmbi.1999.3215. PMID 10543964.
- ^ а б c d е ж Блэр Дж. А., Сюй К., Чайлдерс В. С., Мэтьюз II, Керн Дж. В., Эккарт М., Дикон А. М., Шапиро Л. (сентябрь 2013 г.). «Разветвленная сигнальная проводка необходимого бактериального белка фосфопереноса клеточного цикла». Структура. 21 (9): 1590–601. Дои:10.1016 / j.str.2013.06.024. ЧВК 3787845. PMID 23932593.
- ^ а б c Капра Э.Дж., Лауб М.Т. (2012). «Эволюция двухкомпонентных систем передачи сигналов». Ежегодный обзор микробиологии. 66: 325–47. Дои:10.1146 / annurev-micro-092611-150039. ЧВК 4097194. PMID 22746333.
- ^ а б c d Суруджон Д., Ратнер Д.И. (2016). «Использование вероятностного поиска мотивов для идентификации белков, содержащих гистидиновый фосфотрансферный домен». PLOS ONE. 11 (1): e0146577. Bibcode:2016PLoSO..1146577S. Дои:10.1371 / journal.pone.0146577. ЧВК 4709007. PMID 26751210.
- ^ а б Сюй К., Карлтон Д., Миллер М.Д., Эльслигер М.А., Кришна С.С., Абдубек П., Астахова Т., Бурра П., Чиу Х.Дж., Клейтон Т., Деллер М.К., Дуан Л., Элиас Й., Фейерхельм Дж., Грант Дж.С., Гжечник А., Гжечник С.К. , Han GW, Jaroszewski L, Jin KK, Klock HE, Knuth MW, Kozbial P, Kumar A, Marciano D, McMullan D, Morse AT, Nigoghossian E, Okach L, Oommachen S, Paulsen J, Reyes R, Rife CL, Sefcovic N, Trame C, Trout CV, ван ден Бедем H, Weekes D, Hodgson KO, Wooley J, Deacon AM, Godzik A, Lesley SA, Wilson IA (июль 2009 г.). «Кристаллическая структура гистидинового фосфотрансферного белка ShpA, важного регулятора биогенеза стебля у Caulobacter crescentus». Журнал молекулярной биологии. 390 (4): 686–98. Дои:10.1016 / j.jmb.2009.05.023. ЧВК 2726009. PMID 19450606.
- ^ а б c Витворт, Дэвид Э. (2012). «Двухкомпонентные регуляторные системы прокариот». In Filloux, Ален А. (ред.). Бактериальные регуляторные сети. Норфолк, Великобритания: Caister Academic Press. С. 191–222. ISBN 9781908230034.
- ^ а б Варугезе К.И. (апрель 2002 г.). «Молекулярное распознавание бактериальных белков фосфора». Текущее мнение в микробиологии. 5 (2): 142–8. Дои:10.1016 / с 1369-5274 (02) 00305-3. PMID 11934609.
- ^ Салазар М.Э., Лауб М.Т. (апрель 2015 г.). «Временная и эволюционная динамика двухкомпонентных сигнальных путей» (PDF). Текущее мнение в микробиологии. 24: 7–14. Дои:10.1016 / j.mib.2014.12.003. HDL:1721.1/105366. ЧВК 4380680. PMID 25589045.
- ^ Чжао X, Copeland DM, Soares AS, West AH (январь 2008 г.). «Кристаллическая структура комплекса между фосфорильным белком YPD1 и доменом регулятора ответа SLN1, связанного с фосфорильным аналогом». Журнал молекулярной биологии. 375 (4): 1141–51. Дои:10.1016 / j.jmb.2007.11.045. ЧВК 2254212. PMID 18076904.
- ^ а б Fassler JS, West AH (август 2013 г.). «Белки фосфопереноса гистидина в двухкомпонентных путях передачи сигнала грибов». Эукариотическая клетка. 12 (8): 1052–60. Дои:10.1128 / ec.00083-13. ЧВК 3754533. PMID 23771905.
- ^ Zapf J, Sen U, Hoch JA, Varughese KI (август 2000 г.). «Временное взаимодействие между двумя фосфорелейными белками, заключенными в кристаллическую решетку, раскрывает механизм молекулярного распознавания и фосфопереноса при передаче сигнала». Структура. 8 (8): 851–62. Дои:10.1016 / s0969-2126 (00) 00174-x. PMID 10997904.
- ^ Сальвадо Б., Вилаприньо Э, Соррибас А., Алвес Р. (2015). «Обзор доменов HK, HPt и RR и их организации в двухкомпонентных системах и фосфорелейных белках организмов с полностью секвенированными геномами». PeerJ. 3: e1183. Дои:10.7717 / peerj.1183. ЧВК 4558063. PMID 26339559.
