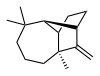
Лонгифолен - Longifolene
 | |
| Имена | |
|---|---|
| Название ИЮПАК (1р,2S,7S,9S) - 3,3,7-триметил-8-метилентрицикло- [5.4.0.02,9] ундекан | |
| Идентификаторы | |
| |
3D модель (JSmol ) | |
| 5731712 2044263 4663756 | |
| ЧЭБИ |
|
| ChemSpider | |
| ECHA InfoCard | 100.006.812 |
| Номер ЕС |
|
PubChem CID | |
| UNII |
|
| |
| |
| |
| Характеристики | |
| C15ЧАС24 | |
| Молярная масса | 204,36 г / моль |
| Плотность | 0,928 г / см3 |
| Точка кипения | 254 ° С (489 ° F, 527 К) (706 мм рт. Ст.) |
| Опасности | |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасность |
| H304, H317, H400, H410 | |
| P261, P272, P273, P280, P301 + 310, P302 + 352, P321, P331, P333 + 313, P363, P391, P405, P501 | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Лонгифолен это обычное (или тривиальное) химическое название встречающейся в природе маслянистой жидкости углеводород содержится в основном в высококипящей фракции некоторых сосновых смолы. Название происходит от названия сосна виды, из которых было выделено соединение,[1] Сосна длиннолистная (устаревшее название для Pinus roxburghii Сарг.)[2]
По химическому составу лонгифолен представляет собой трициклический сесквитерпен. Эта молекула хиральный, а энантиомер обычно встречается в соснах и других высших растениях. оптическое вращение + 42,73 °. Другой энантиомер (оптическое вращение -42,73 °) обнаруживается в небольших количествах в некоторых грибы и печеночники.
Лонгифолен используется в органическом синтезе для получения дилонгифолилборана,[3] хиральный гидроборирование агент.
Лонгифолен также является одним из двух наиболее распространенных аромат составляющие Lapsang Souchong чай, потому что чай коптят на костре из соснового леса.[4]
Всего синтезов
За счет компактной трициклической конструкции и отсутствия функциональные группы, Лонгифолен является привлекательной мишенью для исследовательских групп, изучающих новые синтетические методологии. Известные синтезы сделаны Кори,[5][6] Макмерри,[7] Джонсон,[8] Оппольцер,[9] и Шульц.[10] Фаллис опубликовал стереоселективный синтез (+) - лонгифолена с использованием внутримолекулярного Дильс-Альдер стратегия.[11]
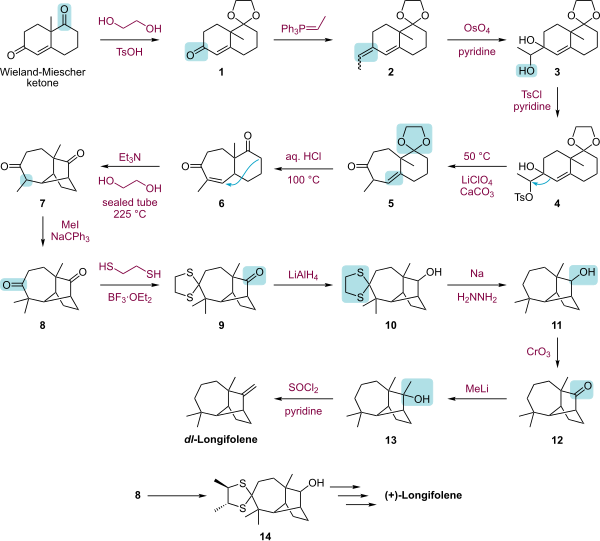 |
| Общий синтез лонгифолена по Corey.svg |
|---|
С тех пор биосинтез Джонсона был подтвержден как осуществимый с использованием современных квантово-механических вычислительных методов. Было показано, что последующий катионный каскадный механизм проходит через неклассический катион средний.[12]
Биосинтез
Биосинтез лонгифолена начинается с фарнезил дифосфат (1) (также называемый фарнезилпирофосфат ) посредством каскада катионной полициклизации. Потеря пирофосфатной группы и циклизация дистальным алкен дает промежуточные 3, который с помощью 1,3-гидридный сдвиг дает промежуточные 4. После двух дополнительных циклизаций промежуточный 6 производит лонгифолен 1,2-алкильная миграция.

Использовать
Производное борана дилонгифолилборан используется в органический синтез как хиральный гидроборирование агент.[13]
Рекомендации
- ^ Naffa, P .; Ориссон, Г. Bulletin de la Société chimique de France, 1954, 1410.
- ^ Симонсен, Дж. Л. J. Chem. Soc. 1920, 117, 570.
- ^ Jadhav, P.K .; Браун, Х. J. Org. Chem. 1981, 46, 2988.
- ^ Шан-Шань Яо ; Вэнь-Фей Го ; И Лу ; Юань-Сюнь Цзян, «Вкусовые характеристики Лапсанг Сушонг и Копченого Лапсан Сушуна, особого китайского черного чая с копчением сосны», Журнал сельскохозяйственной и пищевой химии, Vol. 53, № 22, (2005)[постоянная мертвая ссылка ]
- ^ Кори, Э. Дж .; Оно, Масаджи .; Mitra, Rajat B .; Ватакенчерри, Пол А. (февраль 1964 г.). «Полный синтез лонгифолена». Журнал Американского химического общества. 86 (3): 478–485. Дои:10.1021 / ja01057a039.
- ^ Кори, Э. Дж .; Оно, Масаджи; Vatakencherry, Paul A .; Митра, Раджат Б. (март 1961 г.). «ПОЛНЫЙ СИНТЕЗ d, l-ЛОНГИФОЛЕНА». Журнал Американского химического общества. 83 (5): 1251–1253. Дои:10.1021 / ja01466a056.
- ^ Макмерри, Джон Э .; Иссер, Стивен Дж. (Октябрь 1972 г.). «Полный синтез лонгифолена». Журнал Американского химического общества. 94 (20): 7132–7137. Дои:10.1021 / ja00775a044.
- ^ Фолькманн, Роберт А .; Эндрюс, Гленн С.; Джонсон, Уильям С. (август 1975 г.). «Новый синтез лонгифолена». Журнал Американского химического общества. 97 (16): 4777–4779. Дои:10.1021 / ja00849a062.
- ^ Оппольцер, Вольфганг; Годель, Тьерри (апрель 1978 г.). «Новый и эффективный тотальный синтез (. + -.) - лонгифолена». Журнал Американского химического общества. 100 (8): 2583–2584. Дои:10.1021 / ja00476a071.
- ^ Шульц, Артур Г .; Пуиг, Сальвадор (март 1985 г.). «Эквивалентность внутримолекулярного циклоприсоединения диен-карбен и энантиоселективное восстановление-алкилирование по Березе с помощью хирального вспомогательного подхода. Полный синтез (. + -.) - и (-) - лонгифолена». Журнал органической химии. 50 (6): 915–916. Дои:10.1021 / jo00206a049.
- ^ Бо, Лей; Фаллис, Алекс Г. (май 1990 г.). «Прямой полный синтез (+) - лонгифолена с помощью внутримолекулярной стратегии Дильса-Альдера». Журнал Американского химического общества. 112 (11): 4609–4610. Дои:10.1021 / ja00167a105.
- ^ Хо, Грегори J. Org. Chem. 2005, 70, 5139 -5143.
- ^ Дев, Сух (1981). «Аспекты химии лонгифолена. Пример еще одного аспекта химии природных продуктов». Отчеты о химических исследованиях. 14 (3): 82–88. Дои:10.1021 / ar00063a004.
