Редактирование нецелевого генома - Off-target genome editing
Редактирование нецелевого генома относится к неспецифическим и непреднамеренным генетическим модификациям, которые могут возникнуть в результате использования сконструированная нуклеаза такие технологии, как: сгруппированные, регулярно чередующиеся, короткие палиндромные повторы (CRISPR )-Cas9, эффекторные нуклеазы, подобные активаторам транскрипции (ТАЛЕН ), мегануклеазы, и нуклеазы цинковых пальцев (ZFN).[1] Эти инструменты используют разные механизмы для связывания заранее определенной последовательности ДНК («Цель»), которую они расщепляют (или «разрезают»), создавая двухцепочечный хромосомный разрыв (DSB), который вызывает клетки Механизмы восстановления ДНК (негомологичное соединение концов (NHEJ ) и гомологичной рекомбинации (HR )) и приводит к модификации сайта.[2] Если эти комплексы не связываются с мишенью, часто в результате гомологичных последовательностей и / или устойчивости к несоответствию, они будут расщеплять нецелевые DSB и вызывать неспецифические генетические модификации.[3][4][5] В частности, нецелевые эффекты состоят из непреднамеренных точечные мутации,[6] удаления,[7][8] вставки[5] инверсии,[5] и транслокации.[9][8]
Дизайнерские нуклеазные системы, такие как CRISPR-cas9, становятся все более популярными исследовательскими инструментами в результате их простоты, масштабируемости и доступности.[10][11] При этом часто встречаются нецелевые генетические модификации, которые могут изменить функцию интактных генов. Множественные исследования с использованием ранних агентов CRISPR-cas9 показали, что более 50% РНК-управляемых мутаций, вызванных эндонуклеазами, не происходили на мишени.[3][7] В Cas9 Направляющая РНК (gRNA) распознает последовательность ДНК-мишени размером 20 п.н., которую она связывает и расщепляет для «редактирования» последовательности ДНК. Однако связывание последовательности-мишени может допускать несовпадения до нескольких пар оснований, что означает, что часто существуют тысячи возможных сайтов связывания, которые представляют несколько экспериментальных проблем и проблем безопасности.[12][3] В сфере исследований нецелевые эффекты могут сбивать с толку переменные в биологических исследованиях, приводя к потенциально неверным и невоспроизводимым результатам.[2] В клинической сфере основные проблемы связаны с нарушением жизненно важных кодирующих областей, приводящим к генотоксическим эффектам, таким как рак.[13] Соответственно, улучшение специфичности[14][15] инструментов редактирования генома и обнаружения[9][16] нецелевых эффектов - быстро развивающиеся области исследований. Такие исследования включают разработку дизайнерских нуклеаз.[17] и открытие,[18] программы вычислительного прогнозирования и базы данных,[19][20] и высокопроизводительное секвенирование[9][16] для уменьшения и прогнозирования появления мутаций. Многие дизайнерские инструменты нуклеазы все еще находятся в зачаточном состоянии, и поскольку их молекулярные свойства и in vivo поведение станет более понятным, оно станет более точным и предсказуемым.
Механизмы
Система CRISPR-Cas9 работает как адаптивная иммунная система бактерий и архей.[21] Когда вирус заражает бактерии, эта система включает сегменты вирусной ДНК в бактериальный геном. При второй инвазии транскрипты этих последовательностей направляют нуклеазную активность на ее комплементарную последовательность во вторгающемся вирусе, чтобы уничтожить ее.[22][23][24]
Чтобы экстраполировать этот метод на эукариот с целью разработки метода редактирования генов, необходимы белок Cas9, РНК последовательности узнавания и трансактивирующая РНК. Слияние CRISPR РНК (crRNA) специфичности последовательности распознавания и трансактивирующей РНК (tracrRNA) обычно используется в экспериментах и называется единой направляющей РНК (sgRNA).[25] Он выполняет обе функции: первые 20 нуклеотидов sgRNA комплементарны целевой последовательности ДНК (функция cr), в то время как следующие нуклеотиды являются частью прилегающий мотив протоспейсера (PAM; функция tracr).[26][27][28]
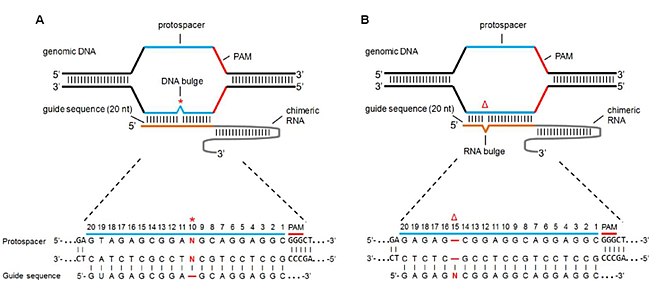
Связывание с нецелевой нуклеазой происходит из частичного, но достаточного совпадения с целевой последовательностью. Механизмы связывания вне мишени можно сгруппировать в две основные формы: устойчивость к базовому несоответствию и несоответствие выпуклости.[29]
Базовый допуск несоответствия
В то время как специфичность Cas9, как полагают, контролируется 20nt sgRNA и PAM, мутации вне мишени все еще распространены и могут возникать при несовпадении 3-5 пар оснований (из 20) между sgRNA и целевой последовательностью ДНК.[25][30] Кроме того, вторичные структуры sgRNA также могут влиять на расщепление целевых и нецелевых сайтов. Как упоминалось выше, sgRNA состоит из последовательности (~ 20nt), которая комплементарна последовательностям-мишеням, и за ней следует последовательность PAM, которая активирует эндонуклеаза Мероприятия. Хотя было показано, что 10-12 нуклеотидов, прилегающих к PAM (называемых «затравочной последовательностью»), было достаточно для специфичности Cas9, Wu и другие. показали, что в каталитически мертвом Cas9 для специфичности требуется только 1-5 пар оснований затравочной последовательности.[31] Позже это было доказано и другими исследованиями. Связывание с белком Cas9 дополнительно зависит от ряда механизмов:
- Последовательность семян определяет частоту появления семян плюс PAM в геноме и контролирует эффективную концентрацию комплекса Cas9 sgRNA.
- Семена, богатые урацилом, вероятно, будут иметь низкие уровни sgRNA и повышать специфичность, поскольку несколько урацилов в последовательности могут приводить к терминации sgRNA. транскрипция.[31][32]
- Несоответствия на 5’-конце crRNA более терпимы, поскольку важный сайт будет примыкать к матрице PAM. Одинарные и двойные несовпадения также допускаются в зависимости от того, как их разместить.
- В недавнем исследовании Рен и другие. наблюдали связь между эффективностью мутагенеза и содержанием GC sgRNA. Для хорошего редактирования требуется как минимум 4-6bp рядом с PAM.[33]
- При выборе gRNA гуанин предпочтительнее цитозина в качестве первого основания затравки рядом с PAM, цитозин в качестве первого в 5 ’и аденин в середине последовательности. Эта конструкция основана на стабильности, связанной с образованием G квадруплексы.[31][32][34]
- А ЧИП исполнила Ким и другие. демонстрация того, что добавление очищенного Cas9 вместе с sgRNA вызывало слабые нецелевые эффекты, что означает, что существует больше факторов, вызывающих эти эффекты.[35]
Важно отметить, что метилирование ДНК сайтов CpG снижает эффективность связывания Cas9 и других факторов в клетках. Таким образом, существует эпигенетическая связь, которую мы будем больше исследовать для будущего редактирования эпигенома.[36]
Вариации в последовательности PAM также могут влиять на активность sgRNA, в свою очередь влияя на саму sgRNA. В обычно используемых системах Cas9 мотивом PAM является 5 ’NGG 3’, где N представляет собой любой из четырех нуклеотидов ДНК. Требование последовательности PAM может вызвать проблемы со специфичностью, так как некоторые области будут иметь доступную последовательность-мишень для выполнения желаемой генетической модификации. В отчете говорится, что 99,96% сайтов, ранее считавшихся уникальными мишенями Cas9 в экзонах человека, могут иметь потенциальные эффекты, не соответствующие мишени, содержащие NAG или NGG PAM, и несоответствие одного основания в последовательности семян.[37]
Несоответствие выпуклости
Как нецелевые сайты с отсутствующими основаниями (или делециями), так и нецелевые сайты с дополнительными основаниями (или вставками), называемые выпуклостью РНК и выпуклостью ДНК соответственно, оказывают влияние на специфичность Cas9 и активность расщепления. Линь и другие. имитировали эти выпуклости, добавляя и удаляя основания из последовательности sgRNA, так что делеция оснований в sgRNA приводила к выпуклости РНК, а вставка основания приводила к выпуклости ДНК.[7] Изучая частоту мутаций через NHEJ, они пришли к следующим результатам:
- В случае чистых выпуклостей ДНК мутации хорошо переносились (т.е. активность расщепления Cas9 все еще преобладала). Области толерантности к выпуклости включали семь оснований от PAM и 5 ’и 3’ концов затравочной последовательности. Это привело к аналогичным или немного более высоким (в некоторых случаях) мутациям по сравнению с нулевыми выпуклостями.
- В случае чисто РНК-выступов более высокая активность Cas9 индуцировалась во многих положениях по сравнению с выпуклостями ДНК. Эта характеристика была приписана тому факту, что РНК более гибкая, чем ДНК, и, следовательно, имеет меньший штраф связывания с выпуклостью РНК, что приводит к более высокой толерантности и более высоким мутациям вне мишени.[38]
- Более высокое содержание GC в последовательности sgRNA привело к более высокой толерантности и, таким образом, к более высокой частоте мутаций вне мишени.
- Выпуклости размером 2bp-5bp поразительно более толерантны и вызывают мутации, чем одиночная выпуклость 2bp.
Улучшения


Способы повышения специфичности
Широко используемый Streptococcus pyogenes Нуклеаза Cas9 (SpCas9) эффективна, однако она вызывает нежелательные мутации вне мишени с высокой частотой. Было описано несколько инженерных и скрининговых методов, направленных на снижение нецелевых мутаций по всему геному, включая нуклеазные мутации, прилегающий мотив протоспейсера (PAM) модификация последовательности, направляющая РНК Усечение (гРНК) и открытие новых нуклеаз.[39] Например, в 2013 году Fu и другие. сообщили, что при усечении гРНК с <20 п.н. в длину до 17 или 18 п.н. целевая специфичность нуклеазы увеличивалась до 5000 раз, а случаи несоответствия выше 3 оснований редко, если вообще имели место.[14]
Cas9 никасы
Нуклеаза spCas9 также может быть мутирована различными способами для улучшения специфичности и контроля. Нуклеазные домены можно мутировать независимо друг от друга в так называемые Cas9 никасы. Эти нуклеазы имеют один активный и неактивный домен нуклеазы, в результате чего образуется комплекс, выполняющий одноцепочечное расщепление.[4] Никазы Cas9 можно использовать в тандеме (так называемые парные никазы), которые выполняют два одинарных «разреза» на чередующихся цепях.[4] Используя эту стратегию, обе никазы Cas9 должны совместно локализовать, связывать и расщеплять свою цель, что резко снижает вероятность попадания в цель. инделы.[4] Кроме того, DSB, расщепленные парными никазами, имеют длинные выступы вместо тупых концов, что обеспечивает улучшенный контроль над целевыми вставками.
Fok1-dCas9 и нуклеазы димеризации
Так как мономерный нуклеазы часто вызывают высокий уровень нецелевых эффектов, димеризация привлекательная стратегия. В димерной системе обе нуклеазы должны связываться со своими индивидуальными мишенями или «полу-сайтами», а затем взаимодействовать и димеризоваться, чтобы инициировать расщепление, что значительно снижает вероятность нецелевых эффектов. Метод, который включает надежность зависящей от димеризации FokI Были разработаны нуклеазные домены, используемые в ZFN и TALEN, с простотой CRISPR-cas9.[17] Нуклеаза FokI была первоначально обнаружена в Flavobacterium okeanokoites, и будет расщеплять ДНК только при активации димеризации. По сути, исследователи слили эту нуклеазу с комплексом CRISPR с неактивной нуклеазой Cas9 (Fok1-dCas9).[17] GRNA направляет комплекс CRISPR к целевому сайту, но «разрез» производится димеризованным Fok1. Подсчитано, что стратегия Fok1-dCas9 снижает обнаруживаемые эффекты вне цели в 10 000 раз, что делает ее эффективной для приложений, требующих высокоточного и специфического редактирования генома.[17][40]
Нуклеазная мутация
В дополнение к гРНК-мишени Cas9 требует связывания со специфической 2-6 нуклеотидной последовательностью PAM. В обычно используемых системах SpCas9 мотивом PAM является 5 ’NGG 3’, где N представляет собой любой из четырех нуклеотидов ДНК. Требование последовательности PAM может вызвать ограничения специфичности, так как некоторые области не будут иметь доступной последовательности-мишени для выполнения желаемой генетической модификации. Последовательность PAM может быть отредактирована для получения неканонических мотивов NAG и NGA, которые не только улучшают специфичность, но и снижают эффекты вне мишени.[41] А Мутант D1135E похоже, изменяет особенности PAM. Мутант D1135E снижает нецелевые эффекты и увеличивает специфичность SpCas9.[41] Дополнительный вариант, SpCas9-HF1, также приводит к благоприятным улучшениям специфичности Cas9.[42] Было идентифицировано несколько комбинаций замен, которые, как известно, образуют неспецифические контакты ДНК (N497A, R661A, Q695A и Q926A).[42] Четырехкратная замена этих остатков (позже названная SpCas9-HF1) имеет чрезвычайно низкие уровни нецелевых эффектов, обнаруженных с помощью GUIDE-seq эксперименты.[42] Такие варианты, как SpCas9-HF1 и D1135E, и другие ему подобные, можно комбинировать, тестировать и легко добавлять к существующим векторам SpCas9, чтобы снизить частоту мутаций вне мишени. Кроме того, многие из технических стратегий, перечисленных выше, могут быть объединены для создания все более надежных и надежных инструментов редактирования нуклеаз, управляемых РНК. Направленную эволюцию также можно использовать для снижения нуклеазной активности в отношении определенных последовательностей-мишеней, что приводит к таким вариантам, как SpartaCas (содержащие мутации D23A, T67L, Y128V и D1251G относительно SpCas9 дикого типа).[43]
CRISPRi и CRISPRa
CRISPR вмешательство (CRISPRi ) и активация CRISPR (CRISPRa ) также были разработаны.[44] Эти системы могут точно изменять транскрипцию генов на уровне ДНК, не вызывая необратимых генетических изменений.[44] Кроме того, непосредственно воздействуя на ДНК, они, как правило, более специфичны и предсказуемы по сравнению с РНКи.[45] Хотя CRISPRi / a не может заменить редактирование генома во всех экспериментах, в некоторых случаях они могут выступать в качестве эффективных альтернатив. CRISPRi и CRISPRa используют деактивированный фермент Cas9 (dCas9), который не может разрезать ДНК, но может доставлять активаторы и репрессоры транскрипции для модуляции желаемой экспрессии гена с высокой точностью.[44] В настоящее время нецелевые эффекты CRISPRi минимальны и демонстрируют пониженный ответ и чувствительность к несоответствиям по одному основанию.[44] Важно отметить, что когда неспецифические эффекты все же возникают, они обратимы, зависят от времени и менее разрушительны, чем редактирование ДНК, что делает их эффективными альтернативами, которые могут ограничить бремя нецелевых, когда это возможно. CRISPR-cas13b с помощью системы CRISPR-Cas типа IV (в отличие от обычно используемой системы типа II) можно нацеливать и редактировать определенные последовательности РНК.[46] Такая платформа для редактирования РНК имеет возможность специфически редактировать мРНК и, следовательно, трансляцию белков, не изменяя ДНК. Представляет собой многообещающую технологию, которая в случае успеха снизит бремя необратимых мутаций вне мишени.
Обнаружение
Несмотря на то, что можно принять осторожные меры, чтобы избежать мутаций, не соответствующих цели, и даже в случае успеха, необходимо провести подтверждающий скрининг, чтобы выявить непреднамеренные мутации. В настоящее время существует множество предвзятых и непредвзятых методов для такого экрана, и только два in vitro методы. Все они перечислены ниже:
Целевое, экзомное и полное секвенирование генома
В случае нормального целевого секвенирования предвзятый подход даст результаты только для предполагаемой области захвата, что затрудняет поиск, поскольку на экране не появляются неожиданные мутации. Хотя это просто и дешево, после добавления новых целевых сайтов это отнимает много времени и становится дорого. Секвенирование экзома использует захват экзома для захвата кодирующих белок областей генома. Однако он беспристрастен, он не приведет к появлению целевых мутаций в некодирующей области генома. В случае секвенирование всего генома, весь геном проверяется на наличие нецелевых мутаций. В настоящее время этот метод дорогостоящий и, как и секвенирование экзома, для целого генома также требуется эталонный геном, чтобы делать выводы.[47]
БЛАГОСЛОВЕНИЕ

БЛАГОСЛОВЕНИЕ - это самый простой способ обнаружения и количественной оценки мутаций вне мишени путем скрининга DSB в геноме. Этот метод основан на прямом на месте нарушает маркировку обогащения стрептавидином. Разработан в 2013 году,[48] BLESS выполняется путем лигирования концов DSB биотином, то есть биотинилирования. Затем следует разделение / сбор указанных лигированных концов с использованием стрептавидина. Связанная последовательность добавляется к биотинилированным последовательностям, и эта последняя смесь затем секвенируется для определения положения мутации вне мишени. Будучи непредвзятым по своей природе, BLESS дает информацию о месте мутации в геноме, а не о белках, участвующих или связанных с DSB. Однако BLESS может обнаруживать мутации только во время эксперимента, а не те, которые образовались ранее и были исправлены.[49]
LAM-HTGTS
Опосредованная линейной амплификацией - высокопроизводительное секвенирование транслокации по всему геному, или LAM-HTGTS, - это метод, разработанный для отслеживания событий транслокации, вызванных объединением между DSB.[50] Этот метод, разработанный для обнаружения нецелевых мутаций TALEN и CRISPR-Cas9, основан на репарации ДНК путем соединения концов в DSB. После добавления нуклеазы она продолжает производить мутации как на мишени, так и вне ее. Наряду с этим есть последовательность наживки, которая также раскалывается. Следовательно, если другой DSB встречается на хромосоме, отличной от хромосомы последовательности приманки, оба из них соединяются, что приводит к транслокации. Поскольку последовательность приманки известна, эта перемещенная последовательность амплифицируется с праймерами. В случае отсутствия транслокации существует сайт рестрикции, внутри которого происходит расщепление, чтобы предотвратить амплификацию только последовательности приманки. Затем амплифицированная ДНК секвенируется для изучения крупных геномных перестроек из-за мутаций вне мишени. Один из недостатков состоит в том, что он основан на одновременном наличии наживки и другого DSB.
GUIDE-Seq
Другой подход к поиску нецелевых мутаций из-за нуклеазной активности - это GUIDE-Seq метод. GUIDE-seq или объективная идентификация генома DSB, обеспечиваемая секвенированием, основана на включении двухцепочечных олигодезоксинуклеотидов (dsODN) в DSB через NHEJ. После его амплификации следует секвенирование. Поскольку для секвенирования dsODN будут использоваться два праймера, области, фланкирующие DSB вместе с DSB, будут амплифицированы. Таким образом, позволяя картировать мутацию вне мишени. Этот метод был применен для идентификации всех ранее известных нецелевых сайтов, а также новых с частотой всего 0,03%. Однако, как и BLESS, GUIDE-seq может обнаруживать только DSB, присутствующие во время исследования.
Digenome-Seq
Один из нынешних in vitro методы, Digenome-Seq использует свойство Cas9 расщеплять геном для получения объективного профиля всего генома. В этом методе Cas9 добавляется к гДНК, и последующие эффекты изучаются с помощью высокопроизводительного секвенирования. Поскольку фрагменты образуются за счет одной и той же нуклеазы, концы этих фрагментов могут быть сопоставлены выровненными. Два больших преимущества заключаются в том, что его можно использовать для изучения до 10 гРНК одновременно и определять цели с частотами всего 0,01%.[9] Однако главное преимущество заключается в том, что этот метод in vitro то есть DSB, введенные Cas9, не будут обрабатываться механизмом репарации ДНК (в отличие от BLESS и GUIDE-seq) и, таким образом, будут включать все возможные мутанты вне мишени. Однако это также может привести к большому количеству ложных срабатываний.[51]
CIRCLE-Seq
Последнее дополнение к in vitro методы обнаружения нецелевых мутаций - CIRCLE-seq. Лицензировано Beacon genomics (вместе с GUIDE-seq),[52] CIRCLE-seq направлен на устранение недостатков Digenome-seq, таких как необходимость большого размера выборки и глубины чтения (~ 400 миллионов считываний), а также высокий фон, который затрудняет идентификацию низкочастотных событий расщепления.[53] Он принимает рестрикционный фермент независимая стратегия для создания и выбора конверсии случайно разрезанной ДНК. При расщеплении целевая ДНК образует стеблевую петлю, к которой могут быть добавлены адаптеры для секвенирования. Хотя это оказалось возможным, другая возможность дала кратно большую разницу в обнаружении /. Во втором случае последовательность расщепляется с использованием Cas9, и когда она снова расщепляется на половине сайта, становится доступен круговой разрез (что и является причиной названия CIRCLE-seq). Почти все сайты, идентифицированные с помощью циркуляризации, содержат как линейно обнаруженные сайты, так и более новые, что позволяет предположить, что CIRCLE-seq не смещается между разрывами и также получает сильные разрывы с низкой частотой. Кроме того, это помогает секвенировать сайт разрыва с обеих сторон расщепления по сравнению с другими методами, которые имеют только одну сторону считывания.
Библиотеки целей со штрих-кодами
Нуклеазы, такие как Cas9, также могут быть нарушены. in vitro рандомизированными библиотеками целей.[54] Лигирование адаптера для количественной оценки расщепленных и нерасщепленных членов библиотеки позволяет беспристрастно измерить профиль специфичности нуклеазы. Измерение расщепления библиотек мишеней со штрих-кодом (BLT) с помощью SpCas9 показало, что профили специфичности были специфичными для направляющих и зависели от направляющей последовательности, а также от самой нуклеазы. Непредвзятые профили специфичности, основанные на каждом конкретном комплексе Cas9-gRNA, затем могут быть использованы для построения прогнозных моделей для конкретных рекомендаций. in vitro расщепление.
Значение
Генная терапия
Чтобы технологии редактирования генов сделали скачок к безопасному и широкому использованию в клинике, скорость модификации нецелевой должна быть устаревшей. Безопасность генной терапии имеет первостепенное значение, особенно во время клинических испытаний, когда нецелевые модификации могут блокировать дальнейшую разработку продукта-кандидата.[55] Возможно, наиболее известным примером современной генной терапии является терапия CAR-T, которая используется для лечения В-клеточная лимфома. Чтобы ограничить скорость отщепления от мишени, в терапии используется высокоспецифичный и точно настроенный TALEN, который, как было доказано, практически не имеет фонового взаимодействия с мишенью.[55] CAR-T иммунотерапия является ex vivo процедура, что означает, что иммунные клетки пациента (в данном случае Т-клетки ) извлекаются и редактируются с помощью дизайнерских нуклеаз.[55] Несмотря на то, что разработка системы TALEN является дорогостоящей и требует много времени, исследования и технические модификации резко ограничили скорость их нецелевого взаимодействия. Тем не менее, пациенты, получающие лечение, по-прежнему часто находятся под наблюдением в течение следующих 15 лет, чтобы можно было проанализировать и принять во внимание нецелевые эффекты и иммуногенные реакции по мере того, как новые генные методы лечения будут переданы на клинические испытания.[56]
CCR5 ZFN-модифицированные испытания аутологичных хелперных Т-клеток
Фаза I / II клиническое испытание набрали 12 пациентов с синдромом приобретенного иммунодефицита (СПИД) для проверки безопасности и эффективности введения ZFN-модифицированных аутологичных хелперных Т-клеток.[57] Посредством нацеленных делеций пользовательский ZFN отключает хемокиновый рецептор C-C 5 (CCR5 ) ген, кодирующий корецептор, который используется вирусом ВИЧ для проникновения в клетку.[58] В результате высокой степени гомологии последовательностей хемокиновых рецепторов C-C этот ZFN также расщепляет CCR2, что приводит к нецелевым делециям ∼15kb и геномным перестройкам.[58][59] Воздействие этих CCR2 модификации до сих пор не известны, и на сегодняшний день не сообщалось о побочных эффектах. Однако, CCR2 известно, что он играет важную роль в нервной и метаболической системах.[60][61]
Джин Драйвс
Спроектированные генные драйвы с использованием CRISPR-cas9 в настоящее время тестируются и были предложены в качестве стратегии для устранения инвазивных видов и переносчиков болезней. Путем генетической модификации организма для экспрессии эндогенной специфической эндонуклеазы, мишень (например, ген фертильности) может быть расщеплена на противоположной хромосоме.[62] DSB на мишени приводит к гомологичной репарации, которая эффективно делает организм гомозиготным по желаемой целевой последовательности. Эта стратегия, известная как стремление к самонадеянности, может подавлять популяцию, воздействуя на критический ген или вызывая рецессивную стерильность. Однако, если бы такая система была выпущена на рынок, система CRISPR-cas9 продолжала бы работать бесконечно. С каждым последующим поколением мутации, не соответствующие цели, будут становиться все более вероятными, и влияние этих мутаций на вид будет стохастическим. Мутации вне мишени могут отключать подавляющие качества генного драйва при сохранении экспрессии эндонуклеазы. В такой ситуации может возникнуть повышенный риск передачи генов между видами-мишенями и другими видами, что может привести к нежелательным результатам.[63]
Полемика
Все более широкое использование редактирования генома и его возможное преобразование в клиническое использование вызвало разногласия по поводу истинной нецелевой нагрузки на технологии.
Шефер и другие. 2017
30 мая 2017 г. в журнале Nature Methods была опубликована двухстраничная заочная статья, в которой сообщалось о необычно большом количестве нецелевых SNV и индели после секвенирования мышей, которые ранее были вовлечены в in vivo эксперимент по восстановлению генов.[64] Предыдущий эксперимент, проведенный той же группой, успешно восстановил зрение у слепых мышей линии (rd1) путем исправления мутации Y347X в Pde6b ген с использованием системы CRISPR-cas9.[65] После завершения эксперимента у двух генетически исправленных мышей секвенировали весь геном и сравнивали с геномами контрольной и известной линий мышей. Было обнаружено более 1600 SNV и 128 инделей, из которых 1397 SNV и 117 инделей были разделены между двумя отредактированными мышами, что позволяет предположить, что нецелевые эффекты не были случайными. Алгоритмы, пытающиеся предсказать местоположение этих нецелевых мутаций, потерпели неудачу для подавляющего большинства локусов. Для сравнения, исследование полного секвенирования экзома 2016 года обнаружило 19 SNV и 3 индела у 5 мышей, подвергшихся редактированию, в то время как Schaefer и другие. обнаружил 115 экзонных SNV и 9 инделей всего у 2 отредактированных мышей.[66] Многие эксперты не согласились с газетой и критиковали ее в журнальных статьях.[66] и социальные сети, предполагая, что в первоначальной статье использовались необычные методы лечения CRISPR, а размер выборки был слишком мал для значимости (n = 2). Nature Methods выпустила две редакционные заметки на бумаге.[67] Тем не менее, показатели, не соответствующие целевому показателю, постоянно встречаются чаще. in vivo по сравнению с экспериментами на клеточных культурах, и считается, что они особенно распространены у людей.[3][7]
использованная литература
- ^ Коста Дж. Р., Бейчек Б. Е., Макги Дж. Э., Фогель А. И., Бримакомб К. Р., Кеттелер Р. (2004). Ситтампалам Г.С., Куссенс Н.П., Бримакомб К., Гроссман А., Аркин М., Олд Д. и др. (ред.). Руководство по проведению анализа. Bethesda (MD): Eli Lilly & Company и Национальный центр развития трансляционных наук. PMID 29165977.
- ^ а б Конг Л., Чжан Ф (2015). «Геномная инженерия с использованием системы CRISPR-Cas9». Методы молекулярной биологии. 1239: 197–217. Дои:10.1007/978-1-4939-1862-1_10. HDL:1721.1/102943. ISBN 978-1-4939-1861-4. ЧВК 3969860. PMID 25408407.
- ^ а б c d Фу Й, Фоден Дж. А., Хайтер С., Мэдер М. Л., Рейон Д., Джунг Дж. К., Сандер Дж. Д. (сентябрь 2013 г.). «Высокочастотный мутагенез вне мишени, индуцированный нуклеазами CRISPR-Cas в клетках человека». Природа Биотехнологии. 31 (9): 822–6. Дои:10.1038 / nbt.2623. ЧВК 3773023. PMID 23792628.
- ^ а б c d Чо С.В., Ким С., Ким И, Квеон Дж., Ким Х.С., Бэ С., Ким Дж. С. (январь 2014 г.). «Анализ нецелевых эффектов CRISPR / Cas-производных РНК-управляемых эндонуклеаз и никаз». Геномные исследования. 24 (1): 132–41. Дои:10.1101 / гр.162339.113. ЧВК 3875854. PMID 24253446.
- ^ а б c Верес А., Гозис Б.С., Динг К., Коллинз Р., Рагавендран А., Брэнд Х, Эрдин С., Коуэн, Калифорния, Тальковски М.Э., Мусунуру К. (июль 2014 г.). «Низкая частота нецелевых мутаций в отдельных клонах стволовых клеток человека, нацеленных на CRISPR-Cas9 и TALEN, обнаруженных с помощью полногеномного секвенирования». Стволовая клетка клетки. 15 (1): 27–30. Дои:10.1016 / j.stem.2014.04.020. ЧВК 4082799. PMID 24996167.
- ^ Ван Х, Ян Х, Шивалила С.С., Давлати М.М., Ченг А.В., Чжан Ф., Джениш Р. (май 2013 г.). «Одношаговое создание мышей, несущих мутации в нескольких генах, с помощью CRISPR / Cas-опосредованной геномной инженерии». Ячейка. 153 (4): 910–8. Дои:10.1016 / j.cell.2013.04.025. ЧВК 3969854. PMID 23643243.
- ^ а б c d Лин И, Крадик Т.Дж., Браун М.Т., Дешмук Х., Ранджан П., Сарод Н, Уайл Б.М., Вертино П.М., Стюарт Ф.Дж., Бао Джи (июнь 2014 г.). «Системы CRISPR / Cas9 обладают нецелевой активностью со вставками или делециями между целевой ДНК и последовательностями направляющей РНК». Исследования нуклеиновых кислот. 42 (11): 7473–85. Дои:10.1093 / нар / gku402. ЧВК 4066799. PMID 24838573.
- ^ а б Cradick TJ, Fine EJ, Antico CJ, Bao G (ноябрь 2013 г.). «Системы CRISPR / Cas9, нацеленные на гены β-глобина и CCR5, обладают значительной нецелевой активностью». Исследования нуклеиновых кислот. 41 (20): 9584–92. Дои:10.1093 / nar / gkt714. ЧВК 3814385. PMID 23939622.
- ^ а б c d Ким Д., Пэ С, Пак Дж., Ким И, Ким С., Ю Х. Р., Хван Дж, Ким Джи, Ким Дж. С. (март 2015 г.). «Digenome-seq: полногеномное профилирование нецелевых эффектов CRISPR-Cas9 в клетках человека». Методы природы. 12 (3): 237–43, 1 стр. После 243. Дои:10.1038 / nmeth.3284. PMID 25664545.
- ^ Махфуз М.М., Пиатек А., Стюарт С.Н. (октябрь 2014 г.). «Геномная инженерия с помощью систем TALEN и CRISPR / Cas9: проблемы и перспективы». Журнал биотехнологии растений. 12 (8): 1006–14. Дои:10.1111 / pbi.12256. PMID 25250853.
- ^ Pennisi E (август 2013 г.). «Увлечение CRISPR». Наука. 341 (6148): 833–6. Дои:10.1126 / science.341.6148.833. PMID 23970676.
- ^ Сюй П.Д., Ландер Э.С., Чжан Ф. (июнь 2014 г.). «Разработка и применение CRISPR-Cas9 для геномной инженерии». Ячейка. 157 (6): 1262–78. Дои:10.1016 / j.cell.2014.05.010. ЧВК 4343198. PMID 24906146.
- ^ Ид А, Махфуз М.М. (октябрь 2016 г.). «Редактирование генома: путь CRISPR / Cas9 от стенда к клинике». Экспериментальная и молекулярная медицина. 48 (10): e265. Дои:10.1038 / emm.2016.111. ЧВК 5099421. PMID 27741224.
- ^ а б Фу Й, Сандер Дж., Рейон Д., Кашио В. М., Джунг Дж. К. (март 2014 г.). «Повышение специфичности нуклеазы CRISPR-Cas с помощью усеченных направляющих РНК». Природа Биотехнологии. 32 (3): 279–284. Дои:10.1038 / nbt.2808. ЧВК 3988262. PMID 24463574.
- ^ Standage-Beier K, Zhang Q, Wang X (ноябрь 2015 г.). «Целенаправленное крупномасштабное удаление бактериальных геномов с использованием CRISPR-никаз». Синтетическая биология ACS. 4 (11): 1217–25. Дои:10.1021 / acssynbio.5b00132. ЧВК 4655420. PMID 26451892.
- ^ а б Tsai SQ, Nguyen NT, Malagon-Lopez J, Topkar VV, Aryee MJ, Joung JK (июнь 2017 г.). «CIRCLE-seq: высокочувствительный in vitro скрининг на наличие нецелевых нуклеаз CRISPR-Cas9 по всему геному». Методы природы. 14 (6): 607–614. Дои:10.1038 / nmeth.4278. ЧВК 5924695. PMID 28459458.
- ^ а б c d Tsai SQ, Wyvekens N, Khayter C, Foden JA, Thapar V, Reyon D, Goodwin MJ, Aryee MJ, Joung JK (июнь 2014 г.). «Димерные CRISPR РНК-управляемые нуклеазы FokI для высокоспецифичного редактирования генома». Природа Биотехнологии. 32 (6): 569–76. Дои:10.1038 / nbt.2908. ЧВК 4090141. PMID 24770325.
- ^ Унгерер Дж., Пакраси HB (декабрь 2016 г.). «Cpf1 - универсальный инструмент для редактирования генома CRISPR для различных видов цианобактерий». Научные отчеты. 6: 39681. Дои:10.1038 / srep39681. ЧВК 5175191. PMID 28000776.
- ^ Сингх Р., Куску С., Куинлан А., Ци Й., Адли М. (октябрь 2015 г.). «Информация о связывании Cas9-хроматина позволяет более точно прогнозировать отклонение от цели CRISPR». Исследования нуклеиновых кислот. 43 (18): e118. Дои:10.1093 / нар / gkv575. ЧВК 4605288. PMID 26032770.
- ^ Tsai SQ, Zheng Z, Nguyen NT, Liebers M, Topkar VV, Thapar V, Wyvekens N, Khayter C, Iafrate AJ, Le LP, Aryee MJ, Joung JK (февраль 2015 г.). «GUIDE-seq позволяет профилировать геномное расщепление с помощью нуклеаз CRISPR-Cas». Природа Биотехнологии. 33 (2): 187–197. Дои:10.1038 / nbt.3117. ЧВК 4320685. PMID 25513782.
- ^ Хорват П., Баррангу Р. (январь 2010 г.). «CRISPR / Cas, иммунная система бактерий и архей». Наука. 327 (5962): 167–70. Дои:10.1126 / science.1179555. PMID 20056882.
- ^ Гасюнас Г., Баррангу Р., Хорват П., Сикснис В. (сентябрь 2012 г.). «Рибонуклеопротеиновый комплекс Cas9-crRNA опосредует специфическое расщепление ДНК для обеспечения адаптивного иммунитета у бактерий». Труды Национальной академии наук Соединенных Штатов Америки. 109 (39): E2579-86. Дои:10.1073 / pnas.1208507109. ЧВК 3465414. PMID 22949671.
- ^ Джинек М., Чилински К., Фонфара И., Хауэр М., Дудна Дж. А., Шарпантье Е. (август 2012 г.). «Программируемая двойная РНК-управляемая ДНК-эндонуклеаза в адаптивном бактериальном иммунитете». Наука. 337 (6096): 816–21. Дои:10.1126 / наука.1225829. ЧВК 6286148. PMID 22745249.
- ^ Чжан XH, Ти LY, Ван XG, Хуанг QS, Ян Ш. (ноябрь 2015 г.). «Нецелевые эффекты в CRISPR / Cas9-опосредованной геномной инженерии». Молекулярная терапия. Нуклеиновых кислот. 4: e264. Дои:10.1038 / mtna.2015.37. ЧВК 4877446. PMID 26575098.
- ^ а б Конг Л., Ран Ф.А., Кокс Д., Лин С., Барретто Р., Хабиб Н., Сюй П.Д., Ву Х, Цзян В., Марраффини Л.А., Чжан Ф. (февраль 2013 г.). «Мультиплексная геномная инженерия с использованием систем CRISPR / Cas». Наука. 339 (6121): 819–23. Дои:10.1126 / наука.1231143. ЧВК 3795411. PMID 23287718.
- ^ Mojica FJ, Díez-Villaseñor C, García-Martínez J, Almendros C (март 2009 г.). «Последовательности коротких мотивов определяют мишени системы защиты CRISPR прокариот». Микробиология. 155 (Pt 3): 733–40. Дои:10.1099 / микрофон.0.023960-0. PMID 19246744.
- ^ Штернберг Ш., Реддинг С., Джинек М., Грин Э. К., Дудна Дж. А. (март 2014 г.). "Исследование ДНК с помощью CRISPR-управляемой РНК эндонуклеазы Cas9". Природа. 507 (7490): 62–7. Дои:10.1038 / природа13011. ЧВК 4106473. PMID 24476820.
- ^ Андерс С., Невоехнер О., Дюрст А., Янек М. (сентябрь 2014 г.). «Структурные основы распознавания PAM-зависимой целевой ДНК эндонуклеазой Cas9». Природа. 513 (7519): 569–73. Дои:10.1038 / природа13579. ЧВК 4176945. PMID 25079318.
- ^ Лин Y, Cradick TJ, Brown MT, Deshmukh H, Ranjan P, Sarode N, Wile BM, Vertino PM, Stewart FJ, Bao G (июнь 2014 г.). «Системы CRISPR / Cas9 обладают нецелевой активностью со вставками или делециями между целевой ДНК и последовательностями направляющей РНК». Исследования нуклеиновых кислот. 42 (11): 7473–85. Дои:10.1093 / нар / gku402. ЧВК 4066799. PMID 24838573.
- ^ Сюй П.Д., Скотт Д.А., Вайнштейн Дж.А., Ран Ф.А., Конерманн С., Агарвала В., Ли И, Файн Э.Дж., Ву Х, Шалем О, Крадик Т.Дж., Марраффини Л.А., Бао Джи, Чжан Ф. (сентябрь 2013 г.). «ДНК-нацеленная специфичность РНК-управляемых нуклеаз Cas9». Природа Биотехнологии. 31 (9): 827–32. Дои:10.1038 / nbt.2647. ЧВК 3969858. PMID 23873081.
- ^ а б c Ву Х, Скотт Д.А., Криз А.Дж., Чиу А.С., Сюй П.Д., Дадон Д.Б., Ченг А.В., Тревино А.Э., Конерманн С., Чен С., Джениш Р., Чжан Ф., Шарп, Пенсильвания (июль 2014 г.). «Полногеномное связывание эндонуклеазы CRISPR Cas9 в клетках млекопитающих». Природа Биотехнологии. 32 (7): 670–6. Дои:10.1038 / nbt.2889. ЧВК 4145672. PMID 24752079.
- ^ а б Ван Т., Вэй Дж.Дж., Сабатини Д.М., Ландер Э.С. (январь 2014 г.). «Генетический скрининг в клетках человека с использованием системы CRISPR-Cas9». Наука. 343 (6166): 80–4. Дои:10.1126 / science.1246981. ЧВК 3972032. PMID 24336569.
- ^ Ren X, Yang Z, Xu J, Sun J, Mao D, Hu Y, Yang SJ, Qiao HH, Wang X, Hu Q, Deng P, Liu LP, Ji JY, Li JB, Ni JQ (ноябрь 2014 г.). «Повышенная специфичность и эффективность системы CRISPR / Cas9 с оптимизированными параметрами sgRNA у Drosophila». Отчеты по ячейкам. 9 (3): 1151–62. Дои:10.1016 / j.celrep.2014.09.044. ЧВК 4250831. PMID 25437567.
- ^ Морено-Матеос М.А., Вейнар К.Э., Бодуан Дж. Д., Фернандес Дж. П., Мис Е.К., Хоха М.К., Хиралдес А.Дж. (октябрь 2015 г.). «CRISPRscan: разработка высокоэффективных sgRNA для нацеливания CRISPR-Cas9 in vivo». Методы природы. 12 (10): 982–8. Дои:10.1038 / nmeth.3543. ЧВК 4589495. PMID 26322839.
- ^ Ким С., Ким Д., Чо С. В., Ким Дж., Ким Дж. С. (июнь 2014 г.). «Высокоэффективное редактирование генома под управлением РНК в клетках человека посредством доставки очищенных рибонуклеопротеинов Cas9». Геномные исследования. 24 (6): 1012–9. Дои:10.1101 / гр.171322.113. ЧВК 4032847. PMID 24696461.
- ^ Куску С., Арслан С., Сингх Р., Торп Дж., Адли М. (июль 2014 г.). «Полногеномный анализ выявляет характеристики нецелевых сайтов, связанных эндонуклеазой Cas9». Природа Биотехнологии. 32 (7): 677–83. Дои:10.1038 / nbt.2916. PMID 24837660.
- ^ Мали П., Аач Дж., Странджес ПБ, Эсвелт К.М., Моосбернер М., Косури С., Ян Л., Черч Дж. М. (сентябрь 2013 г.). «Активаторы транскрипции CAS9 для скрининга целевой специфичности и парные никазы для совместной геномной инженерии». Природа Биотехнологии. 31 (9): 833–8. Дои:10.1038 / nbt.2675. ЧВК 3818127. PMID 23907171.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2007). Молекулярная биология клетки. Нью-Йорк: Наука Гарланд.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Kadam US, Shelake RM, Chavhan RL, Suprasanna P (2018). «Обеспокоенность относительно« нецелевой »активности эндонуклеаз, редактирующих геном». муравей Физиология и биохимия. 131: 22–30. Дои:10.1016 / j.plaphy.2018.03.027. PMID 29653762.
- ^ Wyvekens N, Topkar VV, Khayter C, Joung JK, Tsai SQ (июль 2015 г.). «Димерные CRISPR-управляемые РНК-нуклеазы FokI-dCas9, управляемые усеченными гРНК для высокоспецифичного редактирования генома». Генная терапия человека. 26 (7): 425–31. Дои:10.1089 / hum.2015.084. ЧВК 4509490. PMID 26068112.
- ^ а б Kleinstiver BP, Prew MS, Tsai SQ, Topkar VV, Nguyen NT, Zheng Z, Gonzales AP, Li Z, Peterson RT, Yeh JR, Aryee MJ, Joung JK (июль 2015 г.). «Сконструированные нуклеазы CRISPR-Cas9 с измененной специфичностью PAM». Природа. 523 (7561): 481–5. Дои:10.1038 / природа14592. ЧВК 4540238. PMID 26098369.
- ^ а б c Kleinstiver BP, Pattanayak V, Prew MS, Tsai SQ, Nguyen NT, Zheng Z, Joung JK (январь 2016 г.). «Высококачественные нуклеазы CRISPR-Cas9 без обнаруживаемых нецелевых эффектов по всему геному». Природа. 529 (7587): 490–5. Дои:10.1038 / природа16526. ЧВК 4851738. PMID 26735016.
- ^ Черчионе, Дерек; Лавлак, Кэтрин; Тиллотсон, Эрик Л .; Харбински, Фред; ДаСильва, Джен; Келли, Чейз П .; Кестон-Смит, Элиза; Fernandez, Cecilia A .; Myer, Vic E .; Джаярам, Харихаран; Стейнберг, Барретт Э. (16 апреля 2020 г.). «Библиотеки SMOOT и индуцированная фагом направленная эволюция Cas9 для создания сниженной активности вне мишени». PLOS ONE. 15 (4): e0231716. Дои:10.1371 / journal.pone.0231716.
- ^ а б c d Гилберт Л.А., Хорлбек М.А., Адамсон Б., Вильялта Дж. Э., Чен Ю., Уайтхед Е. Х., Гимарайнш С., Паннинг Б., Плоег Г. Л., Бассик М. С., Ци Л. С., Кампманн М., Вайсман Дж. С. (октябрь 2014 г.). "Контроль репрессии и активации генов, опосредованный CRISPR в масштабе генома". Ячейка. 159 (3): 647–61. Дои:10.1016 / j.cell.2014.09.029. ЧВК 4253859. PMID 25307932.
- ^ Ларсон М.Х., Гилберт Л.А., Ван Х, Лим В.А., Вайсман Дж.С., Ци Л.С. (ноябрь 2013 г.). «Интерференция CRISPR (CRISPRi) для последовательного контроля экспрессии генов». Протоколы природы. 8 (11): 2180–96. Дои:10.1038 / nprot.2013.132. ЧВК 3922765. PMID 24136345.
- ^ Cox DB, Gootenberg JS, Abudayyeh OO, Franklin B, Kellner MJ, Joung J, Zhang F (ноябрь 2017 г.). «Редактирование РНК с помощью CRISPR-Cas13». Наука. 358 (6366): 1019–1027. Дои:10.1126 / science.aaq0180. ЧВК 5793859. PMID 29070703.
- ^ Zischewski J, Fischer R, Bortesi L (2017). «Обнаружение мутаций на мишени и вне мишени, генерируемых CRISPR / Cas9 и другими нуклеазами, специфичными для последовательности». Достижения биотехнологии. 35 (1): 95–104. Дои:10.1016 / j.biotechadv.2016.12.003. PMID 28011075.
- ^ Крозетто Н., Митра А., Сильва М.Дж., Биенко М., Дойер Н., Ван К., Карака Е., Кьярле Р., Скшипчак М., Гинальски К., Пасеро П., Ровицка М., Дикич I. (апрель 2013 г.). «Картирование двухцепочечных разрывов ДНК с разрешением нуклеотидов с помощью секвенирования следующего поколения». Методы природы. 10 (4): 361–5. Дои:10.1038 / nmeth.2408. ЧВК 3651036. PMID 23503052.
- ^ Tsai SQ, Joung JK (май 2016 г.). «Определение и улучшение общегеномной специфичности нуклеаз CRISPR-Cas9». Природа Обзоры Генетика. 17 (5): 300–12. Дои:10.1038 / nrg.2016.28. ЧВК 7225572. PMID 27087594.
- ^ Маллин Х., Хестерикова М., Рейтер Р., Уорд ТР (май 2016 г.). «Дизайн библиотеки и протокол скрининга искусственных металлоферментов на основе биотин-стрептавидиновой технологии». Протоколы природы. 11 (5): 835–52. Дои:10.1038 / nprot.2016.019. PMID 27031496.
- ^ Fu BX, St Onge RP, Fire AZ, Smith JD (июнь 2016 г.). «Отличительные образцы толерантности к несоответствию Cas9 in vitro и in vivo». Исследования нуклеиновых кислот. 44 (11): 5365–77. Дои:10.1093 / nar / gkw417. ЧВК 4914125. PMID 27198218.
- ^ "CIRCLE-Seq Пресс-релиз". beacongenomics.com. Получено 2018-03-01.
- ^ Tsai SQ, Nguyen NT, Malagon-Lopez J, Topkar VV, Aryee MJ, Joung JK (июнь 2017 г.). «CIRCLE-seq: высокочувствительный in vitro скрининг на наличие нецелевых нуклеаз CRISPR-Cas9 по всему геному». Методы природы. 14 (6): 607–614. Дои:10.1038 / nmeth.4278. ЧВК 5924695. PMID 28459458.
- ^ Хьюстон, Николас С .; Тыко, Джош; Тиллотсон, Эрик Л .; Уилсон, Кристофер Дж .; Myer, Vic E .; Джаярам, Харихаран; Стейнберг, Барретт Э. (1 июня 2019 г.). «Идентификация внутренних детерминант специфичности Cas9». Журнал CRISPR. 2 (3): 172–185. Дои:10.1089 / crispr.2019.0009. ISSN 2573-1599.
- ^ а б c Gautron AS, Juillerat A, Guyot V, Filhol JM, Dessez E, Duclert A, Duchateau P, Poirot L (декабрь 2017 г.). «Точная и предсказуемая настройка таргетинга редактирования генов TALEN для улучшенной адоптивной иммунотерапии Т-клеток». Молекулярная терапия. Нуклеиновых кислот. 9: 312–321. Дои:10.1016 / j.omtn.2017.10.005. ЧВК 5684446. PMID 29246309.
- ^ Левин Б.Л., Мискин Дж., Воннакотт К., Кейр С. (март 2017 г.). «Глобальное производство CAR T-клеточной терапии». Молекулярная терапия. Методы и клинические разработки. 4: 92–101. Дои:10.1016 / j.omtm.2016.12.006. ЧВК 5363291. PMID 28344995.
- ^ Тебас П., Штейн Д., Тан В.В., Франк I, Ван С.К., Ли Джи, Спратт С.К., Суроски Р.Т., Гедлин М.А., Никол Джи, Холмс М.С., Грегори П.Д., Андо Д.Г., Калос М., Коллман Р.Г., Биндер-Шолль Дж., Плеса Г., Хванг В.Т., Левин Б.Л., Швейцария, июнь (март 2014 г.). «Редактирование генов CCR5 в аутологичных Т-лимфоцитах CD4 людей, инфицированных ВИЧ». Медицинский журнал Новой Англии. 370 (10): 901–10. Дои:10.1056 / NEJMoa1300662. ЧВК 4084652. PMID 24597865.
- ^ а б Ли Х. Дж., Ким Э, Ким Дж. С. (январь 2010 г.). «Направленные делеции хромосом в клетках человека с использованием нуклеаз цинкового пальца». Геномные исследования. 20 (1): 81–9. Дои:10.1101 / гр.099747.109. ЧВК 2798833. PMID 19952142.
- ^ Ли Х. Дж., Квеон Дж., Ким И, Ким С., Ким Дж. С. (март 2012 г.). «Целевые хромосомные дупликации и инверсии в геноме человека с использованием нуклеаз цинкового пальца». Геномные исследования. 22 (3): 539–48. Дои:10.1101 / гр.129635.111. ЧВК 3290789. PMID 22183967.
- ^ Скучно Л., Гослинг Дж, Клири М., Чаро И.Ф. (август 1998 г.). «Уменьшение образования поражений у мышей CCR2 - / - показывает роль хемокинов в инициации атеросклероза». Природа. 394 (6696): 894–7. Дои:10.1038/29788. PMID 9732872.
- ^ Эль-Хури Дж, Тофт М., Хикман С.Е., Средство ТЗ, Терада К, Геула С., Блеск AD (апрель 2007 г.). «Дефицит Ccr2 ухудшает накопление микроглии и ускоряет прогрессирование болезни, подобной болезни Альцгеймера». Природа Медицина. 13 (4): 432–8. Дои:10,1038 / нм1555. PMID 17351623.
- ^ Чампер Дж., Бухман А., Акбари О.С. (март 2016 г.). «Жульничество эволюции: инженерные гены для управления судьбой диких популяций». Природа Обзоры Генетика. 17 (3): 146–59. Дои:10.1038 / nrg.2015.34. PMID 26875679.
- ^ Уэббер Б.Л., Рагху С., Эдвардс О.Р. (август 2015 г.). «Мнение: Является ли ген, основанный на CRISPR, серебряной пулей биоконтроля или глобальной угрозой сохранения?». Труды Национальной академии наук Соединенных Штатов Америки. 112 (34): 10565–7. Дои:10.1073 / pnas.1514258112. ЧВК 4553820. PMID 26272924.
- ^ Шефер К.А., Ву WH, Колган Д.Ф., Цанг С.Х., Бассук А.Г., Махаджан В.Б. (май 2017 г.). «Неожиданные мутации после редактирования CRISPR-Cas9 in vivo». Методы природы. 14 (6): 547–548. Дои:10.1038 / nmeth.4293. ЧВК 5796662. PMID 28557981.
- ^ Wu WH, Tsai YT, Justus S, Lee TT, Zhang L, Lin CS, Bassuk AG, Mahajan VB, Tsang SH (август 2016 г.). «Ремонт CRISPR выявляет причинную мутацию в доклинической модели пигментного ретинита». Молекулярная терапия. 24 (8): 1388–94. Дои:10.1038 / мт.2016.107. ЧВК 5023380. PMID 27203441.
- ^ а б Уилсон С.Дж., Феннелл Т., Ботмер А., Мейдер М.Л., Рейон Д., Котта-Рамузино С., Фернандес КА, Марко Е., Баррера Л.А. (2017-07-10). «Экспериментальный план и интерпретация данных в статье« Неожиданные мутации после редактирования CRISPR Cas9 in vivo »Шефера и др. Недостаточны для подтверждения выводов, сделанных авторами». bioRxiv: 153338. Дои:10.1101/153338.
- ^ Накадзима К., Казуно А.А., Келсо Дж., Наканиши М., Такуми Т., Като Т. (октябрь 2016 г.). «Секвенирование экзома у мышей knockin, созданное с использованием системы CRISPR / Cas». Научные отчеты. 6: 34703. Дои:10.1038 / srep34703. ЧВК 5048150. PMID 27698470.
