ПАК-1 - PAC-1
Эта статья относится к противоопухолевой молекуле, а не к одноименному антителу, специфичному для активации интегрина a2iib3.
 | |
| Идентификаторы | |
|---|---|
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| ChemSpider | |
| UNII | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.164.322 |
| Химические и физические данные | |
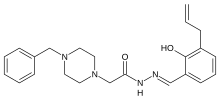
| Формула | C23ЧАС28N4О2 |
| Молярная масса | 392.503 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| (проверять) | |
ПАК-1 (первый прокаспас активирующее соединение) представляет собой синтезированное химическое соединение, которое избирательно индуцирует апоптоз, в раковый клетки. Было предоставлено орфанный препарат статус FDA в 2016 году.
История
PAC-1 был обнаружен в лаборатории профессора Поля Хергенротера в Университет штата Иллинойс в Урбане-Шампейн во время процесса, который экранированный многие химические вещества для противоопухолевого потенциала. Эта молекула, когда доставляется к раковым клеткам, сигнализирует клеткам о самоуничтожении, активируя белок «палач», прокаспаза-3. Затем активированный белок-палач начинает каскад событий, разрушающих механизмы клетки. В 2011 году была основана компания Vanquish Oncology Inc., чтобы продвинуть PAC-1 к клиническим испытаниям на людях. В 2013 году Vanquish объявил о многомиллионных инвестициях в компанию. В 2015 году началась фаза I клинических испытаний PAC-1 для включения онкологических больных, а в 2016 году было объявлено, что PAC-1 был присвоен статус орфанного препарата для лечения глиобластома Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, а в конце 2017 года началось исследование фазы 1b PAC-1 плюс темозоломид для лечения пациентов с рецидивирующей глиобластомой или анапластической астроцитомой.
Механизм действия
В клетках белок-палач, каспаза-3, хранится в неактивной форме, прокаспазе-3. Таким образом, клетка может быстро подвергнуться апоптозу, активируя белок, который уже есть. Эта неактивная форма называется зимоген. Известно, что прокаспаза-3 ингибируется низким уровнем цинка. PAC-1 активирует прокаспазу-3 за счет хелатирования цинка, тем самым снимая опосредованное цинком ингибирование. Это позволяет прокаспазе-3 быть активным ферментом, а затем она может расщеплять другую молекулу прокаспазы-3 до активной каспазы-3. Каспаза-3 может дополнительно активировать другие молекулы прокаспазы-3 в клетке, вызывая экспоненциальное увеличение концентрации каспазы-3. PAC-1 облегчает этот процесс и заставляет клетку быстро подвергаться апоптозу.[1]
Этот способ действия прямой активации прокаспазы-3 для PAC-1 был подтвержден другими лабораториями: в 2013 году лабораторией Megeney в ходе исследований роли каспазы-3 в кардиомиоцитах,[2] в 2014 году лабораторией Wu в обширном исследовании противоопухолевой активности и механизма действия PAC-1 и производных,[3] и в 2015 году лабораторией Ганди в исследовании потенциала PAC-1 и производного B-PAC-1 для лечения хронический лимфолейкоз (CLL).[4]
Исследования с нокаут-клетками показали важность прокаспазы-7 в качестве вторичной или альтернативной мишени для PAC-1, особенно в отсутствие прокаспазы-3. Например, эксперименты с использованием эмбриональных фибробластов мыши (MEF) демонстрируют, что двойной нокаут генов CASP3 и CASP7 приводит к клеткам, которые нечувствительны к проапоптотическим эффектам соединений класса PAC-1 и снова сбивают CASP3 или CASP7. сенсибилизирует эти клетки к соединениям типа PAC-1.[5] Недавние эксперименты с использованием линий раковых клеток с CRISPR-делецией CASP3 также согласуются с этим результатом.[6] Активация прокаспазы-7 с помощью PAC-1 согласуется с биохимическими данными, хотя относительная важность прокаспазы-7 в клетках с функциональной прокаспазой-3 неясна.
Возможная проблема селективности возникает из-за того, что прокаспаза-3 присутствует в большинстве клеток организма. Однако было показано, что при многих формах рака, в том числе некоторых нейробластомы, лимфомы, лейкемии, меланомы, и рак печени, прокаспаза-3 присутствует в более высоких концентрациях.[1] Например, клетки рака легких могут иметь более чем в 1000 раз больше прокаспазы-3, чем нормальные клетки.[1] Следовательно, контролируя дозировку, можно добиться селективности между нормальными и раковыми клетками.
В дополнение к своей автономной активности, PAC-1 также заметно синергизирует с множеством одобренных противораковых препаратов, например, с BRAF и МЕК ингибиторы в мышиных моделях меланомы,[7] и с обычными химиотерапевтическими агентами, такими как доксорубицин у домашних собак со спонтанным раком, включая лимфому и метастатический остеосаркома,[8] и с темозоломид у домашних собак с естественным глиома.[9]
Vanquish Oncology сообщили о своем намерении начать фазу I клинических испытаний на людях у онкологических больных, которые начнутся в начале 2015 года, и действительно, первая фаза исследования PAC-1 открылась для регистрации в феврале 2015 года (NCT02355535). Это исследование проводится в Онкологическом центре Университета Иллинойса в Чикаго, в Онкологический центр Сидни Киммела в Джонс Хопкинс, и в региональной больнице в Сент-Поле, Миннесота. В конце 2017 г. в тех же трех центрах началось испытание фазы 1b препарата PAC-1 плюс темозоломид (NCT03332355); Пациенты с глиомой высокой степени злокачественности (мультиформная глиобластома (GBM) или анапластическая астроцитома) после прогрессирования после стандартной терапии первой линии подходят для этого исследования.
Испытания на животных
PAC-1 примечателен уникальным путем, который он прошел в клинику, поскольку это, возможно, единственный препарат от рака, который вначале подвергся тщательной оценке на домашних собаках со спонтанным раком в качестве прелюдии к клиническим испытаниям на людях. В 2010 году исследование показало, что PAC-1 безопасен для собак, а второе исследование, опубликованное позже в том же году, показало, что производное PAC-1 (названное S-PAC-1) хорошо переносится в небольшом клиническом испытании фазы I. собаки с лимфомой. Совсем недавно, в дополнение к этой монотерапии, PAC-1 показал мощный синергетический эффект с одобренными противораковыми препаратами, например, с доксорубицином, при лечении домашних собак с лимфомой и метастатической остеосаркомой.[8] и с темозоломидом при лечении домашних собак со спонтанной глиомой.[9]
Клинические испытания на людях
PAC-1 прошел или в настоящее время проходит следующие клинические испытания на людях:
- NCT02355535 - Соединение-1, активирующее прокаспазу (PAC-1) в лечении запущенных злокачественных новообразований - Компонент 1
- NCT03332355 - Соединение-1, активирующее прокаспазу (PAC-1), в лечении запущенных злокачественных новообразований - компонент 2
- NCT03927248 - PAC-1 для лечения рефрактерного метастатического рака почки
Рекомендации
- ^ а б c Putt KS, Chen GW, Pearson JM, Sandhorst JS, Hoagland MS, Kwon JT, Hwang SK, Jin H, Churchwell MI, Cho MH, Doerge DR, Helferich WG, Hergenrother PJ (2006). «Низкомолекулярная активация прокаспазы-3 в каспазу-3 как персонализированная противораковая стратегия 1». Природа Химическая Биология. 2 (10): 543–50. Дои:10.1038 / nchembio814. PMID 16936720.
- ^ Путински С., Абдул-Гани М., Стайлз Р., Брюнетка С., Дик С.А., Фернандо П., Мегени Л.А. (2013). «Внутренне-опосредованная активация каспаз необходима для гипертрофии кардиомиоцитов». Труды Национальной академии наук. 110 (43): E4079-87. Дои:10.1073 / pnas.1315587110. ЧВК 3808644. PMID 24101493.
- ^ Ван Ф, Ван Л., Чжао И, Ли И, Пинг Дж, Сяо С., Чен К., Чжу В., Гонг П, Ян Дж, Ву С. (2014). «Новый низкомолекулярный активатор прокаспазы-3 индуцирует апоптоз в раковых клетках и снижает рост опухоли в ксенотрансплантатах рака груди, печени и желчного пузыря человека». Молекулярная онкология. 8 (8): 1640–1652. Дои:10.1016 / j.molonc.2014.06.015. ЧВК 5528581.
- ^ Патель В., Балакришнан К., Китин М.Дж., Виерда В.Г., Ганди В. (2015). «Экспрессия прокаспаз палача и их активация соединением, активирующим прокаспазу, в клетках хронического лимфоцитарного лейкоза». Кровь. 125 (7): 1126–1136. Дои:10.1182 / кровь-2014-01-546796. ЧВК 4326772. PMID 25538042.
- ^ Саркар А., Балакришнан К., Чен Дж., Патель В., Нилапу С.С., МакМюррей Дж. С., Ганди В. (2016). «Молекулярное доказательство Zn-хелатирования соединения, активирующего прокаспазу B-PAC-1, при В-клеточной лимфоме». Oncotarget. 7 (3): 3461–3476. Дои:10.18632 / oncotarget.6505. ЧВК 4823120. PMID 26658105.
- ^ Лин А., Джулиано С., Палладино А., Джон К., Абрамович С., Юань М., Сосвилл Е., Луков Д., Лю Л., Чайт А., Галлуццо З., Такер С., Шельцер Дж. (2019). «Нецелевое токсическое действие - это обычный механизм действия противораковых препаратов, проходящих клинические испытания». Sci Transl Med. 11 (509): eaaw8412. Дои:10.1126 / scitranslmed.aaw8412. PMID 31511426.
- ^ Пех Дж., Фан TM, Висисло К.Л., Рот Х.С., Хергенротер П.Дж. (2016). «Комбинация активации вемурафениба и прокаспазы-3 является синергетической при мутантных меланомах BRAF». Молекулярная терапия рака. 15: 1859–1869. Дои:10.1158 / 1535-7163.MCT-16-0025. ЧВК 4975653.
- ^ а б Botham RC, Roth HS, Book AP, Roady PJ, Fan TM, Hergenrother, PJ (2016). «Активация низкомолекулярной прокаспазы-3 делает рак чувствительным к лечению различными химиотерапевтическими средствами». ACS Central Science. 2: 545–559. Дои:10.1021 / acscentsci.6b00165. ЧВК 4999974.
- ^ а б Джоши А.Д., Ботам Р.С., Рот Х.С., Шлейн Л.Дж., Рот Х.С., Мангравити А., Бородовски А., Тайлер Б., Джослин С., Лупер Дж. С., Поделл М., Фан TM, Хергенротер П.Дж., Риггинс Г.Дж. (2017). «Синергетическая и таргетная терапия с активатором прокаспазы-3 и темозоломидом увеличивает выживаемость на моделях глиомы на грызунах и может применяться для лечения пациентов со злокачественной глиомой собак». Oncotarget. 8: 80124–80138. Дои:10.18632 / oncotarget.19085. ЧВК 5655184.
- Peterson, Q.P .; Goode, D. R .; West, D.C .; Ramsey, K. N .; Ли, Дж. Дж .; Хергенротер, П. Дж. (2009). «PAC-1 активирует прокаспазу-3 in vitro за счет снятия цинк-опосредованного ингибирования». J. Mol. Биол. 388 (1): 144–158. Дои:10.1016 / j.jmb.2009.03.003. ЧВК 2714579. PMID 19281821.
- Peterson, Q.P .; Hsu, D. C .; Goode, D. R .; Novotny, C.J .; Тоттен, Р. К. Хергенротер (2009). «Активация прокаспазы-3 как противораковая стратегия: взаимосвязь структура-активность PAC-1 и его клеточная локализация с каспазой-3». J. Med. Chem. 52 (18): 5721–5731. Дои:10.1021 / jm900722z. ЧВК 2749958. PMID 19708658.
- Лукас, П. У .; Schmit, J.M .; Peterson, Q.P .; West, D.C .; Hsu, D. C .; Novotny, C.J .; Dirikoul, L .; Deorge, D. R .; Garrett, L.D .; и другие. (2011). «Фармакокинетика и определение противоракового режима дозирования PAC-1, предпочтительного активатора малых молекул прокаспазы-3, у здоровых собак». Вкладывать деньги. Новые препараты. 29 (5): 901–911. Дои:10.1007 / s10637-010-9445-z. ЧВК 3182491. PMID 20499133.
- Peterson, Q.P .; Hsu, D. C .; Novotny, C.J .; West, D.C .; Kim, D .; Schmit, J.M .; Дириколу, Л .; Hergenrother, P.J .; Fan, T. M .; и другие. (2010). «Открытие и доклиническая оценка на собаках нетоксичного соединения, активирующего прокаспазу-3». Рак Res. 70 (18): 7232–7241. Дои:10.1158 / 0008-5472.can-10-0766. ЧВК 3113694. PMID 20823163.
- West, D.C .; Qin, Y .; Peterson, Q.P .; Thomas, D. L .; Palchaudhuri, R.P .; Моррисон, К. С .; Лукас, П. У .; Palmer, A.E .; Fan, T. M .; и другие. (2012). «Дифференциальные эффекты соединений, активирующих прокаспазу-3, в индукции гибели раковых клеток». Мол. Фармацевтика. 9: 1425–1434.
- Botham, R.C .; Fan, T. M .; Im, I .; Borst, L.B; Дириколу, Л .; Хергенротер, П. Дж. (2014). «Двойное нацеливание на небольшие молекулы прокаспазы-3 значительно усиливает активацию зимогена и противоопухолевую активность». Варенье. Chem. Soc. 136 (4): 1312–1319. Дои:10.1021 / ja4124303. ЧВК 3954530. PMID 24383395.
внешняя ссылка
- Обнаружен палач раковой клетки. BBC News 27 августа 2006 г.
- Раковые клетки могут жить вечно. BBC News 29 апреля 2004 г.
- Победить онкологию
- Бизнес-ангелы помогают продвигать PAC-1 вперед
- FDA присвоило статус орфанного лекарства PAC-1 от глиомы
- Фаза 1 клинических испытаний PAC-1 у больных раком человека Clinicaltrials.gov
