BRAF (ген) - BRAF (gene)
BRAF человек ген который кодирует белок - позвонил Б-Раф. Этот ген также называют протоонкоген B-Raf и Гомолог B вирусного онкогена мышиной саркомы v-Raf, в то время как белок более формально известен как серин / треонин-протеинкиназа B-Raf.[5][6]
Белок B-Raf участвует в отправке сигналы внутри ячеек, которые участвуют в управлении рост клеток. В 2002 году была выявлена неисправность (мутировавший ) в некоторых людях раки.[7]
Некоторые другие унаследованные BRAF мутации вызывают врожденные дефекты.
Препараты для лечения рака, вызванного BRAF мутации. Два из этих препаратов, вемурафениб[8] и дабрафениб одобрены FDA для лечения меланомы на поздней стадии. Вемурафениб был первым одобренным препаратом, вышедшим из открытие лекарств на основе фрагментов.[9]
Функция

Би-Раф является членом Раф киназа семья роста преобразование сигнала протеинкиназы. Этот белок играет роль в регулировании MAP киназа /ERK сигнальный путь, что влияет деление клеток, дифференциация, и секреция.[10]
Структура
B-Raf - это 766-аминокислота, регулируемый преобразование сигнала серин / треонин-специфическая протеинкиназа. Вообще говоря, он состоит из трех сохранившихся домены характеристика Семья киназ раф: консервативная область 1 (CR1), a Рас -GTP переплет[11] саморегулирующийся домен, консервативная область 2 (CR2), a серин -богатая шарнирная область и консервативная область 3 (CR3), каталитическая протеинкиназа домен, который фосфорилаты а консенсусная последовательность на белковых субстратах.[12] В своей активной конформации B-Raf образует димеры через водородная связь и электростатические взаимодействия его киназных доменов.[13]
CR1
Консервированная область 1 автоингибит Киназный домен B-Raf (CR3), так что передача сигналов B-Raf регулируется, а не конститутивно.[12] Остатки 155–227[14] составить Рас -связывающий домен (RBD), который связывается с Ras-GTP эффектор домен для высвобождения CR1 и прекращения ингибирования киназы. Остатки 234–280 содержат форбол сложный эфир /DAG переплет цинковый палец мотив, который участвует в стыковке мембраны B-Raf после связывания Ras.[14][15]
CR2
Консервированная область 2 (CR2) представляет собой гибкий линкер, который соединяет CR1 и CR3 и действует как шарнир.[нужна цитата ]
CR3
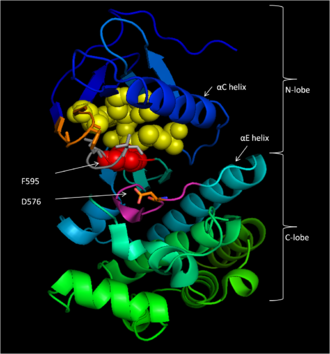
Консервативная область 3 (CR3), остатки 457–717,[14] составляет ферментативный киназный домен B-Raf. Эта в значительной степени сохранившаяся структура[16] двулопастная, соединяется короткой шарнирной областью.[17] Меньший N -доля (остатки 457-530) в первую очередь отвечает за АТФ привязка в то время как больший C -доля (остатки 535-717) связывает субстрат белки.[16] Активный центр - это щель между двумя долями, а каталитический Жерех Остаток 576 расположен на C-доле, обращенной внутрь этой щели.[14][16]
Субрегионы
P-петля
В P-петля B-Raf (остатки 464–471) стабилизирует непередаваемый фосфат группы АТФ во время связывания фермента АТФ. В частности, S 467, F 468, и грамм 469 позвоночник амиды водородная связь с β-фосфатом АТФ для закрепления молекулы. Функциональные мотивы B-Raf были определены путем анализа гомологии PKA проанализированы Хэнксом и Хантером на домен киназы B-Raf.[16]
Карман для связывания нуклеотидов
V 471, C 532, W 531, Т 529, L 514, и А 481 образуют гидрофобный карман, в котором аденин АТФ заякорен за счет притяжения Ван-дер-Ваальса при связывании АТФ.[16][18]
Каталитическая петля
Остатки 574–581 составляют часть киназного домена, ответственного за поддержку переноса γ-фосфата АТФ на белковый субстрат B-Raf. Особенно, D 576 действует как акцептор протонов активировать нуклеофильный гидроксильный кислород на остатках серина или треонина субстрата, позволяя протекать реакции переноса фосфата, опосредованной базовый катализ.[16]
Мотив DFG
D594, F595 и G596 составляют мотив, центральный для функции B-Raf как в его неактивном, так и в активном состоянии. В неактивном состоянии F595 занимает карман для связывания нуклеотидов, препятствуя проникновению АТФ и уменьшая вероятность ферментативного катализа.[13][18][19] В активном состоянии D594 хелаты то двухвалентный магний катион который стабилизирует β- и γ-фосфатные группы АТФ, ориентируя γ-фосфат для переноса.[16]
Цикл активации
Остатки 596-600 образуют сильные гидрофобные взаимодействия с Р-петлей в неактивной конформации киназы, блокируя киназу в неактивном состоянии до тех пор, пока цикл активации фосфорилируется, дестабилизируя эти взаимодействия наличием отрицательного заряда. Это вызывает переход киназы в активное состояние. В частности, L597 и V600 петли активации взаимодействуют с G466, F468 и V471 P-петли, чтобы сохранить киназный домен в неактивном состоянии до тех пор, пока он не будет фосфорилирован.[17]
Энзимология
B-Raf - это серин / треонин-специфическая протеинкиназа. Таким образом, он катализирует фосфорилирование серин и треонин остатки в консенсусная последовательность на целевые белки АТФ, уступая ADP и фосфорилированный белок в качестве продуктов.[16] Поскольку это строго регулируемый преобразование сигнала киназа, B-Raf должен сначала привязать Рас -GTP прежде, чем стать активным как фермент.[15] Как только B-Raf активируется, консервативное каталитическое ядро протеинкиназы фосфорилирует белковые субстраты, способствуя нуклеофильной атаке активированного субстрата серина или треонина. гидроксил атом кислорода на γ-фосфат группа АТФ через бимолекулярное нуклеофильное замещение.[16][20][21][22]
Активация
Снятие аутоингибирования CR1
Киназный (CR3) домен человека Раф киназы тормозится двумя механизмами: самоограничение сам по себе регулирующий Рас -GTP -связывание домена CR1 и отсутствие посттрансляционный фосфорилирование ключевого серина и тирозин остатки (S338 и Y341 для c-Raf) в шарнирной области CR2. Во время активации B-Raf белок автоингибиторный Домен CR1 сначала связывает Ras-GTP эффектор домена к Ras-связывающему домену CR1 (RBD) для высвобождения домена CR3 киназы, как и другие члены человеческого Семья киназ раф. Взаимодействие CR1-Ras позже усиливается за счет связывания цистеин -богатый субдомен (CRD) CR1 в Ras и мембрана фосфолипиды.[12] В отличие от А-Раф и C-Raf, который должен быть фосфорилирован по гидроксилсодержащим остаткам CR2 до полного высвобождения CR1, чтобы стать активным, B-Raf постоянно фосфорилируется на CR2 S445.[23] Это позволяет отрицательно заряженному фосфосерину немедленно отталкивать CR1 посредством стерических и электростатических взаимодействий, когда регуляторный домен не связан, освобождая CR3-киназный домен для взаимодействия с белками-субстратами.
Активация домена CR3
После высвобождения аутоингибиторного регуляторного домена CR1 CR3 B-Raf киназа домен должен измениться на его АТФ -обвязка активна конформер прежде чем он сможет катализировать фосфорилирование белков. В неактивной конформации F595 мотива DFG блокирует гидрофобный аденин карман для переплета в то время как цикл активации остатки образуют гидрофобные взаимодействия с P-петлей, останавливая АТФ от доступа к его сайту привязки. Когда активационная петля фосфорилируется, отрицательный заряд фосфата нестабилен в гидрофобной среде P-петли. В результате цикл активации меняется конформация, протянувшись через C-образную долю киназа домен. В этом процессе он образует стабилизирующие β-лист взаимодействия с β6 цепью. Между тем, фосфорилированный остаток приближается к K507, образуя стабилизирующий соляной мост чтобы зафиксировать петлю активации на месте. Мотив DFG изменяет конформацию с петлей активации, заставляя F595 перемещаться из сайта связывания адениновых нуклеотидов в гидрофобный карман, ограниченный Спирали αC и αE. Вместе DFG и движение петли активации при фосфорилировании открывают АТФ. сайт привязки. Поскольку все другие субстрат-связывающие и каталитические домены уже присутствуют, фосфорилирование одной только активационной петли активирует киназный домен B-Raf посредством цепной реакции, которая по существу удаляет крышку с подготовленного иным образом активного сайта.[17]
Механизм катализа

Эффективно катализировать фосфорилирование белков посредством бимолекулярного замещения остатков серина и треонина на ADP как уходящая группа, B-Raf должен сначала связывать АТФ, а затем стабилизировать переходное состояние поскольку передается γ-фосфат АТФ.[16]
Связывание АТФ
B-Raf связывает АТФ, закрепляя нуклеотид аденина в неполярный карман (желтый, рис. 1) и ориентируя молекулу за счет водородных связей и электростатических взаимодействий с фосфатными группами. Помимо фосфатного связывания P-петли и мотива DFG, описанного выше, K483 и E501 играют ключевую роль в стабилизации непереносимых фосфатных групп. Положительный заряд на первичной амин K483 позволяет ему стабилизировать отрицательный заряд на α- и β-фосфатных группах АТФ при связывании АТФ. Когда АТФ отсутствует, отрицательный заряд E501 карбоксил группа уравновешивает эту плату.[16][17]
Фосфорилирование
Как только АТФ связывается с доменом киназы B-Raf, D576 каталитической петли активирует гидроксильную группу субстрата, увеличивая ее нуклеофильность, чтобы кинетически управлять реакцией фосфорилирования, в то время как другие остатки каталитической петли стабилизируют переходное состояние (рис. 2). N581 хелатирует двухвалентный катион магния, связанный с АТФ, чтобы помочь сориентировать молекулу для оптимального замещения. K578 нейтрализует отрицательный заряд на γ-фосфатной группе АТФ, так что активированный остаток субстрата ser / thr не будет испытывать такое сильное электрон-электронное отталкивание при атаке фосфата. После переноса фосфатной группы высвобождаются АДФ и новый фосфопротеин.[16]
Ингибиторы
Поскольку конститутивно активные мутанты B-Raf обычно вызывают рак (см. «Клиническая значимость») из-за чрезмерной передачи сигналов клеткам для роста, ингибиторы B-Raf были разработаны как для неактивных, так и для активных конформаций киназного домена в качестве кандидатов для лечения рака.[17][18][19]
Сорафениб

BAY43-9006 (Сорафениб, Nexavar) - это V600E мутант B-Raf и C-Raf ингибитор одобрен FDA для лечения первичного печень и почка рак. Bay43-9006 отключает B-Raf киназа домен, заблокировав фермент в неактивной форме. Ингибитор выполняет это, блокируя карман связывания АТФ за счет высокойблизость для киназного домена. Затем он связывает ключевую активационную петлю и остатки мотива DFG, чтобы остановить движение активационной петли и мотива DFG к активной конформации. Наконец, трифторметилфенильный фрагмент стерически блокирует мотив DFG и активный сайт конформации петли активации, делая невозможным сдвиг конформации киназного домена, чтобы стать активным.[17]
Дистальный пиридил кольцо BAY43-9006 закрепляется в гидрофобном нуклеотид-связывающем кармане N-доли киназы, взаимодействуя с W531, F583 и F595. Гидрофобные взаимодействия с каталитической петлей F583 и мотивом DFG F595 стабилизируют неактивную конформацию этих структур, снижая вероятность активации фермента. Дальнейшее гидрофобное взаимодействие K483, L514 и T529 с центральным фенильным кольцом увеличивает близость киназного домена ингибитора. Гидрофобное взаимодействие F595 с центральным кольцом также снижает энергетическую привлекательность переключателя конформации DFG. Наконец, полярные взаимодействия BAY43-9006 с киназным доменом продолжают эту тенденцию увеличения ферментативного сродства к ингибитору и стабилизации остатков DFG в неактивной конформации. E501 и C532 водородные связи мочевина и пиридильные группы ингибитора соответственно, в то время как мочевина карбонил принимает водородную связь от основной цепи D594 амид азот, чтобы закрепить мотив DFG на месте.[17]
Трифторметилфенильный фрагмент закрепляет термодинамическую благоприятность неактивной конформации, когда киназный домен связывается с BAY43-9006, стерически блокируя гидрофобный карман между спиралями αC и αE, в котором будут располагаться мотив DFG и петля активации при перемещении в их положения в активная конформация белка.[17]
Вемурафениб

PLX4032 (Вемурафениб ) - это V600 мутант Ингибитор B-Raf одобрен FDA для лечения поздних стадий меланома.[13] В отличие от BAY43-9006, который ингибирует неактивную форму киназного домена, вемурафениб ингибирует активную "DFG-in" форму киназы,[18][19] прочно закрепляется в сайте связывания АТФ. Ингибируя только активную форму киназы, вемурафениб избирательно подавляет пролиферацию клеток с нерегулируемым B-Raf, обычно тех, которые вызывают рак.
Поскольку вемурафениб отличается от своего предшественника PLX4720 только фенил кольцо добавлено для фармакокинетический причины,[19] Принцип действия PLX4720 эквивалентен действию вемурафениба. PLX4720 имеет хорошее сродство к сайту связывания АТФ частично потому, что его якорная область, 7-азаиндол бициклический, отличается только от природного аденина, который занимает позиции в двух местах, где атомы азота заменены углеродом. Это позволяет сохранять сильные межмолекулярные взаимодействия, такие как водородная связь N7 с C532 и водородная связь N1 с Q530. Превосходное размещение в гидрофобном кармане, связывающем АТФ (C532, W531, T529, L514, A481), также увеличивает сродство связывания. Кетон водородная связь линкера с водой и дифторфенил, входящий во второй гидрофобный карман (A481, V482, K483, V471, I527, T529, L514 и F583), вносят вклад в исключительно высокое сродство связывания в целом. Селективное связывание с активным Raf осуществляется концевой пропильной группой, которая связывается с Raf-селективным карманом, созданным смещением спирали αC. Селективность в отношении активной конформации киназы дополнительно увеличивается за счет pH-чувствительного депротонированного сульфонамид группа, которая стабилизируется водородной связью с пептидом основной цепи NH D594 в активном состоянии. В неактивном состоянии сульфонамидная группа ингибитора взаимодействует с остовом. карбонил вместо этого остатка, создавая отталкивание. Таким образом, вемурафениб связывается преимущественно с активным состоянием киназного домена B-Raf.[18][19]
Клиническое значение
Мутации в BRAF ген может вызывать заболевание двумя способами. Во-первых, мутации могут передаваться по наследству и вызывать врожденные дефекты. Во-вторых, мутации могут появляться в более позднем возрасте и вызывать рак, как онкоген.
Унаследованные мутации в этом гене вызывают кардиофациально-кожный синдром, заболевание, характеризующееся пороками сердца, умственной отсталостью и характерной внешностью.[24]
Мутации в этом гене были обнаружены при раке, включая неходжкинская лимфома, колоректальный рак, злокачественный меланома, папиллярная карцинома щитовидной железы, немелкоклеточный рак легкого, аденокарцинома легкого, опухоли головного мозга в том числе глиобластома и плеоморфная ксантоастроцитома а также воспалительные заболевания, такие как Болезнь Эрдхейма-Честера.[10]
Мутация V600E гена BRAF была связана с волосатоклеточный лейкоз в многочисленных исследованиях и был предложен для использования в скрининге на Синдром Линча уменьшить количество пациентов, проходящих ненужные MLH1 последовательность действий.[25][26]
Мутанты
Более 30 мутаций BRAF ген, связанный с раком человека, не идентифицирован. Частота мутаций BRAF широко варьируется при раке человека, от более 80% в меланомы и невусы, до 0–18% в других опухоли, например, 1–3% при раке легких и 5% при колоректальный рак.[27] В 90% случаев тимин заменяется аденином по нуклеотиду 1799. Это приводит к замене валина (V) на глутамат (E) по кодону 600 (теперь обозначается как V600E ) в сегменте активации, который был обнаружен при раке человека.[28] Эта мутация широко наблюдалась в папиллярная карцинома щитовидной железы, колоректальный рак, меланома и немелкоклеточный рак легкого.[29][30][31][32][33][34][35] Мутация BRAF-V600E присутствует у 57% пациентов с гистиоцитозом клеток Лангерганса.[36] Мутация V600E является вероятной мутацией драйвера в 100% случаев волосатоклеточный лейкоз.[37] Высокая частота мутаций BRAF V600E была обнаружена в амелобластоме, доброкачественном, но локально инфильтративном одонтогенном новообразовании.[38] Мутация V600E также может быть связана как мутация с одним драйвером (генетический «дымящийся пистолет») с некоторыми случаями папиллярного краниофарингиома разработка.[39]
Другие обнаруженные мутации: R461I, I462S, G463E, G463V, G465A, G465E, G465V, G468A, G468E, N580S, E585K, D593V, F594L, G595R, L596V, T598I, V5995, V599V, V599V, V599V, V599V и т. д., и большинство этих мутаций сгруппированы в две области: богатая глицином P-петля N-доли и сегмент активации и фланкирующие области.[17] Эти мутации изменяют активационный сегмент из неактивного состояния в активное состояние, например, в ранее цитированной статье сообщалось, что алифатическая боковая цепь Val599 взаимодействует с фенильным кольцом Phe467 в P-петле. Ожидается, что замена гидрофобной боковой цепи Val среднего размера на более крупный и заряженный остаток, обнаруживаемый при раке человека (Glu, Asp, Lys или Arg), дестабилизирует взаимодействия, которые поддерживают мотив DFG в неактивной конформации, поэтому сегмент активации в активную позицию. В зависимости от типа мутации активность киназы по отношению к МЕК также могут отличаться. Большинство мутантов стимулируют усиление B-Raf. киназа активность в отношении МЕК. Однако некоторые мутанты действуют по другому механизму, потому что, хотя их активность в отношении MEK снижена, они принимают конформацию, которая активирует C-RAF дикого типа, который затем передает сигнал к ERK.
BRAF-V600E
- BRAF V600E определяет чувствительность к протеасома ингибиторы. Уязвимость к ингибиторы протеасом зависит от постоянной передачи сигналов BRAF, поскольку блокада BRAF-V600E PLX4720 обратная чувствительность к карфилзомиб в клетках колоректального рака, мутантных по BRAF. Ингибирование протеасомы может представлять ценную стратегию нацеливания на мутантные колоректальные опухоли BRAF V600E.[40]
Ингибиторы BRAF
Как упоминалось выше, некоторые фармацевтические фирмы разрабатывают специфические ингибиторы мутированного белка B-raf для противораковое средство использовать, потому что BRAF - это хорошо изученная цель с высокой доходностью.[18][41] Вемурафениб (RG7204 или PLX4032) был лицензирован США Управление по контролю за продуктами и лекарствами as Zelboraf для лечения метастатической меланомы в августе 2011 года на основании клинических данных фазы III. Было замечено улучшение выживаемости, а также степень ответа на лечение на 53% по сравнению с 7-12% при предыдущем лучшем химиотерапевтическом лечении. дакарбазин.[42] В клинических испытаниях B-Raf увеличивал вероятность выживания пациента с метастатической меланомой. Несмотря на высокую эффективность препарата, 20% опухолей все еще развивают устойчивость к лечению. У мышей 20% опухолей становятся устойчивыми через 56 дней.[43] Хотя механизмы этой устойчивости все еще обсуждаются, некоторые гипотезы включают сверхэкспрессию B-Raf для компенсации высоких концентраций вемурафениба.[43] и восходящая регуляция сигналов роста.[44]
Более общий Ингибиторы B-Raf включают GDC-0879, PLX-4720, Сорафениб, дабрафениб и LGX818
Взаимодействия
BRAF (ген) показал способность взаимодействовать с:
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000157764 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000002413 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Sithanandam G, Kolch W, Duh FM, Rapp UR (декабрь 1990 г.). «Полная кодирующая последовательность кДНК B-raf человека и обнаружение протеинкиназы B-raf с помощью изоферментных антител». Онкоген. 5 (12): 1775–80. PMID 2284096.
- ^ Ситанандам Дж., Драк Т., Канниццаро Л.А., Леуцци Дж., Хюбнер К., Рапп У. Р. (апрель 1992 г.). «Псевдоген B-raf и B-raf расположены на 7q у человека». Онкоген. 7 (4): 795–9. PMID 1565476.
- ^ Дэвис Х., Бигнелл Г.Р., Кокс С., Стивенс П., Эдкинс С., Клегг С. и др. (Июнь 2002 г.). «Мутации гена BRAF при раке человека» (PDF). Природа. 417 (6892): 949–54. Bibcode:2002Натура.417..949D. Дои:10.1038 / природа00766. PMID 12068308. S2CID 3071547.
- ^ «FDA одобряет Зелбораф (Вемурафениб) и сопутствующий диагностический прибор для метастатической меланомы с положительной мутацией BRAF, смертельной формы рака кожи» (Пресс-релиз). Genentech. Получено 2011-08-17.
- ^ Эрлансон Д.А., Фесик С.В., Хаббард Р.Э., Янке В., Джоти Х. (сентябрь 2016 г.). «Двадцать лет спустя: влияние фрагментов на открытие лекарств». Обзоры природы. Открытие наркотиков. 15 (9): 605–619. Дои:10.1038 / nrd.2016.109. PMID 27417849. S2CID 19634793.
- ^ а б "Entrez Gene: BRAF".
- ^ Даум Дж., Айзенманн-Таппе I, Фрис Х.В., Троппмайр Дж., Рапп У. Р. (ноябрь 1994 г.). «Тонкости кинасов Рафа». Тенденции в биохимических науках. 19 (11): 474–80. Дои:10.1016/0968-0004(94)90133-3. PMID 7855890.
- ^ а б c Катлер Р. Э., Стивенс Р. М., Сарачино М. Р., Моррисон Д. К. (август 1998 г.). «Ауторегуляция серин / треонинкиназы Raf-1». Труды Национальной академии наук Соединенных Штатов Америки. 95 (16): 9214–9. Bibcode:1998PNAS ... 95.9214C. Дои:10.1073 / пнас.95.16.9214. ЧВК 21318. PMID 9689060.
- ^ а б c Боллаг Дж., Цай Дж., Чжан Дж., Чжан С., Ибрагим П., Нолоп К., Хирт П. (ноябрь 2012 г.). «Вемурафениб: первый препарат, одобренный для лечения мутантного рака BRAF». Обзоры природы. Открытие наркотиков. 11 (11): 873–86. Дои:10.1038 / nrd3847. PMID 23060265. S2CID 9337155.
- ^ а б c d «Серин / треониновая протеинкиназа B-rAF». Получено 4 марта 2013.
- ^ а б Моррисон Д. К., Катлер Р. Е. (апрель 1997 г.). «Сложность регулирования Раф-1». Текущее мнение в области клеточной биологии. 9 (2): 174–9. Дои:10.1016 / S0955-0674 (97) 80060-9. PMID 9069260.
- ^ а б c d е ж грамм час я j k л Хэнкс С.К., Хантер Т. (май 1995 г.). «Протеинкиназы 6. Надсемейство эукариотических протеинкиназ: структура и классификация киназного (каталитического) домена». Журнал FASEB. 9 (8): 576–96. Дои:10.1096 / fasebj.9.8.7768349. PMID 7768349. S2CID 21377422.
- ^ а б c d е ж грамм час я Ван П.Т., Гарнетт М.Дж., Роу С.М., Ли С., Никулеску-Дуваз Д., Гуд В.М. и др. (Март 2004 г.). Проект генома рака. «Механизм активации сигнального пути RAF-ERK онкогенными мутациями B-RAF». Клетка. 116 (6): 855–67. Дои:10.1016 / S0092-8674 (04) 00215-6. PMID 15035987. S2CID 126161.
- ^ а б c d е ж Цай Дж., Ли Дж. Т., Ван В., Чжан Дж., Чо Х, Мамо С. и др. (Февраль 2008 г.). «Открытие селективного ингибитора онкогенной киназы B-Raf с сильной антимеланомной активностью». Труды Национальной академии наук Соединенных Штатов Америки. 105 (8): 3041–6. Bibcode:2008PNAS..105.3041T. Дои:10.1073 / pnas.0711741105. ЧВК 2268581. PMID 18287029.
- ^ а б c d е Боллаг Дж., Хирт П., Цай Дж., Чжан Дж., Ибрагим П. Н., Чо Х и др. (Сентябрь 2010 г.). «Клиническая эффективность ингибитора RAF требует широкой блокады мишеней при меланоме с мутантным BRAF». Природа. 467 (7315): 596–9. Bibcode:2010Натура.467..596Б. Дои:10.1038 / природа09454. ЧВК 2948082. PMID 20823850.
- ^ Хэнкс С.К., Куинн А.М., Хантер Т. (июль 1988 г.). «Семейство протеинкиназ: консервативные особенности и предполагаемая филогения каталитических доменов». Наука. 241 (4861): 42–52. Bibcode:1988Научный ... 241 ... 42H. Дои:10.1126 / science.3291115. PMID 3291115.
- ^ Хэнкс СК (июнь 1991 г.). «Эукариотические протеинкиназы». Curr. Мнение. Struct. Биол. 1 (3): 369–383. Дои:10.1016 / 0959-440X (91) 90035-R.
- ^ Хэнкс С.К., Куинн А.М. (1991). «[2] База данных последовательностей каталитических доменов протеинкиназ: Идентификация консервативных характеристик первичной структуры и классификация членов семейства». База данных последовательностей каталитических доменов протеинкиназ: идентификация консервативных признаков первичной структуры и классификация членов семейства. Методы в энзимологии. 200. С. 38–62. Дои:10.1016 / 0076-6879 (91) 00126-Н. ISBN 9780121821012. PMID 1956325.
- ^ Мейсон С.С., Спрингер С.Дж., Купер Р.Г., Суперти-Фурга Дж., Маршалл С.Дж., Марэ Р. (апрель 1999 г.). «Фосфорилирование серина и тирозина взаимодействует в Raf-1, но не при активации B-Raf». Журнал EMBO. 18 (8): 2137–48. Дои:10.1093 / emboj / 18.8.2137. ЧВК 1171298. PMID 10205168.
- ^ Робертс А., Аллансон Дж., Ядико С.К., Кавамура М.И., Нунан Дж., Опиц Дж. М. и др. (Ноябрь 2006 г.). «Кардиофациально-кожный синдром». Журнал медицинской генетики. 43 (11): 833–42. Дои:10.1136 / jmg.2006.042796. ЧВК 2563180. PMID 16825433.
- ^ Эвалт М., Нандула С., Филлипс А., Алобейд Б., Мурти В.В., Мансукхани М.М., Бхагат Г. (декабрь 2012 г.). «Анализ на основе ПЦР в реальном времени мутации BRAF V600E в лимфомах низкой и средней степени злокачественности подтверждает частое возникновение лейкемии волосатых клеток». Гематологическая онкология. 30 (4): 190–3. Дои:10.1002 / hon.1023. PMID 22246856. S2CID 204843221.
- ^ Паломаки Г.Е., Макклейн М.Р., Мелилло С., Хампель Х.Л., Тибодо С.Н. (январь 2009 г.). «Обзор дополнительных данных EGAPP: стратегии тестирования ДНК, направленные на снижение заболеваемости и смертности от синдрома Линча». Генетика в медицине. 11 (1): 42–65. Дои:10.1097 / GIM.0b013e31818fa2db. ЧВК 2743613. PMID 19125127.
- ^ Намба Х., Накашима М., Хаяси Т., Хаяшида Н., Маэда С., Рогонович Т.И. и др. (Сентябрь 2003 г.). «Клиническое значение мутации горячей точки BRAF, V599E, при папиллярном раке щитовидной железы». Журнал клинической эндокринологии и метаболизма. 88 (9): 4393–7. Дои:10.1210 / jc.2003-030305. PMID 12970315.
- ^ Тан Й.Х., Лю Й., Эу К.В., Анг PW, Ли В.К., Сальто-Теллез М. и др. (Апрель 2008 г.). «Обнаружение мутации BRAF V600E пиросеквенированием». Патология. 40 (3): 295–8. Дои:10.1080/00313020801911512. PMID 18428050. S2CID 32051681.
- ^ Ли В.К., Каваками К., Рушкевич А., Беннетт Дж., Мур Дж., Якопетта Б. (январь 2006 г.). «Мутации BRAF связаны с отличительными клиническими, патологическими и молекулярными особенностями колоректального рака независимо от статуса микросателлитной нестабильности». Молекулярный рак. 5 (1): 2. Дои:10.1186/1476-4598-5-2. ЧВК 1360090. PMID 16403224.
- ^ Бенллох С., Пая А., Аленда С., Бесса Х, Андреу М., Джовер Р. и др. (Ноябрь 2006 г.). «Обнаружение мутации BRAF V600E при колоректальном раке: сравнение автоматического секвенирования и методологии химии в реальном времени». Журнал молекулярной диагностики. 8 (5): 540–3. Дои:10.2353 / jmoldx.2006.060070. ЧВК 1876165. PMID 17065421.
- ^ Дэн Дж., Белл I, Кроули С., Гам Дж., Тердиман Дж. П., Аллен Б. А. и др. (Январь 2004 г.). «Мутация BRAF часто присутствует при спорадическом колоректальном раке с метилированным hMLH1, но не при наследственном неполипозном колоректальном раке». Клинические исследования рака. 10 (1 Пет 1): 191–5. Дои:10.1158 / 1078-0432.CCR-1118-3. PMID 14734469.
- ^ Gear H, Уильямс H, Кемп EG, Робертс F (август 2004 г.). «Мутации BRAF при меланоме конъюнктивы». Исследовательская офтальмология и визуализация. 45 (8): 2484–8. Дои:10.1167 / iovs.04-0093. PMID 15277467.
- ^ Мальдонадо Дж. Л., Фридлянд Дж., Патель Х., Джайн А. Н., Бусам К., Кагешита Т. и др. (Декабрь 2003 г.). «Детерминанты мутации BRAF при первичных меланомах». Журнал Национального института рака. 95 (24): 1878–90. Дои:10.1093 / jnci / djg123. PMID 14679157.
- ^ Пукседду Э., Моретти С., Элизей Р., Ромей С., Паскуччи Р., Мартинелли М. и др. (Май 2004 г.). «Мутация BRAF (V599E) является ведущим генетическим событием при спорадических папиллярных карциномах щитовидной железы у взрослых». Журнал клинической эндокринологии и метаболизма. 89 (5): 2414–20. Дои:10.1210 / jc.2003-031425. PMID 15126572.
- ^ Элисей Р., Уголини С., Виола Д., Лупи С., Бьяджини А., Джаннини Р. и др. (Октябрь 2008 г.). «Мутация BRAF (V600E) и исходы пациентов с папиллярной карциномой щитовидной железы: среднее последующее исследование за 15 лет». Журнал клинической эндокринологии и метаболизма. 93 (10): 3943–9. Дои:10.1210 / jc.2008-0607. PMID 18682506.
- ^ Бадалян-Вери Дж., Вергилио Дж. А., Дегар Б. А., Родригес-Галиндо С., Роллинз Б. Дж. (Январь 2012 г.). «Последние достижения в понимании гистиоцитоза клеток Лангерганса». Британский журнал гематологии. 156 (2): 163–72. Дои:10.1111 / j.1365-2141.2011.08915.x. PMID 22017623. S2CID 34922416.
- ^ Тиаччи Э., Трифонов В., Скьявони Г., Холмс А., Керн В., Мартелли М. П. и др. (Июнь 2011 г.). «Мутации BRAF при волосисто-клеточном лейкозе». Медицинский журнал Новой Англии. 364 (24): 2305–15. Дои:10.1056 / NEJMoa1014209. ЧВК 3689585. PMID 21663470. Сложить резюме – Блог Science Update: Cancer Research UK.
- ^ Курппа К.Дж., Катон Дж., Морган П.Р., Ристимяки А., Рухин Б., Келлокоски Дж. И др. (Апрель 2014 г.). «Высокая частота мутаций BRAF V600E при амелобластоме». Журнал патологии. 232 (5): 492–8. Дои:10.1002 / путь.4317. ЧВК 4255689. PMID 24374844.
- ^ Brastianos PK, Taylor-Weiner A, Manley PE, Jones RT, Dias-Santagata D, Thorner AR, et al. (Февраль 2014). «Секвенирование экзома выявляет мутации BRAF в папиллярных краниофарингиомах». Природа Генетика. 46 (2): 161–5. Дои:10,1038 / нг.2868. ЧВК 3982316. PMID 24413733. Сложить резюме – Broad Institute.
- ^ Zecchin D, Boscaro V, Medico E, Barault L, Martini M, Arena S и др. (Декабрь 2013). «BRAF V600E определяет чувствительность к ингибиторам протеасом» (PDF). Молекулярная терапия рака. 12 (12): 2950–61. Дои:10.1158 / 1535-7163.MCT-13-0243. PMID 24107445. S2CID 17012966.
- ^ King AJ, Patrick DR, Batorsky RS, Ho ML, Do HT, Zhang SY и др. (Декабрь 2006 г.). «Демонстрация генетического терапевтического индекса опухолей, экспрессирующих онкогенный BRAF с помощью ингибитора киназы SB-590885». Исследования рака. 66 (23): 11100–5. Дои:10.1158 / 0008-5472.CAN-06-2554. PMID 17145850.
- ^ Чапман П.Б., Хаушильд А., Роберт С., Хаанен Дж. Б., Асьерто П., Ларкин Дж. И др. (Июнь 2011 г.). Исследовательская группа БРИМ-3. «Повышение выживаемости с применением вемурафениба при меланоме с мутацией BRAF V600E». Медицинский журнал Новой Англии. 364 (26): 2507–16. Дои:10.1056 / NEJMoa1103782. ЧВК 3549296. PMID 21639808.
- ^ а б Дас Тхакур М., Салангсанг Ф., Ландман А.С., Селлерс В.Р., Прайер Н.К., Левеск М.П. и др. (Февраль 2013). «Моделирование устойчивости к вемурафенибу при меланоме раскрывает стратегию предотвращения лекарственной устойчивости». Природа. 494 (7436): 251–5. Bibcode:2013Натура.494..251D. Дои:10.1038 / природа11814. ЧВК 3930354. PMID 23302800.
- ^ Назарян Р., Ши Х., Ван Кью, Конг Х, Коя Р.С., Ли Х и др. (Декабрь 2010 г.). «Меланомы приобретают устойчивость к ингибированию B-RAF (V600E) за счет активации RTK или N-RAS». Природа. 468 (7326): 973–7. Bibcode:2010Натура.468..973Н. Дои:10.1038 / природа09626. ЧВК 3143360. PMID 21107323.
- ^ Гуан К.Л., Фигероа С., Бртва Т.Р., Чжу Т., Тейлор Дж., Барбер Т.Д., Войтек А.Б. (сентябрь 2000 г.). «Отрицательная регуляция серин / треонинкиназы B-Raf посредством Akt». Журнал биологической химии. 275 (35): 27354–9. Дои:10.1074 / jbc.M004371200. PMID 10869359.
- ^ Вебер CK, Слупский JR, Kalmes HA, Rapp UR (май 2001 г.). «Активный Ras вызывает гетеродимеризацию cRaf и BRaf». Исследования рака. 61 (9): 3595–8. PMID 11325826.
- ^ Станг С., Ботторфф Д., Стоун Дж. С. (июнь 1997 г.). «Взаимодействие активированного Ras с одним только Raf-1 может быть достаточным для трансформации клеток крысы 2». Молекулярная и клеточная биология. 17 (6): 3047–55. Дои:10.1128 / MCB.17.6.3047. ЧВК 232157. PMID 9154803.
- ^ Reuter CW, Catling AD, Jelinek T, Weber MJ (март 1995 г.). «Биохимический анализ активации MEK в фибробластах NIH3T3. Идентификация B-Raf и других активаторов». Журнал биологической химии. 270 (13): 7644–55. Дои:10.1074 / jbc.270.13.7644. PMID 7706312.
- ^ Юинг Р.М., Чу П., Элизма Ф., Ли Х., Тейлор П., Клими С. и др. (2007). «Крупномасштабное картирование белок-белковых взаимодействий человека с помощью масс-спектрометрии». Молекулярная системная биология. 3 (1): 89. Дои:10.1038 / msb4100134. ЧВК 1847948. PMID 17353931.
- ^ Цю В., Чжуан С., фон Линтиг ФК, Босс Г.Р., Пильц РБ (октябрь 2000 г.). «Клеточная регуляция киназы B-Raf с помощью цАМФ и 14-3-3 белков». Журнал биологической химии. 275 (41): 31921–9. Дои:10.1074 / jbc.M003327200. PMID 10931830.
дальнейшее чтение
- Гарнетт MJ, Marais R (октябрь 2004 г.). «Виновен по обвинению: B-RAF - человеческий онкоген». Раковая клетка. 6 (4): 313–9. Дои:10.1016 / j.ccr.2004.09.022. PMID 15488754.
- Куирос Р.М., Дин Х.Г., Гаттузо П., Принц Р.А., Сюй Х (июнь 2005 г.). «Доказательства того, что одна подгруппа анапластической карциномы щитовидной железы происходит от папиллярной карциномы из-за мутаций BRAF и p53». Рак. 103 (11): 2261–8. Дои:10.1002 / cncr.21073. PMID 15880523. S2CID 29665029.
- Karbowniczek M, Henske EP (ноябрь 2005 г.). «Роль туберина в дифференцировке клеток: участвуют ли B-Raf и MAPK?». Летопись Нью-Йоркской академии наук. 1059 (1): 168–73. Bibcode:2005НЯСА1059..168К. Дои:10.1196 / летопись.1339.045. PMID 16382052. S2CID 39146204.
- Чампи Р., Никифоров Ю.Е. (март 2007 г.). «Перестройки RET / PTC и мутации BRAF при онкогенезе щитовидной железы». Эндокринология. 148 (3): 936–41. Дои:10.1210 / en.2006-0921. PMID 16946010.
- Эспиноза А.В., Порчиа Л., Рингель, доктор медицины (январь 2007 г.). «Ориентация на BRAF при раке щитовидной железы». Британский журнал рака. 96 (1): 16–20. Дои:10.1038 / sj.bjc.6603520. ЧВК 2360215. PMID 17179987.
- Аллансон Дж., Робертс А. Е. (8 августа 2019 г.). «Синдром Нунана». В Pagon RA, Bird TD, Dolan CR и др. (ред.). GeneReviews [Интернет]. Сиэтл, Вашингтон: Вашингтонский университет, Сиэтл.
- Рауэн К.А. (3 марта 2016 г.) [18 января 2007 г.]. «Кардиофациально-кожный синдром». В Pagon RA, Bird TD, Dolan CR (ред.). GeneReviews [Интернет]. Сиэтл, Вашингтон: Вашингтонский университет, Сиэтл.
- Гелб Б.Д., Тарталья М. (14 мая 2015 г.) [30 ноября 2007 г.]. «Синдром ЛЕОПАРДА». В Pagon RA, Bird TD, Dolan CR (ред.). GeneReviews [Интернет]. Сиэтл, Вашингтон: Вашингтонский университет, Сиэтл.
внешняя ссылка
- «Ген BRAF». Словарь терминов NCI по раку. Получено 2007-11-25.
- Поиск неисправностей в BRAF - Сообщение в блоге Cancer Research UK об открытии мутаций BRAF, вызывающих рак (включая видео)
- Человек BRAF расположение генома и BRAF страница сведений о генах в Браузер генома UCSC.
![]() Эта статья включаетматериалы общественного достояния из США Национальный институт рака документ: «Словарь терминов по раку».Эта статья включает текст из Национальная медицинская библиотека США, который находится в всеобщее достояние.
Эта статья включаетматериалы общественного достояния из США Национальный институт рака документ: «Словарь терминов по раку».Эта статья включает текст из Национальная медицинская библиотека США, который находится в всеобщее достояние.