Выход из группы - Leaving group
В химия, а уходящая группа представляет собой молекулярный фрагмент, который уходит с парой электроны в гетеролитический разрыв связи. Выход из группы может быть анионы, катионы или нейтральные молекулы, но в любом случае важно, чтобы уходящая группа была способна стабилизировать дополнительную электронную плотность, которая возникает в результате гетеролиза связей. Общие анионные уходящие группы: галогениды такие как Cl−, Br−, и я−, и сульфонат сложные эфиры, такие как тозилат (ЦО−). Фторид (F−) функционирует как уходящая группа в нервно-паралитическом агенте зарин газ. Общие уходящие группы нейтральных молекул: воды и аммиак. Уходящие группы также могут быть положительно заряженными катионами (такими как H+ выпущен во время нитрование из бензол ); они также известны как электроборды.[1][2]
Возможность выхода из группы
Физическое проявление способности покидать группу - это скорость, с которой происходит реакция. Хорошие уходящие группы дают быструю реакцию. К теория переходного состояния, это означает, что реакции с участием хороших уходящих групп имеют низкие активационные барьеры, ведущие к относительно стабильным переходным состояниям.
Полезно рассмотреть концепцию способности выйти из группы в случае первого шага SN1 / E1 реакция с анионной уходящей группой (ионизация), при этом следует помнить, что эту концепцию можно обобщить на все реакции, в которых участвуют уходящие группы. Поскольку уходящая группа несет больший отрицательный заряд в переходном состоянии (и в продуктах), чем в исходном материале, хорошая уходящая группа должна быть способна стабилизировать этот отрицательный заряд, т.е. образовывать стабильные анионы. Хорошим показателем стабильности аниона является pKa аниона конъюгированная кислота, и способность покидать группу действительно обычно следует этой тенденции с более низким pKаH ассоциируется с лучшей способностью покинуть группу.

Корреляция между pKаH и способность покидать группу, однако, не идеальны. Способность покидать группу представляет собой разницу в энергии между исходными материалами и переходным состоянием (ΔG‡) и различия в способности выхода из группы отражаются в изменении этой величины (ΔΔG‡). Величина pKаH, однако, представляет собой разницу в энергии между исходными материалами и продуктами (ΔG) с различиями в кислотности, отраженными в изменениях этого количества (ΔΔG). Также исходные материалы в этих случаях разные. В случае pKа«уходящая группа» связана с протоном в исходном материале, тогда как в случае способности уходящей группы уходящая группа связана (обычно) с углеродом. Принимая во внимание эти важные предостережения, необходимо учитывать pKаH отражает способности выхода из группы, но, тем не менее, тенденции в каждой из них имеют тенденцию хорошо коррелировать друг с другом. В соответствии с этой картиной, сильные основания, такие как OH−, ИЛИ ЖЕ− и NR2− имеют тенденцию создавать плохие уходящие группы из-за их неспособности стабилизировать отрицательный заряд.
| Уходящие группы упорядочены примерно по мере уменьшения возможности выхода[3] | |
|---|---|
| R-N2+ | диазот |
| R-OR '2+ | диалкиловый эфир |
| Р-ОСО2рF | перфторалкилсульфонаты (например, трифлат ) |
| Р-ОТ, Р-ОМ и др. | тозилаты, мезилаты и подобные |
| R-I | йодид |
| R-Br | бромид |
| R-OH2+, R'-OHR+ | воды, спирты |
| R-Cl | хлористый |
| Р-ОНО2, Р-ОПО (ОН)2 | нитрат, фосфат, и другие неорганические эфиры |
| R-SR '2+ | тиоэфир |
| R-NR '3+, R-NH3+ | амины, аммиак |
| R-F | фторид |
| R-OCOR | карбоксилат |
| Рев | феноксиды |
| R-OH, R-OR | гидроксид, алкоксиды |
| R-NR2 | амиды |
Это очень редко для таких групп, как H− (гидриды ) и R3C− (алкильные анионы, R = алкил или H) уходят с парой электронов из-за нестабильности этих оснований.
Контекстные различия в способностях выхода из группы
Важно отметить, что приведенный выше список является качественным и описывает тенденции. Возможность группы уйти зависит от контекста. Например, в SNAr реакций, скорость обычно увеличивается, когда уходящей группой является фторид по сравнению с другими галогенами. Этот эффект обусловлен тем фактом, что переходное состояние с наивысшей энергией для этого двухэтапного процесса присоединения-отщепления происходит на первом этапе, где более высокая способность фторида к поглощению электронов по сравнению с другими галогенидами стабилизирует развивающийся отрицательный заряд на ароматическом кольце. Уход уходящей группы происходит быстро из этой высокой энергии. Комплекс Мейзенхаймера, и поскольку отход не участвует в стадии ограничения скорости, он не влияет на общую скорость реакции. Этот эффект обычно связан с устранением оснований.
Даже когда уход уходящей группы связан с этапом реакции, ограничивающим скорость, все же могут существовать контекстные различия, которые могут изменить порядок выхода из группы способности. В Алкилирование Фриделя-Крафтса, нормальный порядок уходящей группы галогена меняется на противоположный, так что скорость реакции соответствует RF> RCl> RBr> RI. Этот эффект связан с их большей способностью усложнять Кислота Льюиса катализатор, и фактически уходящая группа представляет собой «съеденный» комплекс между кислотой Льюиса и уходящей уходящей группой.[4] Эта ситуация в широком смысле определяется как выход из группы активация
Все еще могут существовать контекстные различия в способности уходящей группы в чистом виде, то есть когда фактическая группа, которая уходит, не зависит от условий реакции (протонированием или комплексообразованием с кислотой Льюиса). и уход уходящей группы происходит на этапе определения скорости. В ситуации, когда другие переменные остаются постоянными (природа алкилэлектрофила, растворитель и т.д.), изменение нуклеофила может привести к изменению порядка реакционной способности уходящих групп. В приведенном ниже случае тозилат является лучшей уходящей группой, когда этоксид является нуклеофилом, но йодид и даже бромид становятся лучше уходящими группами в случае тиолат нуклеофил.[5]
| Выход из группы (X) | 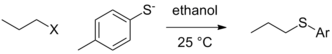 |  |
|---|---|---|
| Cl | 0.0074 | 0,0024 (при 40 ° С) |
| Br | 1 | 1 |
| я | 3.5 | 1.9 |
| OTs | 0.44 | 3.6 |
Активация
Это распространено в E1 и SN1 реакции для превращения плохой уходящей группы в хорошую путем протонирования или комплексообразования с Кислота Льюиса. Таким образом, именно за счет протонирования перед отлетом молекула может формально потерять такие плохо уходящие группы, как гидроксид.
Тот же принцип работает в Реакция Фриделя-Крафтса. Здесь сильная кислота Льюиса необходима для создания либо карбокатион из алкилгалогенида в реакции алкилирования Фриделя-Крафтса или ион ацилия из ацилгалогенида.

В подавляющем большинстве случаев реакции, которые включают активацию уходящей группы, генерируют катион на отдельной стадии перед нуклеофильной атакой или отщеплением. НапримерN1 и E1 могут включать стадию активации, тогда как SN2 и E2 реакции обычно нет.
В сопряженных основаниях исключения
Требование хорошей уходящей группы ослабляется в реакциях отщепления конъюгированных оснований. Эти реакции включают потерю уходящей группы в β-положении энолировать а также регенерация карбонильной группы из тетраэдрического промежуточного соединения при нуклеофильном ацильном замещении. В условиях принудительного воздействия даже амиды могут подвергаться основному гидролизу, процессу, который включает вытеснение крайне плохой уходящей группы R2N−. Еще более драматично декарбоксилирование бензоат анионы может происходить при нагревании медь или Cu2O, включая потерю ариланиона. Этой реакции способствует тот факт, что уходящая группа, скорее всего, представляет собой соединение арилмеди, а не гораздо более основную соль щелочного металла.
Это резкое отклонение от нормальных требований уходящей группы происходит в основном в области образования двойной связи C = O, где образование очень прочной двойной связи C = O может привести к развитию неблагоприятных в противном случае реакций. Требование хорошей уходящей группы по-прежнему ослаблено в случае образования связи C = C. через E1cB, но из-за относительной слабости двойной связи C = C реакция все еще проявляет некоторую чувствительность к уходящей группе. Примечательно, что изменение идентичности уходящей группы (и готовности уйти) может изменить природу механизма в реакциях элиминации. При плохих уходящих группах механизм E1cB предпочтителен, но по мере изменения способности уходящей группы реакция смещается от скорости, определяющей потерю уходящей группы из карбанионного промежуточного соединения. B через TS BC‡ за счет наличия шага депротонирования, определяющего скорость через TS AB‡ (не изображено) к согласованному устранению E2. В последней ситуации уходящая группа X стала достаточно хорошей, чтобы первое переходное состояние, соединяющее промежуточные звенья B и C стал ниже по энергии, чем B, которая больше не является стационарной точкой на поверхности потенциальной энергии для реакции. Потому что только одно переходное состояние связывает исходный материал А и продукт C, реакция теперь согласованная (хотя и очень асинхронная в изображенном случае) из-за увеличения способности X покидать группу.


"Супер" и "гипер" уходящие группы
Типичная супер-уходящая группа - это тройной, и этот термин стал обозначать любую уходящую группу сопоставимых способностей. Соединения, в которых потеря супер уходящей группы может привести к образованию стабильного карбокатиона, обычно очень реактивны и нестабильны. Таким образом, наиболее часто встречающиеся органические трифлаты - это метилтрифлат и алкенил- или арилтрифлаты, все из которых не могут образовывать стабильные карбокатионы при ионизации, что делает их относительно стабильными. Было отмечено, что стероидный алкил nonaflates (другая супер уходящая группа), образованная из спиртов и перфторбутансульфонилфторид не были изолированы как таковые, но сразу образовали продукты устранение или же замена к фторид генерируется реагентом. Смешанные ацил-трифторметансульфонилангидриды плавно подвергаются ацилированию по Фриделю-Крафтсу без катализатора,[6] в отличие от соответствующих ацилгалогенидов, для которых требуется сильная кислота Льюиса. Однако метилтрифлат не участвует в реакциях алкилирования Фриделя-Крафтса электронно-нейтральными ароматическими кольцами.
Помимо супер уходящих групп в реакционной способности находятся «гипер» уходящие группы. Среди них выделяются λ3-йоданы, которые включают соли диарилйодония и другие ионы галония. В одном исследовании было проведено количественное сравнение этих и других уходящих групп. По отношению к хлориду (krel= 1) реакционная способность увеличивается в порядке бромида (krel= 14), иодид (krel= 91), тозилат (krel= 3,7 х 104), трифлат (krel= 1,4 х 108), тетрафторборат фенилиодония (PhI+ BF4−, krel= 1,2 х 1014). Наряду с критерием того, что гипер уходящая группа является более сильной уходящей группой, чем трифлат, является необходимость того, чтобы уходящая группа подвергалась восстановительному удалению. В случае ионов галония это включает восстановление от трехвалентного галония до одновалентного галогенида в сочетании с высвобождением анионного фрагмента. Отчасти исключительная реакционная способность соединений гипер уходящих групп приписывается энтропийный преимущество разделения одной молекулы на три.

Ионы диалкилгалогония также были выделены и охарактеризованы для простых алкильных групп. Эти соединения, несмотря на их крайнюю реакционную способность по отношению к нуклеофилам, могут быть получены в чистом виде в твердом состоянии с очень слабонуклеофильными противоионами, такими как SbF.-
6[7][8] и CHB11Cl11−.[9] Сильно электрофильная природа этих соединений, обусловленная их присоединением к чрезвычайно лабильным уходящим группам R-X (R = алкил, X = Cl, Br, I), иллюстрируется их склонностью к алкилированию очень слабых нуклеофилов. Нагревание чистых образцов (CH3)2Cl+ [CHB11Cl11]− при пониженном давлении приводило к метилированию очень слабонуклеофильного карборан-аниона с сопутствующим изгнанием CH3Cl уходящая группа. Соли гексафторантимоната диалкилгалогения алкилируют избыток алкилгалогенидов с образованием продуктов обмена. Их сильно электрофильная природа, наряду с нестабильностью первичных карбокатионов, образующихся в результате ионизации их алкильных групп, указывает на их возможное участие в химии алкилирования Фриделя-Крафтса.[7] Порядок увеличения лабильности этих уходящих групп равен R-I Смотрите также
Рекомендации
