PDK2 - PDK2
Изоформа 2 пируватдегидрогеназы киназы (PDK2), также известный как пируватдегидрогеназа липоамидкиназа изофермент 2, митохондриальный является фермент что у людей кодируется PDK2 ген.[5][6] PDK2 - это изофермент из киназа пируватдегидрогеназы.
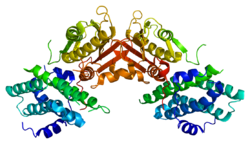
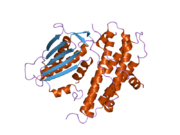
Структура
Белок, кодируемый геном PDK2, имеет два сайта: активный сайт и аллостерический сайт которые позволяют активность и регулирование этого фермента. Есть много структурных мотивов, которые важны для регуляции этого фермента. Ингибиторы Nov3r и AZ12 связываются в липоамид сайт связывания, расположенный на одном конце домена R. Pfz3 связывается в расширенном сайте на другом конце домена R. Один ингибитор, дихолорацетат (DCA) связывается в центре домена R.[7] Внутри активного сайта есть три аминокислотных остатка, R250, T302 и Y320, которые делают киназу устойчивой к ингибитору дихлорацетату, который отделяет активный сайт от аллостерического сайта. Это подтверждает теорию о том, что R250, T302 и Y320 стабилизируют «открытую» и «закрытую» конформации встроенной крышки, которая контролирует доступ нуклеотида в полость для связывания нуклеотидов. Это убедительно свидетельствует о том, что подвижность крышки АТФ является центральной для аллостерической регуляции активности PDHK2, служащей конформационным переключателем, необходимым для связи между активным сайтом и аллостерическими сайтами в молекуле киназы.[8] Существует также DW-мотив, который играет решающую роль в обеспечении связи сайтов связывания DCA, нуклеотидов и липоильных доменов. Эта сеть отвечает за отображение PDK2 в закрытом или неактивном состоянии.[9]
Функция
Комплекс пируватдегидрогеназы (ПДГ) должен строго регулироваться из-за его центральной роли в общем метаболизме. Внутри комплекса есть три остатка серина на компоненте E1, которые являются сайтами фосфорилирования; это фосфорилирование инактивирует комплекс. У людей было четыре изоферменты пируватдегидрогеназной киназы, которые, как было показано, фосфорилируют эти три сайта: PDK1, PDK2, PDK3, и PDK4.[10] PDK2 был определен как самый распространенный изоформа в тканях человека. Во многих исследованиях было ясно, что активность этого фермента необходима даже в состоянии покоя для регулирования гликолиз /карбидратное окисление и производство метаболитов для окислительного фосфорилирования и электронная транспортная цепь. Эти исследования продемонстрировали, что кинетика популяции изоформ PDK, в частности PDK2, более важна для определения активности PDH, чем измерение активности PDK.[11]
Регулирование
Семейство пируватдегидрогеназ, являющееся первичными регуляторами решающего этапа центрального метаболического пути, жестко регулируется множеством факторов. Активность PDK2 регулируется низким уровнем перекиси водорода; это происходит потому, что соединение временно окисляет цистеиновые остатки 45 и 392 на ферменте, что приводит к неактивному PDK2 и большей активности PDH. Эти условия также деактивируют Цикл TCA, следующий шаг в аэробного дыхания. Это намекает на тот факт, что при высоком уровне O2 производство в митохондрии, что может произойти из-за избытка питательных веществ, увеличение продуктов служит негативный отзыв которые контролируют метаболизм митохондрий.[12]PDK2 в сочетании с PDK3 и PDK4 являются основными целями Дельта рецептора, активируемого пролифератором пероксисом или бета, с PDK2, имеющим два элемента, которые отвечают на эти рецепторы.[13]
Клиническое значение
Все изоферменты пируватдегидрогеназы были связаны с различными метаболическими нарушениями, включая сахарный диабет. Это связано с механизмом, с помощью которого постоянно повышается свободная жирная кислота уровни стимулируют ферменты PDK, особенно PDK2 и PDK4 в печени. При стимуляции этой активности происходит меньшая активность ПДГ и, следовательно, меньшее поглощение глюкозы.[14]
Рак
Поскольку ферменты PDK связаны с центральным метаболизмом и ростом, они часто связаны с различными механизмами прогрессирования рака. Повышенная активность PDK2 приводит к увеличению гликолиз и производство молочной кислоты, известный как Эффект варбурга. В некоторых исследованиях опухолевый белок дикого типа p53 предотвращает проявление туморогенез регулируя активность PDK2.[15]Кроме того, ингибирование PDK2 впоследствии подавляет HIF1A в раковых клетках за счет как пролилгидроксилазы (PHD) -зависимого механизма, так и PHD-независимого механизма. Следовательно, метаболические модуляторы, нацеленные на митохондрии, увеличивают пируватдегидрогеназа активность и подавить ангиогенез а также нормализация псевдогипоксических сигналов, которые приводят к нормоксической активации HIF1A в солидные опухоли.[16]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000005882 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000038967 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Гуди Р., Боукер-Кинли М.М., Кедишвили Н.Ю., Чжао Ю., Попов К.М. (декабрь 1995 г.). «Разнообразие семейства генов киназы пируватдегидрогеназы у людей». Журнал биологической химии. 270 (48): 28989–94. Дои:10.1074 / jbc.270.48.28989. PMID 7499431.
- ^ «Ген Entrez: киназа пируватдегидрогеназы PDK2, изофермент 2».
- ^ Knoechel TR, Tucker AD, Robinson CM, Phillips C, Taylor W., Bungay PJ, Kasten SA, Roche TE, Brown DG (январь 2006 г.). «Регуляторные роли N-концевого домена на основе кристаллических структур киназы 2 пируватдегидрогеназы человека, содержащей физиологические и синтетические лиганды». Биохимия. 45 (2): 402–15. Дои:10.1021 / bi051402s. PMID 16401071.
- ^ Клюева А., Туганова А., Попов К.М. (август 2008 г.). «Аллостерическое сочетание в киназе 2 пируватдегидрогеназы». Биохимия. 47 (32): 8358–66. Дои:10.1021 / bi800631h. ЧВК 2568900. PMID 18627174.
- ^ Ли Дж., Като М., Чуанг Д. Т. (декабрь 2009 г.). «Ключевая роль С-концевого DW-мотива в опосредовании ингибирования киназы 2 пируватдегидрогеназы дихлорацетатом». Журнал биологической химии. 284 (49): 34458–67. Дои:10.1074 / jbc.M109.065557. ЧВК 2797213. PMID 19833728.
- ^ Колобова Е., Туганова А., Булатников И., Попов К.М. (август 2001 г.). «Регулирование активности пируватдегидрогеназы посредством фосфорилирования по нескольким сайтам». Биохимический журнал. 358 (Пт 1): 69–77. Дои:10.1042/0264-6021:3580069. ЧВК 1222033. PMID 11485553.
- ^ Данфорд Е.С., Хербст Е.А., Джунг Н.Х., Гиттингс В., Инглис Дж. Г., Ванденбум Р., Леблан П.Дж., Харрис Р.А., Питерс С.Дж. (июнь 2011 г.). «Активация PDH во время мышечных сокращений in vitro у мышей с нокаутом PDH-киназы 2: эффект компенсации PDH-киназы 1». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология. 300 (6): Р1487-93. Дои:10.1152 / ajpregu.00498.2010. PMID 21411764.
- ^ Херд, TR; Коллинз, Ю. Абакумова, я; Chouchani, ET; Барановский, Б; Фернли, И. М.; Prime, TA; Мерфи, депутат; Джеймс, AM (12 октября 2012 г.). «Инактивация киназы 2 пируватдегидрогеназы митохондриальными реактивными формами кислорода». Журнал биологической химии. 287 (42): 35153–60. Дои:10.1074 / jbc.m112.400002. ЧВК 3471752. PMID 22910903.
- ^ Дегенхардт, Т; Сарамяки, А; Малинен, М. Рик, М; Вяйсянен, С; Хуотари, А; Herzig, KH; Müller, R; Карлберг, К. (14 сентября 2007 г.). «Три члена семейства генов киназы пируватдегидрогеназы человека являются прямыми мишенями бета / дельта рецептора, активируемого пролифератором пероксисом». Журнал молекулярной биологии. 372 (2): 341–55. Дои:10.1016 / j.jmb.2007.06.091. PMID 17669420.
- ^ Байотто, G; Мураками, Т; Нагасаки, М; Цинь, Б; Мацуо, Y; Maeda, K; Охаши, М; Oshida, Y; Сато, Y; Шимомура, Y (март 2006 г.). «Повышенная экспрессия киназ 2 и 4 пируватдегидрогеназы в печени у молодых и средних лет крыс Otsuka Long-Evans Tokushima Fatty: индукция повышенными уровнями свободных жирных кислот». Метаболизм: клинический и экспериментальный. 55 (3): 317–23. Дои:10.1016 / j.metabol.2005.09.014. PMID 16483874.
- ^ Подрядчик, Т; Харрис, CR (15 января 2012 г.). «p53 отрицательно регулирует транскрипцию киназы пируватдегидрогеназы Pdk2». Исследования рака. 72 (2): 560–7. Дои:10.1158 / 0008-5472.can-11-1215. PMID 22123926.
- ^ Сутендра, G; Dromparis, P; Киннэрд, А; Стенсон, TH; Haromy, A; Паркер, Дж. М.; Макмертри, MS; Michelakis, ED (28 марта 2013 г.). «Активация митохондрий путем ингибирования PDKII подавляет передачу сигналов HIF1a и ангиогенез при раке». Онкоген. 32 (13): 1638–50. Дои:10.1038 / onc.2012.198. PMID 22614004.
дальнейшее чтение
- Sugden MC, Holness MJ (май 2003 г.). «Последние достижения в механизмах, регулирующих окисление глюкозы на уровне пируватдегидрогеназного комплекса с помощью PDK». Американский журнал физиологии. Эндокринология и метаболизм. 284 (5): E855–62. Дои:10.1152 / ajpendo.00526.2002. PMID 12676647.
- Кобаяши Т., Коэн П. (апрель 1999 г.). «Активация регулируемой сывороткой и глюкокортикоидами протеинкиназы агонистами, активирующими фосфатидилинозитид-3-киназу, опосредуется 3-фосфоинозитид-зависимой протеинкиназой-1 (PDK1) и PDK2». Биохимический журнал. 339 (2): 319–28. Дои:10.1042/0264-6021:3390319. ЧВК 1220160. PMID 10191262.
- Gold MR, Scheid MP, Santos L, Dang-Lawson M, Roth RA, Matsuuchi L, Duronio V, Krebs DL (август 1999). «Рецептор B-клеточного антигена активирует путь передачи сигналов Akt (протеинкиназа B) / гликоген-синтаза-киназа-3 через фосфатидилинозитол-3-киназу». Журнал иммунологии. 163 (4): 1894–905. PMID 10438924.
- Бейкер Дж. К., Ян Х, Пэн Т., Кастен С., Рош Т. Е. (май 2000 г.). «Заметные различия между двумя изоформами киназы пируватдегидрогеназы человека». Журнал биологической химии. 275 (21): 15773–81. Дои:10.1074 / jbc.M909488199. PMID 10748134.
- Стейсси К.Н., Попов К.М., Боукер-Кинли М.М., Слоан Р.А., Харрис Р.А., Гамильтон Дж. А. (октябрь 2001 г.). «Структура киназы пируватдегидрогеназы. Новый паттерн сворачивания сериновой протеинкиназы». Журнал биологической химии. 276 (40): 37443–50. Дои:10.1074 / jbc.M104285200. ЧВК 2147663. PMID 11483605.
- Колобова Е., Туганова А., Булатников И., Попов К.М. (август 2001 г.). «Регулирование активности пируватдегидрогеназы посредством фосфорилирования по нескольким сайтам». Биохимический журнал. 358 (Пт 1): 69–77. Дои:10.1042/0264-6021:3580069. ЧВК 1222033. PMID 11485553.
- Короткина Л.Г., Пател М.С. (октябрь 2001 г.). «Сайт-специфичность четырех изоферментов киназы пируватдегидрогеназы по отношению к трем сайтам фосфорилирования пируватдегидрогеназы человека». Журнал биологической химии. 276 (40): 37223–9. Дои:10.1074 / jbc.M103069200. PMID 11486000.
- Питерс С.Дж., Харрис Р.А., Ву П., Пехлеман Т.Л., Хейгенхаузер Г.Дж., Spriet LL (декабрь 2001 г.). «Активность киназы ПДГ в скелетных мышцах человека и экспрессия изоформ во время 3-дневной диеты с высоким содержанием жиров / низким содержанием углеводов». Американский журнал физиологии. Эндокринология и метаболизм. 281 (6): E1151–8. Дои:10.1152 / ajpendo.2001.281.6.e1151. PMID 11701428.
- Туганова А., Булатников И., Попов К.М. (август 2002 г.). «Взаимодействие между отдельными изоферментами киназы пируватдегидрогеназы и внутренним липоилсодержащим доменом трансацетилазного компонента пируватдегидрогеназного комплекса». Биохимический журнал. 366 (Пт 1): 129–36. Дои:10.1042 / BJ20020301. ЧВК 1222743. PMID 11978179.
- Булатников И., Попов К.М. (фев 2003). «Образование функциональных гетеродимеров изоферментами 1 и 2 киназы пируватдегидрогеназы». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1645 (2): 183–92. Дои:10.1016 / S1570-9639 (02) 00542-3. PMID 12573248.
- Хиромаса Y, Roche TE (сентябрь 2003 г.). «Облегченное взаимодействие между изоформой 2 киназы пируватдегидрогеназы и дигидролипоилацетилтрансферазой». Журнал биологической химии. 278 (36): 33681–93. Дои:10.1074 / jbc.M212733200. PMID 12816949.
- Ватт MJ, Heigenhauser GJ, LeBlanc PJ, Inglis JG, Spriet LL, Peters SJ (октябрь 2004 г.). «Быстрое повышение активности киназы пируватдегидрогеназы в скелетных мышцах человека во время длительных упражнений». Журнал прикладной физиологии. 97 (4): 1261–7. Дои:10.1152 / japplphysiol.00132.2004. PMID 15169745.
- Бао Х., Кастен С.А., Ян Х, Рош Т.Э. (октябрь 2004 г.). «Активность изоформы 2 пируватдегидрогеназы киназы ограничена и дополнительно ингибируется за счет замедления скорости диссоциации АДФ». Биохимия. 43 (42): 13432–41. Дои:10.1021 / bi049488x. PMID 15491150.
- Бао Х., Кастен С.А., Ян Х, Хиромаса Й., Рош Т.Э. (октябрь 2004 г.). «Активность изоформы 2 киназы пируватдегидрогеназы, стимулированная увеличением скорости диссоциации АДФ». Биохимия. 43 (42): 13442–51. Дои:10.1021 / bi0494875. PMID 15491151.
- Эббот Э.Л., Маккормак Дж. Г., Рейнет К., Хассалл Д. Г., Бьюкен К. В., Йеман С. Дж. (Июнь 2005 г.). «Дивергирующая регуляция экспрессии гена изоформы киназы пируватдегидрогеназы в культивируемых мышечных клетках человека». Журнал FEBS. 272 (12): 3004–14. Дои:10.1111 / j.1742-4658.2005.04713.x. PMID 15955060. S2CID 21366281.