Окислительного фосфорилирования - Oxidative phosphorylation
Окислительного фосфорилирования (ВЕЛИКОБРИТАНИЯ /ɒkˈsɪd.ə.тɪv/, НАС /ˈɑːk.sɪˌdeɪ.тɪv/ [1] или же электронно-транспортное фосфорилирование) это метаболический путь в котором клетки использовать ферменты к окислять питательные вещества, тем самым высвобождая химическую энергию, хранящуюся внутри, для производства аденозинтрифосфат (АТФ). В большинстве эукариоты, это происходит внутри митохондрии. Почти все аэробные организмы проводят окислительное фосфорилирование. Этот путь настолько распространен, потому что энергия двойной связи кислород намного выше, чем энергия двойной связи в диоксиде углерода или в парах одинарных связей в органических молекулах[2] наблюдается в качестве альтернативы ферментация такие процессы как анаэробный гликолиз.
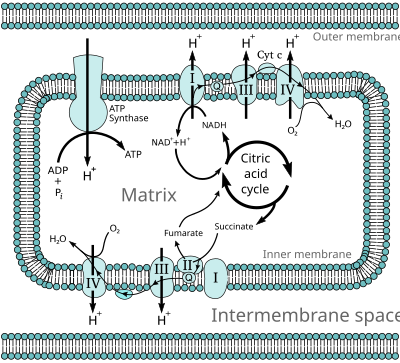
Во время окислительного фосфорилирования электроны переносятся из доноры электронов к акцепторы электронов например кислород в окислительно-восстановительные реакции. Эти окислительно-восстановительные реакции высвобождают энергию, запасенную в относительно слабой двойной связи O2, который используется для образования АТФ. В эукариоты, эти окислительно-восстановительные реакции катализируются серией белковые комплексы внутри внутренней мембраны митохондрий клетки, тогда как в прокариоты эти белки расположены в межмембранном пространстве клетки. Эти связанные наборы белков называются цепи переноса электронов. У эукариот задействовано пять основных белковых комплексов, тогда как у прокариот присутствует множество различных ферментов, использующих различные доноры и акцепторы электронов.
Энергия, передаваемая электронами, протекающими через эту цепь переноса электронов, используется для переноса протоны через внутренняя митохондриальная мембрана, в процессе, называемом электронный транспорт. Это порождает потенциальная энергия в виде pH градиент и электрический потенциал через эту мембрану. Этот запас энергии используется, когда протоны текут обратно через мембрану и спускаются вниз по градиенту потенциальной энергии через большой фермент, называемый АТФ-синтаза; этот процесс известен как хемиосмос. Синтаза АТФ использует энергию для преобразования аденозиндифосфат (АДФ) в аденозинтрифосфат, в фосфорилирование реакция. Реакция запускается потоком протонов, который заставляет вращение части фермента; АТФ-синтаза - это вращающийся механический двигатель.
Хотя окислительное фосфорилирование является жизненно важной частью метаболизма, оно производит активные формы кислорода Такие как супероксид и пероксид водорода, которые приводят к размножению свободные радикалы, повреждая клетки и способствуя болезнь и, возможно, старение (старение ). Ферменты, осуществляющие этот метаболический путь, также являются мишенью для многих лекарств и ядов, которые подавлять их деятельность.
Это конечный процесс клеточное дыхание у эукариот и обеспечивает высокий выход АТФ.
Хемиосмос
Окислительное фосфорилирование работает с использованием энергия -выпускание химических реакций для запуска реакций, требующих энергии: говорят, что эти два набора реакций соединенный. Это означает, что одно не может происходить без другого. Цепочка окислительно-восстановительных реакций, управляющая потоком электронов через цепь переноса электронов от доноров электронов, таких как НАДН к акцепторы электронов Такие как кислород и водород (протоны),[2] является экзергонический процесс - он высвобождает энергию, тогда как синтез АТФ является эндергонический процесс, требующий затрат энергии. И цепь переноса электронов, и синтаза АТФ встроены в мембрану, и энергия передается от цепи переноса электронов к синтазе путем перемещения протонов через эту мембрану в процессе, называемом хемиосмос.[3] Ток протонов перемещается от отрицательной N-стороны мембраны к положительной P-стороне через ферменты, перекачивающие протоны в цепи переноса электронов. Движение протонов создает электрохимический градиент через мембрану, которую часто называют протонодвижущая сила. Он состоит из двух компонентов: разница в концентрации протонов (H+ градиент, ΔpH ) и разница в электрический потенциал, с отрицательным зарядом на N-стороне.[4]
АТФ-синтаза высвобождает эту накопленную энергию, замыкая цепь и позволяя протонам течь вниз по электрохимическому градиенту обратно к N-стороне мембраны.[5] Электрохимический градиент управляет вращением части структуры фермента и связывает это движение с синтезом АТФ.
Две составляющие протонно-движущей силы: термодинамически эквивалент: в митохондриях большая часть энергии обеспечивается потенциалом; в алкалифил бактерии, электрическая энергия даже должна компенсировать противодействующую обратную разницу pH. Обратно, хлоропласты работают в основном на ΔpH. Однако они также требуют небольшого мембранного потенциала для кинетики синтеза АТФ. В случае фузобактерии Propionigenium modestum он приводит в движение встречное вращение субъединиц а и с FО мотор АТФ-синтазы.[4]
Количество энергии, выделяемой при окислительном фосфорилировании, велико по сравнению с количеством, производимым анаэробная ферментация, из-за высокой энергии O2.[2] Гликолиз производит только 2 молекулы АТФ, но где-то от 30 до 36 АТФ продуцируются окислительным фосфорилированием 10 молекул НАДН и 2 молекул сукцината, образованных преобразованием одной молекулы глюкоза в углекислый газ и воду,[6] в то время как каждый цикл бета-окисление из жирная кислота дает около 14 АТФ. Эти выходы АТФ являются теоретическими максимальными значениями; на практике некоторые протоны проникают через мембрану, снижая выход АТФ.[7]
Молекулы переноса электронов и протонов
Цепь переноса электронов переносит как протоны, так и электроны, передавая электроны от доноров к акцепторам и перенося протоны через мембрану. В этих процессах используются как растворимые, так и связанные с белками переносящие молекулы. В митохондриях электроны переносятся в межмембранном пространстве с помощью воды.растворимый белок переноса электрона цитохром с.[8] Он переносит только электроны, которые переносятся путем восстановления и окисления утюг атом, который белок удерживает в гем группа по своему составу. Цитохром c также обнаружен у некоторых бактерий, где он находится в периплазматическое пространство.[9]
Внутри внутренней митохондриальной мембраны липид -растворимый переносчик электронов Коэнзим Q10 (Q) переносит электроны и протоны на редокс цикл.[10] Этот маленький бензохинон молекула очень гидрофобный, поэтому он свободно распространяется внутри мембраны. Когда Q принимает два электрона и два протона, он сводится к убихинол форма (QH2); когда QH2 высвобождает два электрона и два протона, он снова окисляется до убихинон (Q) форма. В результате, если два фермента расположены так, что Q уменьшается на одной стороне мембраны и QH2 окисленный с другой стороны, убихинон будет связывать эти реакции и перемещать протоны через мембрану.[11] Некоторые бактериальные цепи переноса электронов используют разные хиноны, такие как менахинон, помимо убихинона.[12]
Внутри белков электроны переносятся между флавин кофакторы,[5][13] железо-серные кластеры и цитохромы. Существует несколько типов железо-серного кластера. Самый простой вид цепи переноса электрона состоит из двух атомов железа, соединенных двумя атомами неорганического сера; они называются кластерами [2Fe – 2S]. Второй вид, названный [4Fe – 4S], содержит куб из четырех атомов железа и четырех атомов серы. Каждый атом железа в этих кластерах координируется дополнительным аминокислота, обычно атомом серы цистеин. Кофакторы ионов металлов подвергаются окислительно-восстановительным реакциям без связывания или высвобождения протонов, поэтому в цепи переноса электронов они служат исключительно для переноса электронов через белки. Электроны перемещаются через белки на довольно большие расстояния, прыгая по цепочкам этих кофакторов.[14] Это происходит квантовое туннелирование, который быстро проходит на расстояниях менее 1,4×10−9 м.[15]
Цепи транспорта электронов эукариот
Много катаболический биохимические процессы, такие как гликолиз, то цикл лимонной кислоты, и бета-окисление, производят сокращенные кофактор НАДН. Этот кофермент содержит электроны с высоким потенциал передачи; Другими словами, они выделяют большое количество энергии при окислении. Однако клетка не выделяет эту энергию сразу, поскольку это была бы неконтролируемая реакция. Вместо этого электроны удаляются из НАДН и передаются кислороду через ряд ферментов, каждый из которых выделяет небольшое количество энергии. Этот набор ферментов, состоящий из комплексов с I по IV, называется цепью переноса электронов и находится во внутренней мембране митохондрии. Сукцинат также окисляется цепью переноса электронов, но попадает в путь в другой точке.
В эукариоты, ферменты в этой системе переноса электронов используют энергию, выделяемую O2 НАДН для накачки протоны через внутреннюю мембрану митохондрии. Это заставляет протоны накапливаться в межмембранное пространство, и генерирует электрохимический градиент через мембрану. Энергия, запасенная в этом потенциале, затем используется АТФ-синтазой для производства АТФ. Окислительное фосфорилирование в митохондриях эукариот является наиболее понятным примером этого процесса. Митохондрии присутствуют почти у всех эукариот, за исключением анаэробных простейших, таких как Влагалищная трихомонада которые вместо этого восстанавливают протоны до водорода в остаточной митохондрии, называемой гидрогеносома.[16]
| Респираторный фермент | Редокс пара | Потенциал средней точки (Вольт) |
|---|---|---|
| НАДН-дегидрогеназа | НАД+ / НАДН | −0.32[17] |
| Сукцинатдегидрогеназа | FMN или же FAD / FMNH2 или FADH2 | −0.20[17] |
| Цитохром bc1 сложный | Коэнзим Q10бык / Коэнзим Q10красный | +0.06[17] |
| Цитохром bc1 сложный | Цитохром bбык / Цитохром bкрасный | +0.12[17] |
| Комплекс IV | Цитохром сбык / Цитохром скрасный | +0.22[17] |
| Комплекс IV | Цитохром абык / Цитохром акрасный | +0.29[17] |
| Комплекс IV | О2 / HO− | +0.82[17] |
| Условия: pH = 7[17] | ||
НАДН-кофермент Q оксидоредуктаза (комплекс I)

НАДН-кофермент Q оксидоредуктаза, также известный как НАДН-дегидрогеназа или же комплекс I, является первым белком в цепи переноса электронов.[18] Комплекс I - гигант фермент с комплексом млекопитающих I, состоящим из 46 субъединиц и молекулярной массой около 1000 килодальтон (кДа).[19] Подробно строение известно только от бактерии;[20][21] у большинства организмов комплекс напоминает сапог с большим «шаром», торчащим из мембраны в митохондрию.[22][23] Гены, кодирующие отдельные белки, содержатся как в ядро клетки и митохондриальный геном, как и в случае со многими ферментами, присутствующими в митохондриях.
Реакция, катализируемая этим ферментом, представляет собой двухэлектронное окисление НАДН к Коэнзим Q10 или же убихинон (представлен как Q в уравнении ниже), жирорастворимый хинон который находится в мембране митохондрии:
(1)
Начало реакции, да и всей электронной цепи, - это связывание молекулы НАДН с комплексом I и передача двух электронов. Электроны входят в комплекс I через протезная группа пристроен к комплексу, флавинмононуклеотид (ФМН). Добавление электронов к FMN преобразует его в его восстановленную форму, FMNH.2. Затем электроны переносятся через серию железо-серные кластеры: второй вид протезной группы, присутствующей в комплексе.[20] В комплексе I присутствуют железо-серные кластеры как [2Fe – 2S], так и [4Fe – 4S].
Когда электроны проходят через этот комплекс, четыре протона перекачиваются из матрицы в межмембранное пространство. Неясно, как именно это происходит, но, похоже, это связано с конформационные изменения в комплексе I, который заставляет белок связывать протоны на N-стороне мембраны и высвобождать их на P-стороне мембраны.[24] Наконец, электроны передаются от цепочки кластеров железо-сера к молекуле убихинона в мембране.[18] Восстановление убихинона также способствует генерации протонного градиента, поскольку два протона захватываются из матрицы, когда она восстанавливается до убихинол (QH2).
Сукцинат-Q оксидоредуктаза (комплекс II)

Сукцинат-Q оксидоредуктаза, также известный как комплекс II или же сукцинатдегидрогеназа, является второй точкой входа в цепь переноса электронов.[25] Это необычно, потому что это единственный фермент, который является частью цикла лимонной кислоты и цепи переноса электронов. Комплекс II состоит из четырех белковых субъединиц и содержит связанный флавинаденин динуклеотид (FAD) кофактор, железо-серные кластеры и гем группа, которая не участвует в переносе электрона к коферменту Q, но считается важной для уменьшения образования активных форм кислорода.[26][27] Окисляет сукцинат к фумарат и снижает убихинон. Поскольку в этой реакции выделяется меньше энергии, чем при окислении НАДН, комплекс II не переносит протоны через мембрану и не способствует протонному градиенту.
(2)
У некоторых эукариот, таких как паразитический червь Ascaris suum, фермент, подобный комплексу II, фумаратредуктазе (менахинол: фумаратэоксидоредуктаза, или QFR), действует в обратном направлении, окисляя убихинол и восстанавливая фумарат. Это позволяет червю выжить в анаэробной среде толстая кишка, осуществляя анаэробное окислительное фосфорилирование с фумаратом в качестве акцептора электронов.[28] Другая необычная функция комплекса II видна в малярия паразит Плазмодий falciparum. Здесь обратное действие комплекса II как оксидазы важно для регенерации убихинола, который паразит использует в необычной форме пиримидин биосинтез.[29]
Электронный перенос оксидоредуктазы флавопротеин-Q
Электронный перенос флавопротеин-убихинон оксидоредуктаза (Оксидоредуктаза ETF-Q), также известная как электрон-переносчик-флавопротеиндегидрогеназа, является третьей точкой входа в цепь переноса электронов. Это фермент, который принимает электроны от электрон-переносящий флавопротеин в митохондриальном матриксе и использует эти электроны для восстановления убихинона.[30] Этот фермент содержит флавин и кластер [4Fe – 4S], но, в отличие от других респираторных комплексов, он прикрепляется к поверхности мембраны и не пересекает липидный бислой.[31]
(3)
У млекопитающих этот метаболический путь важен для бета-окисление из жирные кислоты и катаболизм аминокислоты и холин, поскольку он принимает электроны от нескольких ацетил-КоА дегидрогеназы.[32][33] У растений оксидоредуктаза ETF-Q также важна для метаболических реакций, которые позволяют выжить в продолжительные периоды темноты.[34]
Q-цитохром с оксидоредуктаза (комплекс III)

Q-цитохром с оксидоредуктаза также известен как цитохром с редуктаза, цитохром bc1 сложный, или просто комплекс III.[35][36] У млекопитающих этот фермент представляет собой димер, где каждый комплекс субъединиц содержит 11 белковых субъединиц, железо-серный кластер [2Fe-2S] и три цитохромы: один цитохром c1 и два б цитохромы.[37] Цитохром - это разновидность белка, переносящего электроны, который содержит как минимум один гем группа. Атомы железа внутри гемовых групп комплекса III чередуются между состоянием восстановленного двухвалентного железа (+2) и окисленного трехвалентного железа (+3) по мере того, как электроны переносятся через белок.
Реакция, катализируемая комплексом III, представляет собой окисление одной молекулы убихинол и восстановление двух молекул цитохром с, гемовый белок, слабо связанный с митохондрией. В отличие от кофермента Q, который несет два электрона, цитохром с несет только один электрон.
(4)
Поскольку только один из электронов может быть перенесен из QH2 донор акцептора цитохрома с за один раз, механизм реакции комплекса III более сложен, чем у других респираторных комплексов, и происходит в два этапа, называемых Q цикл.[38] На первом этапе фермент связывает три субстрата, первый - QH2, который затем окисляется, причем один электрон передается второму субстрату, цитохрому c. Два протона, выпущенные из QH2 переходят в межмембранное пространство. Третья подложка - Q, которая принимает второй электрон из QH.2 и сводится к Q.−, какой убисемихинон свободный радикал. Первые два субстрата высвобождаются, но этот промежуточный убисемихинон остается связанным. На втором этапе вторая молекула QH2 связывается и снова передает свой первый электрон акцептору цитохрома с. Второй электрон передается связанному убисемихинону, восстанавливая его до QH2 поскольку он получает два протона из митохондриального матрикса. Это QH2 затем высвобождается из фермента.[39]
Поскольку кофермент Q восстанавливается до убихинола на внутренней стороне мембраны и окисляется до убихинона на другой стороне, происходит чистый перенос протонов через мембрану, увеличивая протонный градиент.[5] Довольно сложный двухступенчатый механизм, с помощью которого это происходит, важен, поскольку он увеличивает эффективность переноса протона. Если вместо Q-цикла одна молекула QH2 были использованы для прямого восстановления двух молекул цитохрома с, эффективность будет уменьшена вдвое, с уменьшением только одного протона, переносимого на цитохром с.[5]
Цитохром с оксидаза (комплекс IV)

Цитохром с оксидаза, также известный как комплекс IV, является последним белковым комплексом в цепи переноса электронов.[40] Фермент млекопитающих имеет чрезвычайно сложную структуру и содержит 13 субъединиц, две гемовые группы, а также несколько кофакторов ионов металлов - всего три атома медь, один из магний и один из цинк.[41]
Этот фермент опосредует заключительную реакцию в цепи переноса электронов и переносит электроны на кислород и водород (протоны),[2] перекачивая протоны через мембрану.[42] Финал акцептор электронов кислород, который обеспечивает большую часть энергии, выделяемой в цепи переноса электронов, и его также называют терминальный акцептор электронов, на этом этапе превращается в воду, которая высвобождает половину всей энергии аэробного дыхания.[2] Как прямая накачка протонов, так и расход матричных протонов на восстановление кислорода вносят свой вклад в протонный градиент. Катализируется реакция окисления цитохрома с и восстановления кислорода:
(5)
Альтернативные редуктазы и оксидазы
Многие эукариотические организмы имеют цепи переноса электронов, которые отличаются от хорошо изученных ферментов млекопитающих, описанных выше. Например, растения имеют альтернативные НАДН-оксидазы, которые окисляют НАДН в цитозоле, а не в митохондриальном матриксе, и передают эти электроны в пул убихинона.[43] Эти ферменты не переносят протоны и, следовательно, восстанавливают убихинон без изменения электрохимического градиента через внутреннюю мембрану.[44]
Другим примером расходящейся цепи переноса электронов является альтернативная оксидаза, который находится в растения, а также некоторые грибы, протисты, и, возможно, некоторые животные.[45][46] Этот фермент передает электроны непосредственно от убихинола к кислороду.[47]
Пути переноса электронов, продуцируемые этими альтернативными НАДН и убихиноноксидазами, имеют более низкую АТФ урожаи, чем полный путь. Преимущества укороченного пути не совсем ясны. Однако альтернативная оксидаза вырабатывается в ответ на такие стрессы, как холод, активные формы кислорода, и заражение патогенами, а также другие факторы, которые ингибируют полную цепь переноса электронов.[48][49] Следовательно, альтернативные пути могут повышать сопротивляемость организмов травмам за счет уменьшения окислительный стресс.[50]
Организация комплексов
Первоначальная модель организации комплексов дыхательной цепи заключалась в том, что они свободно и независимо диффундируют в митохондриальной мембране.[51] Однако недавние данные предполагают, что комплексы могут образовывать структуры более высокого порядка, называемые суперкомплексами или "респирасомы ".[52] В этой модели различные комплексы существуют как организованные наборы взаимодействующих ферментов.[53] Эти ассоциации могут позволить каналу субстратов между различными ферментными комплексами, увеличивая скорость и эффективность переноса электронов.[54] В таких суперкомплексах млекопитающих некоторые компоненты будут присутствовать в более высоких количествах, чем другие, при этом некоторые данные предполагают соотношение между комплексами I / II / III / IV и АТФ-синтазой примерно 1: 1: 3: 7: 4.[55] Однако споры по поводу этой сверхкомплексной гипотезы полностью не разрешены, так как некоторые данные не соответствуют этой модели.[19][56]
Прокариотические цепи транспорта электронов
В отличие от общего сходства в структуре и функциях цепей переноса электронов у эукариот, бактерии и археи обладают большим разнообразием ферментов переноса электронов. Они используют в качестве субстратов столь же широкий набор химикатов.[57] Как и у эукариот, прокариотический перенос электронов использует энергию, высвобождаемую при окислении субстрата, для перекачки ионов через мембрану и создания электрохимического градиента. У бактерий окислительное фосфорилирование в кишечная палочка изучен наиболее подробно, в то время как архейные системы в настоящее время изучены плохо.[58]
Основное различие между окислительным фосфорилированием эукариот и прокариот заключается в том, что бактерии и археи используют множество различных веществ для передачи или приема электронов. Это позволяет прокариотам расти в самых разных условиях окружающей среды.[59] В Кишечная палочканапример, окислительное фосфорилирование может быть вызвано большим количеством пар восстанавливающих агентов и окислителей, которые перечислены ниже. В потенциал средней точки химического вещества измеряет, сколько энергии выделяется при его окислении или восстановлении, при этом восстанавливающие агенты имеют отрицательный потенциал, а окислители - положительный.
| Респираторный фермент | Редокс пара | Потенциал средней точки (Вольт) |
|---|---|---|
| Формиатдегидрогеназа | Бикарбонат / Форматировать | −0.43 |
| Гидрогеназа | Протон / Водород | −0.42 |
| НАДН-дегидрогеназа | НАД+ / НАДН | −0.32 |
| Глицерин-3-фосфатдегидрогеназа | DHAP / Гли-3-П | −0.19 |
| Пируватоксидаза | Ацетат + Углекислый газ / Пируват | ? |
| Лактатдегидрогеназа | Пируват / Лактат | −0.19 |
| D-аминокислотдегидрогеназа | 2-оксокислота + аммиак / D-аминокислота | ? |
| Глюкозодегидрогеназа | Глюконат / Глюкоза | −0.14 |
| Сукцинатдегидрогеназа | Фумарат / Сукцинат | +0.03 |
| Убихинолоксидаза | Кислород / Вода | +0.82 |
| Нитратредуктаза | Нитрат / Нитриты | +0.42 |
| Нитритредуктаза | Нитриты / Аммиак | +0.36 |
| Диметилсульфоксид редуктаза | ДМСО / DMS | +0.16 |
| Триметиламин N-оксид редуктаза | ТМАО / TMA | +0.13 |
| Фумарат редуктаза | Фумарат / Сукцинат | +0.03 |
Как показано выше, Кишечная палочка могут расти с восстановителями, такими как формиат, водород или лактат в качестве доноров электронов, и с нитратом, ДМСО или кислородом в качестве акцепторов.[59] Чем больше разница в средней точке потенциала между окислителем и восстановителем, тем больше энергии выделяется при их реакции. Из этих соединений пара сукцинат / фумарат необычна, поскольку ее потенциал в средней точке близок к нулю. Следовательно, сукцинат может быть окислен до фумарата, если доступен сильный окислитель, такой как кислород, или фумарат может быть восстановлен до сукцината с использованием сильного восстанавливающего агента, такого как формиат. Эти альтернативные реакции катализируются сукцинатдегидрогеназа и фумаратредуктаза, соответственно.[61]
Некоторые прокариоты используют окислительно-восстановительные пары, у которых есть лишь небольшая разница в средней точке потенциала. Например, нитрифицирующий бактерии, такие как Нитробактер окисляют нитрит до нитрата, отдавая электроны кислороду. Небольшого количества энергии, выделяющейся в этой реакции, достаточно для перекачки протонов и выработки АТФ, но недостаточно для производства НАДН или НАДФН непосредственно для использования в анаболизм.[62] Эта проблема решается с помощью нитрит оксидоредуктаза чтобы произвести достаточную протонно-движущую силу, чтобы запустить часть цепи переноса электронов в обратном направлении, заставляя комплекс I генерировать НАДН.[63][64]
Прокариоты контролируют использование этих доноров и акцепторов электронов, варьируя продуцируемые ферменты в зависимости от условий окружающей среды.[65] Такая гибкость возможна, потому что разные оксидазы и редуктазы используют один и тот же пул убихинона. Это позволяет множеству комбинаций ферментов функционировать вместе, связанных общим промежуточным продуктом убихинола.[60] Эти дыхательные цепи поэтому имеют Модульная конструкция, с легко заменяемыми наборами ферментных систем.
В дополнение к этому метаболическому разнообразию прокариоты также обладают рядом изоферменты - разные ферменты, катализирующие одну и ту же реакцию. Например, в Кишечная палочка, существует два разных типа убихинолоксидазы, использующей кислород в качестве акцептора электронов.В высокоаэробных условиях клетка использует оксидазу с низким сродством к кислороду, которая может переносить два протона на электрон. Однако, если уровень кислорода падает, они переключаются на оксидазу, которая переносит только один протон на электрон, но имеет высокое сродство к кислороду.[66]
АТФ-синтаза (комплекс V)
АТФ-синтаза, также называемая комплекс V, является последним ферментом в пути окислительного фосфорилирования. Этот фермент присутствует во всех формах жизни и действует одинаково как у прокариот, так и у эукариот.[67] Фермент использует энергию, запасенную в протонном градиенте через мембрану, чтобы управлять синтезом АТФ из АДФ и фосфат (Пя). Оценки количества протонов, необходимых для синтеза одного АТФ, варьируются от трех до четырех,[68][69] некоторые предполагают, что клетки могут изменять это соотношение, чтобы соответствовать различным условиям.[70]
(6)
Этот фосфорилирование реакция - это равновесие, который можно сдвинуть, изменив протонодвижущую силу. В отсутствие протонодвижущей силы реакция АТФ-синтазы будет протекать справа налево, гидролизуя АТФ и выкачивая протоны из матрицы через мембрану. Однако, когда протонодвижущая сила высока, реакция вынуждена идти в противоположном направлении; он проходит слева направо, позволяя протонам течь вниз по градиенту их концентрации и превращая АДФ в АТФ.[67] Действительно, в тесно связанных H + -АТФазы вакуолярного типа, реакция гидролиза используется для подкисления клеточных компартментов путем перекачки протонов и гидролиза АТФ.[71]
АТФ-синтаза представляет собой массивный белковый комплекс грибовидной формы. Ферментный комплекс млекопитающих состоит из 16 субъединиц и имеет массу примерно 600 килодальтон.[72] Часть, встроенная в мембрану, называется FО и содержит кольцо c субъединиц и протонный канал. Стебель и шарообразный головной убор называется F1 и является местом синтеза АТФ. Шаровидный комплекс в конце F1 Часть содержит шесть белков двух разных типов (три субъединицы α и три субъединицы β), тогда как «стебель» состоит из одного белка: субъединицы γ, причем кончик ножки простирается в клубок из субъединиц α и β.[73] Обе субъединицы α и β связывают нуклеотиды, но только субъединицы β катализируют реакцию синтеза АТФ. Достигая стороны F1 Часть и обратно в мембрану представляет собой длинную палочковидную субъединицу, которая прикрепляет субъединицы α и β к основанию фермента.
Когда протоны пересекают мембрану через канал в основании АТФ-синтазы, FО двигатель, управляемый протонами, вращается.[74] Поворот может быть вызван изменениями в ионизация аминокислот в кольце субъединиц с, вызывающих электростатический взаимодействия, которые продвигают кольцо субъединиц c мимо протонного канала.[75] Это вращающееся кольцо, в свою очередь, приводит во вращение центральный ось (стебель субъединицы γ) внутри субъединиц α и β. Субъединицы α и β не могут вращаться сами по себе боковым плечом, которое действует как статор. Это движение кончика субъединицы γ внутри шара из субъединиц α и β обеспечивает энергию для активных сайтов субъединиц β, чтобы они могли совершить цикл движений, которые производят, а затем высвобождают АТФ.[76]

Эта реакция синтеза АТФ называется механизм изменения привязки и включает в себя активный сайт субъединицы β, циклический переход между тремя состояниями.[77] В «открытом» состоянии АДФ и фосфат попадают в активный центр (показан коричневым на схеме). Затем белок замыкается вокруг молекул и свободно связывает их - «рыхлое» состояние (показано красным). Затем фермент снова меняет форму и заставляет эти молекулы вместе, при этом активный центр в результирующем «плотном» состоянии (показано розовым цветом) связывает вновь образованную молекулу АТФ с очень высокой близость. Наконец, активный сайт возвращается в открытое состояние, высвобождая АТФ и связывая больше АДФ и фосфата, готовые к следующему циклу.
У некоторых бактерий и архей синтез АТФ обусловлен движением ионов натрия через клеточную мембрану, а не движением протонов.[78][79] Археи, такие как Метанококк также содержат A1Ао синтаза, форма фермента, которая содержит дополнительные белки с небольшим сходством по последовательности с другими бактериальными и эукариотическими субъединицами АТФ-синтазы. Возможно, что у некоторых видов A1Ао форма фермента - специализированная АТФ-синтаза, управляемая натрием,[80] но это может быть не во всех случаях.[79]
Окислительное фосфорилирование - энергетика
Энергия, выделяемая при окислительном фосфорилировании, в основном может быть связана с O2 с его относительно слабой двойной связью.[2] Транспорт электронов от окислительно-восстановительной пары НАД+/ НАДН к конечной редокс-паре 1/2 O2/ H2O можно резюмировать как
1/2 O2 + НАДН + Н+ → H2O + NAD+
Разность потенциалов между этими двумя окислительно-восстановительными парами составляет 1,14 В, что эквивалентно -52 ккал / моль или -2600 кДж на 6 моль O.2.
Когда один НАДН окисляется через цепь переноса электрона, образуются три АТФ, что эквивалентно 7,3 ккал / моль x 3 = 21,9 ккал / моль.
Сохранение энергии можно рассчитать по следующей формуле
КПД = (21,9 х 100%) / 52 = 42%
Таким образом, мы можем сделать вывод, что когда НАДН окисляется, около 42% энергии сохраняется в виде трех АТФ, а оставшаяся (58%) энергия теряется в виде тепла (если химическая энергия АТФ в физиологических условиях не была недооценена).
Активные формы кислорода
Молекулярный кислород - идеальный терминал акцептор электронов потому что это сильный окислитель. Восстановление кислорода действительно связано с потенциально вредными промежуточными продуктами.[81] Хотя перенос четырех электронов и четырех протонов восстанавливает кислород до воды, что безвредно, перенос одного или двух электронов производит супероксид или же перекись анионы, которые обладают опасной реакционной способностью.
(7)
Эти активные формы кислорода и продукты их реакции, такие как гидроксил радикалы, очень вредны для клеток, так как окисляют белки и вызывают мутации в ДНК. Это клеточное повреждение может способствовать болезнь и предлагается как одна из причин старение.[82][83]
Комплекс цитохром-с-оксидазы очень эффективен при восстановлении кислорода до воды и высвобождает очень мало частично восстановленных промежуточных продуктов; однако небольшие количества супероксид-аниона и пероксида производятся в цепи переноса электронов.[84] Особенно важно снижение коэнзим Q в комплексе III в виде высокореактивного свободного радикала убисемихинона образуется промежуточный продукт в Q-цикле. Этот нестабильный вид может привести к «утечке» электронов, когда электроны переходят непосредственно к кислороду, образуя супероксид.[85] Поскольку производство активных форм кислорода этими комплексами, перекачивающими протоны, является наибольшим при высоких мембранных потенциалах, было предложено, чтобы митохондрии регулировали их активность для поддержания мембранного потенциала в узком диапазоне, который уравновешивает выработку АТФ с образованием окислителя.[86] Например, окислители могут активировать разобщение белков снижающие мембранный потенциал.[87]
Чтобы противодействовать этим реактивным формам кислорода, клетки содержат множество антиоксидант системы, в том числе антиоксидантные витамины Такие как Витамин С и витамин Е и антиоксидантные ферменты, такие как супероксиддисмутаза, каталаза, и пероксидазы,[81] которые детоксифицируют реактивные виды, ограничивая повреждение клетки.
Окислительное фосфорилирование в условиях гипоксии
В качестве кислород является фундаментальным для окислительного фосфорилирования, нехватка O2 уровень, вероятно, изменяет скорость производства АТФ. Однако движущая сила протонов и продукция АТФ могут поддерживаться внутриклеточным ацидозом.[88] Цитозольные протоны, накопившиеся при гидролизе АТФ и лактоацидоз могут свободно диффундировать через внешнюю мембрану митохондрий и подкислять межмембранное пространство, тем самым внося непосредственный вклад в движущую силу протонов и производство АТФ.
Ингибиторы
Есть несколько известных наркотики и токсины которые ингибируют окислительное фосфорилирование. Хотя любой из этих токсинов ингибирует только один фермент в цепи переноса электронов, ингибирование любой стадии в этом процессе остановит остальную часть процесса. Например, если олигомицин ингибирует АТФ-синтазу, протоны не могут пройти обратно в митохондрии.[89] В результате протонные насосы не могут работать, поскольку градиент становится слишком сильным для их преодоления. Таким образом, НАДН больше не окисляется, и цикл лимонной кислоты прекращается, потому что концентрация НАД+ падает ниже концентрации, которую могут использовать эти ферменты.
Многие сайт-специфические ингибиторы ETC внесли свой вклад в современные знания о митохондриальном дыхании. Синтез АТФ также зависит от ETC, поэтому все сайт-специфические ингибиторы также ингибируют образование АТФ. Рыбный яд ротенон, барбитутат амитал и антибиотик пирцидин А ингибируют НАДН и кофермент Q.[90]
Окись углерода, цианид, сероводород и азид эффективно ингибируют цитохромоксидазу. Окись углерода реагирует с восстановленной формой цитохрома, тогда как цианид и азид реагируют с окисленной формой. Антибиотик - антимицин. Британский antile wisite - антидот, используемый против боевого газа в отношении двух важных ингибиторов участка между цитохромом B и C1.[90].
| Соединения | Использовать | Место действия | Влияние на окислительное фосфорилирование |
|---|---|---|---|
| Цианид Монооксид углерода Азид Сероводород | Яды | Комплекс IV | Подавляют цепь переноса электронов, связывая более прочно, чем кислород, с Fe –Cu центр в цитохром с оксидазе, предотвращая восстановление кислорода.[91] |
| Олигомицин | Антибиотик | Комплекс V | Ингибирует АТФ-синтазу, блокируя поток протонов через Fо субъединица.[89] |
| CCCP 2,4-динитрофенол | Яды, похудание[N 1] | Внутренняя мембрана | Ионофоры которые нарушают протонный градиент, перенося протоны через мембрану. Этот ионофор разъединяет перекачка протонов от синтеза АТФ, потому что он переносит протоны через внутреннюю мембрану митохондрий.[92] |
| Ротенон | Пестицид | Комплекс I | Предотвращает перенос электронов от комплекса I к убихинону, блокируя сайт связывания убихинона.[93] |
| Малонат и оксалоацетат | Яды | Комплекс II | Конкурентные ингибиторы сукцинатдегидрогеназы (комплекс II).[94] |
| Антимицин А | Писцицид | Комплекс III | Связывается с сайтом Ци цитохром с редуктаза, тем самым подавляя окисление из убихинол. |
Не все ингибиторы окислительного фосфорилирования являются токсинами. В коричневая жировая ткань, регулируемые протонные каналы, называемые разобщение белков может отделить дыхание от синтеза АТФ.[95] Это быстрое дыхание производит тепло и особенно важно как способ поддержания температура тела за спящий животных, хотя эти белки могут также иметь более общую функцию в ответах клеток на стресс.[96]
История
Область окислительного фосфорилирования началась с доклада в 1906 г. Артур Харден жизненно важной роли фосфата в клеточном ферментация, но изначально только сахарные фосфаты были причастны.[97] Однако в начале 1940-х годов связь между окислением сахаров и образованием АТФ была твердо установлена. Герман Калькар,[98] подтверждая центральную роль АТФ в передаче энергии, что было предложено Фриц Альберт Липманн в 1941 г.[99] Позже, в 1949 году, Моррис Фридкин и Альберт Л. Ленингер доказано, что кофермент НАДН связан с метаболическими путями, такими как цикл лимонной кислоты и синтез АТФ.[100] Период, термин окислительного фосфорилирования был придуман Владимир Белицер в 1939 г.[101][102]
В течение следующих двадцати лет механизм образования АТФ оставался загадочным, и ученые искали неуловимое «высокоэнергетическое промежуточное соединение», которое связывало бы реакции окисления и фосфорилирования.[103] Эта загадка была решена Питер Д. Митчелл с публикацией хемиосмотическая теория в 1961 г.[104] Сначала это предложение было очень спорным, но постепенно было принято, и Митчелл был награжден премией. Нобелевская премия в 1978 г.[105][106] Последующие исследования были сосредоточены на очистке и характеристике задействованных ферментов, при этом основной вклад внесли Дэвид Э. Грин на комплексах электрон-транспортной цепи, а также Эфраим Ракер на АТФ-синтазу.[107] Важный шаг к разгадке механизма АТФ-синтазы был сделан Пол Д. Бойер, его разработкой в 1973 году механизма «изменения связывания», а затем его радикальным предложением ротационного катализа в 1982 году.[77][108] Более свежие работы включали структурные исследования на ферменты, участвующие в окислительном фосфорилировании Джон Э. Уокер, а Уокер и Бойер были удостоены Нобелевской премии 1997 года.[109]
Смотрите также
Примечания
- ^ DNP широко использовался как лекарства от ожирения в 1930-х годах, но в конечном итоге был прекращен из-за его опасных побочных эффектов. Однако незаконное использование этого наркотика для этой цели продолжается и сегодня. Видеть 2,4-Динитрофенол # Диетическое средство для дополнительной информации.
Рекомендации
- ^ «Окислительное значение в Кембриджском словаре английского языка». Dictionary.cambridge.org. В архиве из оригинала 24 января 2018 г.. Получено 28 апреля 2018.
- ^ а б c d е ж Шмидт-Рор К (2020). «Кислород - высокоэнергетическая молекула, питающая сложную многоклеточную жизнь: фундаментальные поправки к традиционной биоэнергетике». СКУД Омега. 5 (5): 2221–2233. Дои:10.1021 / acsomega.9b03352. ЧВК 7016920. PMID 32064383.
- ^ Митчелл П., Мойл Дж. (1967). «Хемиосмотическая гипотеза окислительного фосфорилирования». Природа. 213 (5072): 137–9. Bibcode:1967Натура.213..137М. Дои:10.1038 / 213137a0. PMID 4291593. S2CID 4149605.
- ^ а б Димрот П., Кайм Г., Мэтти У. (1 января 2000 г.). «Решающая роль мембранного потенциала для синтеза АТФ с помощью F (1) F (o) АТФ-синтаз». J. Exp. Биол. 203 (Пт 1): 51–9. PMID 10600673. В архиве из оригинала от 30 сентября 2007 г.
- ^ а б c d Шульц Б.Е., Чан СИ (2001). «Структуры и стратегии протонной накачки митохондриальных респираторных ферментов» (PDF). Annu Rev Biophys Biomol Struct. 30: 23–65. Дои:10.1146 / annurev.biophys.30.1.23. PMID 11340051.
- ^ Богатый пиар (2003). «Молекулярный аппарат дыхательной цепи Кейлина». Biochem. Soc. Транс. 31 (Pt 6): 1095–105. Дои:10.1042 / bst0311095. PMID 14641005.
- ^ Портер Р.К., Бренд MD (1995). «Митохондриальная протонная проводимость и соотношение H + / O не зависят от скорости переноса электронов в изолированных гепатоцитах». Biochem. J. 310 (Pt 2): 379–82. Дои:10.1042 / bj3100379. ЧВК 1135905. PMID 7654171.
- ^ Мэтьюз Ф.С. (1985). «Структура, функции и эволюция цитохромов». Прог. Биофиз. Мол. Биол. 45 (1): 1–56. Дои:10.1016/0079-6107(85)90004-5. PMID 3881803.
- ^ Вуд PM (1983). «Почему существуют цитохромы с-типа?». FEBS Lett. 164 (2): 223–6. Дои:10.1016/0014-5793(83)80289-0. PMID 6317447. S2CID 7685958.
- ^ Кран FL (1 декабря 2001 г.). «Биохимические функции коэнзима Q10». J Am Coll Nutr. 20 (6): 591–8. Дои:10.1080/07315724.2001.10719063. PMID 11771674. S2CID 28013583.
- ^ Митчелл П. (1979). «Концепция дыхательной цепи Кейлина и ее хемиосмотические последствия». Наука. 206 (4423): 1148–59. Bibcode:1979Научный ... 206.1148M. Дои:10.1126 / science.388618. PMID 388618.
- ^ Søballe B, Poole RK (1999). «Микробные убихиноны: множество ролей в дыхании, регуляции генов и управлении окислительным стрессом» (PDF). Микробиология. 145 (8): 1817–30. Дои:10.1099/13500872-145-8-1817. PMID 10463148. В архиве (PDF) из оригинала от 29.05.2008.
- ^ Джонсон, округ Колумбия, декан Д. Р., Смит А. Д., Джонсон М.К. (2005). «Структура, функции и формирование биологических кластеров железа и серы». Анну. Преподобный Biochem. 74: 247–81. Дои:10.1146 / annurev.biochem.74.082803.133518. PMID 15952888.
- ^ Page CC, Moser CC, Chen X, Dutton PL (1999). «Естественные инженерные принципы туннелирования электронов при биологическом окислении-восстановлении». Природа. 402 (6757): 47–52. Bibcode:1999Натура.402 ... 47П. Дои:10.1038/46972. PMID 10573417. S2CID 4431405.
- ^ Лейс Д., Скраттон Н.С. (2004). «Электрические схемы в биологии: новые принципы из структуры белка». Curr. Мнение. Struct. Биол. 14 (6): 642–7. Дои:10.1016 / j.sbi.2004.10.002. PMID 15582386.
- ^ Boxma B, de Graaf RM, van der Staay GW, van Alen TA, Ricard G, Gabaldón T., van Hoek AH, Moon-van der Staay SY, Koopman WJ, van Hellemond JJ, Tielens AG, Friedrich T, Veenhuis M, Huynen MA, Hackstein JH (2005). «Анаэробная митохондрия, производящая водород» (PDF). Природа. 434 (7029): 74–9. Bibcode:2005Натура.434 ... 74Б. Дои:10.1038 / природа03343. PMID 15744302. S2CID 4401178.
- ^ а б c d е ж грамм час Справочник по медицинской химии. Андерс Овергаард Педерсен и Хеннинг Нильсен. Орхусский университет. 2008 г.
- ^ а б Херст Дж (2005). «Передача энергии дыхательным комплексом I - оценка современных знаний». Biochem. Soc. Транс. 33 (Pt 3): 525–9. Дои:10.1042 / BST0330525. PMID 15916556.
- ^ а б Леназ Г., Фато Р., Дженова М.Л., Бергамини С., Бьянки С., Бионди А. (2006). «Митохондриальный комплекс I: структурные и функциональные аспекты». Биохим. Биофиз. Acta. 1757 (9–10): 1406–20. Дои:10.1016 / j.bbabio.2006.05.007. PMID 16828051.
- ^ а б Сазанов Л.А., Хинчлифф П. (2006). «Структура гидрофильного домена респираторного комплекса I от Thermus thermophilus». Наука. 311 (5766): 1430–6. Bibcode:2006Научный ... 311.1430S. Дои:10.1126 / science.1123809. PMID 16469879. S2CID 1892332.
- ^ Ефремов, Р.Г .; Барадаран, Р. Сазанов, Л.А. (2010). «Архитектура дыхательного комплекса I». Природа. 465 (7297): 441–5. Дои:10.1038 / природа09066. PMID 20505720. S2CID 4372778.
- ^ Баранова Е.А., Холт П.Дж., Сазанов Л.А. (2007). «Проекционная структура мембранного домена кишечная палочка дыхательный комплекс I при разрешении 8 А ». J. Mol. Биол. 366 (1): 140–54. Дои:10.1016 / j.jmb.2006.11.026. PMID 17157874.
- ^ Фридрих Т, Бёттчер Б (2004). «Общая структура дыхательного комплекса I: система Lego». Биохим. Биофиз. Acta. 1608 (1): 1–9. Дои:10.1016 / j.bbabio.2003.10.002. PMID 14741580.
- ^ Херст Дж (январь 2010 г.). «К молекулярному механизму дыхательного комплекса I». Biochem. J. 425 (2): 327–39. Дои:10.1042 / BJ20091382. PMID 20025615.
- ^ Чеккини Дж. (2003). «Функция и строение комплекса II дыхательной цепи». Анну. Преподобный Biochem. 72: 77–109. Дои:10.1146 / annurev.biochem.72.121801.161700. PMID 14527321.
- ^ Янковская В., Хорсфилд Р., Торнрот С., Луна-Чавес С., Миёши Н., Леже С., Бирн Б., Чеккини Г., Ивата С. и др. (2003). «Архитектура генерации сукцинатдегидрогеназы и активных форм кислорода». Наука. 299 (5607): 700–4. Bibcode:2003Наука ... 299..700л. Дои:10.1126 / science.1079605. PMID 12560550. S2CID 29222766.
- ^ Хорсфилд Р., Ивата С., Бирн Б. (2004). «Комплекс II со структурной точки зрения». Curr. Protein Pept. Наука. 5 (2): 107–18. Дои:10.2174/1389203043486847. PMID 15078221.
- ^ Кита К., Хираваке Х, Миядера Х, Амино Х, Такео С (2002). «Роль комплекса II в анаэробном дыхании митохондрий паразитов из Ascaris suum и Plasmodium falciparum». Биохим. Биофиз. Acta. 1553 (1–2): 123–39. Дои:10.1016 / S0005-2728 (01) 00237-7. PMID 11803022.
- ^ Художник Х. Дж., Морриси Дж. М., Мазер М. В., Вайдья А. Б. (2007). «Особая роль митохондриального транспорта электронов в Plasmodium falciparum на стадии крови». Природа. 446 (7131): 88–91. Bibcode:2007Натура 446 ... 88П. Дои:10.1038 / природа05572. PMID 17330044. S2CID 4421676.
- ^ Рамзи Р. Р., Стинкамп Д. Д., Хусейн М. (1987). «Реакции флавопротеина с переносом электрона и флавопротеина с переносом электрона: убихинон оксидоредуктаза». Biochem. J. 241 (3): 883–92. Дои:10.1042 / bj2410883. ЧВК 1147643. PMID 3593226.
- ^ Чжан Дж., Фрерман Ф. Э., Ким Дж. Дж. (2006). «Структура переноса электронов флавопротеин-убихинон оксидоредуктазы и перенос электронов в митохондриальный пул убихинона». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 103 (44): 16212–7. Bibcode:2006PNAS..10316212Z. Дои:10.1073 / pnas.0604567103. ЧВК 1637562. PMID 17050691.
- ^ Икеда Ю., Домбровски С., Танака К. (25 января 1983 г.). «Разделение и свойства пяти различных ацил-КоА дегидрогеназ из митохондрий печени крысы. Идентификация новой 2-метил-разветвленной ацил-КоА дегидрогеназы». J. Biol. Chem. 258 (2): 1066–76. PMID 6401712. В архиве из оригинала от 29 сентября 2007 г.
- ^ Ruzicka FJ, Beinert H (1977). «Новый железо-серный флавопротеин дыхательной цепи. Компонент пути бета-окисления жирных кислот» (PDF). J. Biol. Chem. 252 (23): 8440–5. PMID 925004. В архиве (PDF) из оригинала от 27.09.2007.
- ^ Ишизаки К., Ларсон Т.Р., Шауэр Н., Ферни А.Р., Грэм И.А., Ливер С.Дж. (2005). «Критическая роль флавопротеина, переносящего электроны Arabidopsis: убихинон оксидоредуктазы во время голодания, вызванного темнотой». Растительная клетка. 17 (9): 2587–600. Дои:10.1105 / tpc.105.035162. ЧВК 1197437. PMID 16055629.
- ^ Берри Е.А., Гергова-Курас М., Хуанг Л.С., Крофтс А.Р. (2000). «Структура и функция комплексов цитохрома bc» (PDF). Анну. Преподобный Biochem. 69: 1005–75. CiteSeerX 10.1.1.319.5709. Дои:10.1146 / annurev.biochem.69.1.1005. PMID 10966481. В архиве (PDF) из оригинала от 28.12.2015.
- ^ Крофтс АР (2004). «Комплекс цитохрома bc1: функция в контексте структуры». Анну. Преподобный Physiol. 66: 689–733. Дои:10.1146 / annurev.physiol.66.032102.150251. PMID 14977419.
- ^ Ивата С., Ли Дж. У., Окада К., Ли Дж. К., Ивата М., Расмуссен Б., Линк Т. А., Рамасвами С., Яп Б. К. (1998). "Полная структура 11-субъединицы бычьего митохондриального цитохрома bc1 комплекса". Наука. 281 (5373): 64–71. Bibcode:1998Научный ... 281 ... 64I. Дои:10.1126 / science.281.5373.64. PMID 9651245.
- ^ Trumpower BL (1990). «Протонодвижущий цикл Q. Передача энергии путем связывания перемещения протона с переносом электрона комплексом цитохрома bc1» (PDF). J. Biol. Chem. 265 (20): 11409–12. PMID 2164001. В архиве (PDF) из оригинала от 27.09.2007.
- ^ Хант С., Палсдоттир Х, Трампауэр Б. Л. (2003). «Протонмотивные пути и механизмы в комплексе цитохрома bc1». FEBS Lett. 545 (1): 39–46. Дои:10.1016 / S0014-5793 (03) 00391-0. PMID 12788490. S2CID 13942619.
- ^ Калхун М.В., Томас Дж. В., Геннис Р. Б. (1994). "Суперсемейство цитохромоксидазы протонных насосов, управляемых окислительно-восстановительным процессом". Trends Biochem. Наука. 19 (8): 325–30. Дои:10.1016 / 0968-0004 (94) 90071-X. PMID 7940677.
- ^ Цукихара Т., Аояма Х, Ямасита Э, Томизаки Т, Ямагути Х, Синдзава-Ито К., Накашима Р., Яоно Р., Йошикава С. (1996). «Вся структура 13-субъединицы окисла цитохром с оксидазы при 2,8 А». Наука. 272 (5265): 1136–44. Bibcode:1996Научный ... 272.1136Т. Дои:10.1126 / science.272.5265.1136. PMID 8638158. S2CID 20860573.
- ^ Йошикава С., Мурамото К., Синдзава-Ито К., Аояма Х, Цукихара Т., Симоката К., Катаяма Ю., Симада Х (2006). «Протонный насосный механизм цитохром с оксидазы сердца крупного рогатого скота». Биохим. Биофиз. Acta. 1757 (9–10): 1110–6. Дои:10.1016 / j.bbabio.2006.06.004. PMID 16904626.
- ^ Расмуссон А.Г., Сул К.Л., Элтон TE (2004). «Альтернативные НАД (Ф) Н дегидрогеназы митохондрий растений». Анну Рев Завод Биол. 55: 23–39. Дои:10.1146 / annurev.arplant.55.031903.141720. PMID 15725055.
- ^ Менз Р.И., Дэй Д.А. (1996). «Очистка и характеристика 43-кДа нечувствительной к ротенону НАДН-дегидрогеназы из митохондрий растений». J. Biol. Chem. 271 (38): 23117–20. Дои:10.1074 / jbc.271.38.23117. PMID 8798503. S2CID 893754.
- ^ Макдональд А, Ванлерберге Г (2004). «Разветвленный транспорт митохондрий электронов в Animalia: присутствие альтернативной оксидазы в нескольких типах животных». IUBMB Life. 56 (6): 333–41. Дои:10.1080/1521-6540400000876. PMID 15370881.
- ^ Sluse FE, Jarmuszkiewicz W (1998). «Альтернативная оксидаза в разветвленной митохондриальной респираторной сети: обзор структуры, функции, регуляции и роли». Braz. J. Med. Биол. Res. 31 (6): 733–47. Дои:10.1590 / S0100-879X1998000600003. PMID 9698817.
- ^ Мур А. Л., Седов Дж. Н. (1991). «Регуляция и природа цианид-устойчивой альтернативной оксидазы митохондрий растений». Биохим. Биофиз. Acta. 1059 (2): 121–40. Дои:10.1016 / S0005-2728 (05) 80197-5. PMID 1883834.
- ^ Ванлерберге ГК, Макинтош Л (1997). «АЛЬТЕРНАТИВНАЯ ОКСИДАЗА: от гена к функции». Анну. Rev. Plant Physiol. Завод Мол. Биол. 48: 703–734. Дои:10.1146 / annurev.arplant.48.1.703. PMID 15012279.
- ^ Ито Й, Сайшо Д., Наказоно М., Цуцуми Н., Хираи А. (1997). «Уровни транскриптов тандемно расположенных генов альтернативной оксидазы в рисе повышаются при низкой температуре». Ген. 203 (2): 121–9. Дои:10.1016 / S0378-1119 (97) 00502-7. PMID 9426242.
- ^ Максвелл Д.П., Ван И, Макинтош Л. (1999). «Альтернативная оксидаза снижает выработку реактивного кислорода митохондриями в клетках растений». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 96 (14): 8271–6. Bibcode:1999ПНАС ... 96.8271М. Дои:10.1073 / pnas.96.14.8271. ЧВК 22224. PMID 10393984.
- ^ Леназ Г (2001). «Критическая оценка пула митохондриального кофермента Q». FEBS Lett. 509 (2): 151–5. Дои:10.1016 / S0014-5793 (01) 03172-6. PMID 11741580. S2CID 46138989.
- ^ Heinemeyer J, Braun HP, Boekema EJ, Kouril R (2007). «Структурная модель суперкомплекса цитохром С редуктаза / оксидаза из митохондрий дрожжей». J. Biol. Chem. 282 (16): 12240–8. Дои:10.1074 / jbc.M610545200. PMID 17322303. S2CID 18123642.
- ^ Шеггер Х., Пфайффер К. (2000). «Суперкомплексы дыхательных цепей митохондрий дрожжей и млекопитающих». EMBO J. 19 (8): 1777–83. Дои:10.1093 / emboj / 19.8.1777. ЧВК 302020. PMID 10775262.
- ^ Шеггер Х (2002). «Суперкомплексы дыхательной цепи митохондрий и бактерий». Биохим. Биофиз. Acta. 1555 (1–3): 154–9. Дои:10.1016 / S0005-2728 (02) 00271-2. PMID 12206908.
- ^ Шеггер Х., Пфайффер К. (2001). «Соотношение комплексов окислительного фосфорилирования I-V в митохондриях сердца крупного рогатого скота и состав суперкомплексов дыхательной цепи». J. Biol. Chem. 276 (41): 37861–7. Дои:10.1074 / jbc.M106474200. PMID 11483615. В архиве из оригинала от 29.09.2007.
- ^ Gupte S, Wu ES, Hoechli L, Hoechli M, Jacobson K, Sowers AE, Hackenbrock CR (1984). «Взаимосвязь между латеральной диффузией, частотой столкновений и переносом электронов окислительно-восстановительных компонентов внутренней мембраны митохондрий». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 81 (9): 2606–10. Bibcode:1984PNAS ... 81.2606G. Дои:10.1073 / пнас.81.9.2606. ЧВК 345118. PMID 6326133.
- ^ Нилсон KH (1999). «Поствикингская микробиология: новые подходы, новые данные, новые идеи». Orig Life Evol Biosph. 29 (1): 73–93. Bibcode:1999 ОЛЕБ ... 29 ... 73Н. Дои:10.1023 / А: 1006515817767. PMID 11536899. S2CID 12289639.
- ^ Шефер Г., Энгельхард М., Мюллер В. (1999). «Биоэнергетика архей». Microbiol. Мол. Биол. Rev. 63 (3): 570–620. Дои:10.1128 / MMBR.63.3.570-620.1999. ЧВК 103747. PMID 10477309.
- ^ а б Ingledew WJ, Пул RK (1984). «Дыхательные цепи кишечная палочка". Microbiol. Rev. 48 (3): 222–71. Дои:10.1128 / mmbr.48.3.222-271.1984. ЧВК 373010. PMID 6387427.
- ^ а б Unden G, Bongaerts J (1997). «Альтернативные дыхательные пути кишечная палочка: энергетика и регуляция транскрипции в ответ на акцепторы электронов ». Биохим. Биофиз. Acta. 1320 (3): 217–34. Дои:10.1016 / S0005-2728 (97) 00034-0. PMID 9230919.
- ^ Чеккини Г., Шредер И., Гунсалус Р.П., Маклашина Е. (2002). «Сукцинатдегидрогеназа и фумаратредуктаза из кишечная палочка". Биохим. Биофиз. Acta. 1553 (1–2): 140–57. Дои:10.1016 / S0005-2728 (01) 00238-9. PMID 11803023.
- ^ Freitag A, Bock E; Бок (1990). «Энергосбережение в Nitrobacter». Письма о микробиологии FEMS. 66 (1–3): 157–62. Дои:10.1111 / j.1574-6968.1990.tb03989.x.
- ^ Старкенбург С.Р., Цепь PS, Саяведра-Сото Л.А., Хаузер Л., Лэнд М.Л., Лаример Ф.В., Малфатти С.А., Клотц М.Г., Боттомли П.Дж., Арп-ди-джей, Хики В.Дж. (2006). «Последовательность генома хемолитоавтотрофной нитритокисляющей бактерии Nitrobacter winogradskyi Nb-255». Appl. Environ. Микробиол. 72 (3): 2050–63. Дои:10.1128 / AEM.72.3.2050-2063.2006. ЧВК 1393235. PMID 16517654.
- ^ Яманака Т., Фукумори Ю. (1988). «Нитритокисляющая система Nitrobacter winogradskyi». FEMS Microbiol. Rev. 54 (4): 259–70. Дои:10.1111 / j.1574-6968.1988.tb02746.x. PMID 2856189.
- ^ Ючи С., Лин ЕС (1993). "Адаптация кишечная палочка к окислительно-восстановительным средам путем экспрессии генов ". Мол. Микробиол. 9 (1): 9–15. Дои:10.1111 / j.1365-2958.1993.tb01664.x. PMID 8412675.
- ^ Калхун М.В., Оден К.Л., Геннис Р.Б., де Маттос М.Дж., Нейссел О.М. (1993). «Энергетическая эффективность кишечная палочка: последствия мутаций в компонентах аэробной дыхательной цепи » (PDF). J. Bacteriol. 175 (10): 3020–5. Дои:10.1128 / jb.175.10.3020-3025.1993. ЧВК 204621. PMID 8491720. В архиве (PDF) из оригинала от 27.09.2007.
- ^ а б Бойер П.Д. (1997).«АТФ-синтаза - великолепная молекулярная машина». Анну. Преподобный Biochem. 66: 717–49. Дои:10.1146 / annurev.biochem.66.1.717. PMID 9242922.
- ^ Ван Вальравен Х.С., Стротманн Х., Шварц О., Румберг Б. (1996). «Отношение сочетания H + / АТФ для АТФ-синтазы из тиол-модулированных хлоропластов и двух штаммов цианобактерий равно четырем». FEBS Lett. 379 (3): 309–13. Дои:10.1016/0014-5793(95)01536-1. PMID 8603713. S2CID 35989618.
- ^ Ёсида М., Мунэюки Э, Хисабори Т. (2001). «АТФ-синтаза - чудесный роторный двигатель клетки». Nat. Преподобный Мол. Cell Biol. 2 (9): 669–77. Дои:10.1038/35089509. PMID 11533724. S2CID 3926411.
- ^ Шемидт Р.А., Ку Дж., Уильямс Дж. Р., Брусилов В.С. (1998). «Влияние источника углерода на экспрессию генов F0 и на стехиометрию c-субъединицы в АТФазе F1F0 кишечная палочка". J. Bacteriol. 180 (12): 3205–8. Дои:10.1128 / jb.180.12.3205-3208.1998. ЧВК 107823. PMID 9620972.
- ^ Нельсон Н., Перзов Н., Коэн А., Хагай К., Падлер В., Нельсон Х. (1 января 2000 г.). «Клеточная биология генерации протон-движущей силы V-АТФазами». J. Exp. Биол. 203 (Pt 1): 89–95. PMID 10600677. В архиве из оригинала от 30 сентября 2007 г.
- ^ Рубинштейн JL, Уокер JE, Хендерсон R (2003). «Структура митохондриальной АТФ-синтазы с помощью электронной криомикроскопии». EMBO J. 22 (23): 6182–92. Дои:10.1093 / emboj / cdg608. ЧВК 291849. PMID 14633978.
- ^ Лесли А.Г., Уокер Дж. Э. (2000). «Структурная модель F1-АТФазы и значение для роторного катализа». Филос. Пер. R. Soc. Лондон. B Biol. Наука. 355 (1396): 465–71. Дои:10.1098 / рстб.2000.0588. ЧВК 1692760. PMID 10836500.
- ^ Нодзи Х, Йошида М (2001). «Роторная машина в клетке, АТФ-синтаза». J. Biol. Chem. 276 (3): 1665–8. Дои:10.1074 / jbc.R000021200. PMID 11080505. S2CID 30953216.
- ^ Капальди Р.А., Аггелер Р. (2002). «Механизм АТФ-синтазы F (1) F (0) -типа, биологический вращательный двигатель». Trends Biochem. Наука. 27 (3): 154–60. Дои:10.1016 / S0968-0004 (01) 02051-5. PMID 11893513.
- ^ Димрот П., фон Баллмос С., Мейер Т. (2006). «Каталитические и механические циклы в F-ATP-синтазах. Четвертое в серии обзоров Cycles». EMBO Rep. 7 (3): 276–82. Дои:10.1038 / sj.embor.7400646. ЧВК 1456893. PMID 16607397.
- ^ а б Gresser MJ, Myers JA, Boyer PD (25 октября 1982 г.). «Каталитическая кооперативность сайтов митохондриальной F1 аденозинтрифосфатазы говяжьего сердца. Корреляции начальной скорости, связанных промежуточных продуктов и измерений кислородного обмена с чередующейся трехузельной моделью». J. Biol. Chem. 257 (20): 12030–8. PMID 6214554. В архиве из оригинала от 29 сентября 2007 г.
- ^ Димрот П. (1994). «Бактериальная натриевая ионно-связанная энергетика». Антони ван Левенгук. 65 (4): 381–95. Дои:10.1007 / BF00872221. PMID 7832594. S2CID 23763996.
- ^ а б Бехер Б., Мюллер В. (1994). «Дельта мю Na + управляет синтезом АТФ через дельта мю Na (+) - транслокацию F1F0-АТФ-синтазы в мембранных везикулах архей Methanosarcina mazei Gö1». J. Bacteriol. 176 (9): 2543–50. Дои:10.1128 / jb.176.9.2543-2550.1994. ЧВК 205391. PMID 8169202.
- ^ Мюллер V (2004). «Исключительная вариабельность мотора АТФаз архейла A1A0: от мультимерных до мономерных роторов, содержащих 6-13 сайтов связывания ионов». J. Bioenerg. Биомер. 36 (1): 115–25. Дои:10.1023 / B: JOBB.0000019603.68282.04. PMID 15168615. S2CID 24887884.
- ^ а б Дэвис К.Дж. (1995). «Окислительный стресс: парадокс аэробной жизни». Biochem. Soc. Symp. 61: 1–31. Дои:10.1042 / bss0610001. PMID 8660387.
- ^ Ротанг SI (2006). «Теории биологического старения: гены, белки и свободные радикалы» (PDF). Свободный Радич. Res. 40 (12): 1230–8. CiteSeerX 10.1.1.476.9259. Дои:10.1080/10715760600911303. PMID 17090411. S2CID 11125090. Архивировано из оригинал (PDF) на 2014-06-14. Получено 2017-10-27.
- ^ Валко М., Лейбфриц Д., Монкол Дж., Кронин М.Т., Мазур М., Телсер Дж. (2007). «Свободные радикалы и антиоксиданты в нормальных физиологических функциях и болезнях человека». Int. J. Biochem. Cell Biol. 39 (1): 44–84. Дои:10.1016 / j.biocel.2006.07.001. PMID 16978905.
- ^ Раха С., Робинсон Б.Х. (2000). «Митохондрии, свободные радикалы кислорода, болезни и старение». Trends Biochem. Наука. 25 (10): 502–8. Дои:10.1016 / S0968-0004 (00) 01674-1. PMID 11050436.
- ^ Финкель Т., Холбрук, штат Нью-Джерси (2000). «Окислители, окислительный стресс и биология старения». Природа. 408 (6809): 239–47. Bibcode:2000Натура.408..239F. Дои:10.1038/35041687. PMID 11089981. S2CID 2502238.
- ^ Каденбах Б., Рамзан Р., Вен Л., Фогт С. (март 2010 г.). «Новое расширение теории Митчелла для окислительного фосфорилирования в митохондриях живых организмов». Биохим. Биофиз. Acta. 1800 (3): 205–12. Дои:10.1016 / j.bbagen.2009.04.019. PMID 19409964.
- ^ Echtay KS, Roussel D, St-Pierre J, Jekabsons MB, Cadenas S, Stuart JA, Harper JA, Roebuck SJ, Morrison A, Pickering S, Clapham JC, Brand MD (январь 2002 г.). «Супероксид активирует митохондриальные разобщающие белки». Природа. 415 (6867): 96–9. Bibcode:2002Натура 415 ... 96Е. Дои:10.1038 / 415096a. PMID 11780125. S2CID 4349744.
- ^ Дево, JBL; Живые изгороди, CP; Хики, AJR (январь 2019 г.). «Ацидоз поддерживает функцию митохондрий мозга у толерантных к гипоксии трехлеперых рыб: стратегия выживания при остром гипоксическом воздействии?». Front Physiol. 9, 1914: 1941. Дои:10.3389 / fphys.2018.01941. ЧВК 6346031. PMID 30713504.
- ^ а б Джоши С., Хуанг Ю.Г. (1991). «Комплекс АТФ-синтазы из митохондрий сердца крупного рогатого скота: белок, придающий чувствительность к олигомицину, необходим для дициклогексилкарбодиимид-чувствительной АТФазы». Биохим. Биофиз. Acta. 1067 (2): 255–8. Дои:10.1016/0005-2736(91)90051-9. PMID 1831660.
- ^ а б Сатьянараяна, У. (2002). Биохимия (2-е изд.). Калькутта, Индия: Книги и союзники. ISBN 8187134801. OCLC 71209231.
- ^ Цубаки М (1993). «Инфракрасное исследование с преобразованием Фурье связывания цианида с биядерным сайтом Fea3-CuB цитохром-с-оксидазы сердца крупного рогатого скота: влияние окислительно-восстановительных конформационных изменений в биядерном сайте». Биохимия. 32 (1): 164–73. Дои:10.1021 / bi00052a022. PMID 8380331.
- ^ Хейтлер П.Г. (1979). «Разобщители окислительного фосфорилирования». Meth. Энзимол. Методы в энзимологии. 55: 462–42. Дои:10.1016/0076-6879(79)55060-5. ISBN 978-0-12-181955-2. PMID 156853.
- ^ Ламберт AJ, Бренд MD (2004). «Ингибиторы хинон-связывающего сайта позволяют быстро производить супероксид из митохондриальной НАДН: убихинон оксидоредуктазы (комплекс I)». J. Biol. Chem. 279 (38): 39414–20. Дои:10.1074 / jbc.M406576200. PMID 15262965. S2CID 26620903.
- ^ Дервартанян Д.В., Вигер С. (ноябрь 1964 г.). «Исследования сукцинатдегидрогеназы: I. Спектральные свойства очищенного фермента и образование комплексов фермент-конкурентный ингибитор». Биохим. Биофиз. Acta. 92 (2): 233–47. Дои:10.1016/0926-6569(64)90182-8. PMID 14249115.
- ^ Ricquier D, Bouillaud F (2000). «Гомологи разобщающих белков: UCP1, UCP2, UCP3, StUCP и AtUCP». Biochem. J. 345 (2): 161–79. Дои:10.1042/0264-6021:3450161. ЧВК 1220743. PMID 10620491.
- ^ Борецки Я., Верчези А.Е. (2005). «Растение, разобщающее митохондриальный белок и альтернативную оксидазу: энергетический метаболизм и стресс». Biosci. Представитель. 25 (3–4): 271–86. Дои:10.1007 / s10540-005-2889-2. PMID 16283557. S2CID 18598358.
- ^ Harden A, Young WJ .; Янг (1906). «Алкогольная закваска дрожжевого сока». Труды Королевского общества. B (77): 405–20. Дои:10.1098 / rspb.1906.0029.
- ^ Калькар HM (1974). «Истоки концепции окислительного фосфорилирования». Мол. Клетка. Биохим. 5 (1–2): 55–63. Дои:10.1007 / BF01874172. PMID 4279328. S2CID 26999163.
- ^ Липманн Ф (1941). «Метаболическое производство и использование энергии фосфатной связи». Adv Enzymol. 1: 99–162. Дои:10.4159 / гарвард.9780674366701.c141. ISBN 9780674366701.
- ^ Фридкин М., Ленингер А.Л. (1 апреля 1949 г.). «Этерификация неорганического фосфата, связанного с переносом электронов между дигидродифосфопиридиновым нуклеотидом и кислородом». J. Biol. Chem. 178 (2): 611–44. PMID 18116985. В архиве из оригинала от 16 декабря 2008 г.
- ^ Калькар, Х. М. (1991). «50 лет биологических исследований - от окислительного фосфорилирования до регулирования транспорта энергии». Ежегодный обзор биохимии. 60: 1–37. Дои:10.1146 / annurev.bi.60.070191.000245. PMID 1883194.
- ^ Белицер, В. А .; Цибакова, Е. Т. (1939). «О механизме фосфорилирования при дыхании». Биохимия. 4: 516–534.
- ^ Слейтер EC (1953). «Механизм фосфорилирования в дыхательной цепи». Природа. 172 (4387): 975–8. Bibcode:1953Натура.172..975С. Дои:10.1038 / 172975a0. PMID 13111237. S2CID 4153659.
- ^ Митчелл П. (1961). «Связь фосфорилирования с переносом электронов и водорода по хемиосмотическому типу механизма». Природа. 191 (4784): 144–8. Bibcode:1961Натура.191..144М. Дои:10.1038 / 191144a0. PMID 13771349. S2CID 1784050.
- ^ Милтон Х. Сайер мл. Питер Митчелл и жизненная сила. OCLC 55202414.
- ^ Митчелл, Питер (1978). «Концепция дыхательной цепи Дэвида Кейлина и ее хемиосмотические последствия» (PDF). Нобелевская лекция. Нобелевский фонд. В архиве (PDF) из оригинала 2007-09-27. Получено 2007-07-21.
- ^ Пуллман М.Э., Пенефски Х.С., Датта А., Ракер Э. (1 ноября 1960 г.). «Частичное разрешение ферментов, катализирующих окислительное фосфорилирование. I. Очистка и свойства растворимой динитрофенол-стимулированной аденозинтрифосфатазы». J. Biol. Chem. 235 (11): 3322–9. PMID 13738472. В архиве из оригинала от 29 сентября 2007 г.
- ^ Бойер П.Д., Кросс Р.Л., Момсен В. (1973). «Новая концепция взаимодействия энергии при окислительном фосфорилировании, основанная на молекулярном объяснении реакций кислородного обмена». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 70 (10): 2837–9. Bibcode:1973ПНАС ... 70.2837Б. Дои:10.1073 / пнас.70.10.2837. ЧВК 427120. PMID 4517936.
- ^ "Нобелевская премия по химии 1997 г.". Нобелевский фонд. В архиве из оригинала на 2017-03-25. Получено 2007-07-21.
дальнейшее чтение
Вводный
- Нельсон Д.Л.; Кокс MM (2004). Принципы биохимии Ленингера (4-е изд.). В. Х. Фриман. ISBN 0-7167-4339-6.
- Schneider ED; Саган Д (2006). В прохладе: поток энергии, термодинамика и жизнь (1-е изд.). Издательство Чикагского университета. ISBN 0-226-73937-6.
- Переулок N (2006). Власть, секс, самоубийство: митохондрии и смысл жизни (1-е изд.). Oxford University Press, США. ISBN 0-19-920564-7.
Передовой
- Николлс Д.Г.; Фергюсон SJ (2002). Биоэнергетика 3 (1-е изд.). Академическая пресса. ISBN 0-12-518121-3.
- Хейни Д. (2001). Биологическая термодинамика (1-е изд.). Издательство Кембриджского университета. ISBN 0-521-79549-4.
- Раджан СС (2003). Введение в биоэнергетику (1-е изд.). Анмол. ISBN 81-261-1364-2.
- Викстром М (Эд) (2005). Биофизические и структурные аспекты биоэнергетики (1-е изд.). Королевское химическое общество. ISBN 0-85404-346-2.CS1 maint: дополнительный текст: список авторов (связь)
Общие ресурсы
- Анимированные диаграммы, иллюстрирующие окислительное фосфорилирование Wiley and Co Понятия в биохимии
- Он-лайн лекции по биофизике Энтони Крофтс, Университет Иллинойса в Урбане-Шампейн
- АТФ-синтаза Грэм Джонсон
Структурные ресурсы
- PDB молекула месяца:
- Интерактивные молекулярные модели в Universidade Fernando Pessoa:







![{displaystyle {ce {O2 -> [{ce {e ^ {-}}}] {underset {Superoxide} {O2 ^ {underline {ullet}}}} -> [{ce {e ^ {-}}}] {underset {Peroxide} {O2 ^ {2-}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3d9bf9d3a61736aa6207fa53b8ce0165b9eebb6)
