Флавин аденин динуклеотид - Flavin adenine dinucleotide
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| 3DMet | |
| 1208946 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| DrugBank | |
| ECHA InfoCard | 100.005.149 |
| Номер ЕС |
|
| 108834 | |
| КЕГГ | |
| MeSH | Флавин-аденин + динуклеотид |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C27ЧАС33N9О15п2 | |
| Молярная масса | 785.557 г · моль−1 |
| Внешность | Белые стекловидные кристаллы |
| бревно п | -1.336 |
| Кислотность (пKа) | 1.128 |
| Основность (пKб) | 12.8689 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
В биохимия, флавинаденин динуклеотид (FAD) это редокс -активный кофермент связаны с различными белки, который участвует в нескольких ферментативных реакциях в метаболизм. А флавопротеин белок, содержащий группа флавинов, который может быть в форме FAD или флавинмононуклеотид (ФМН). Известны многие флавопротеины: компоненты комплекса сукцинатдегидрогеназы, α-кетоглутаратдегидрогеназа, и компонент пируватдегидрогеназный комплекс.
FAD может существовать в четырех окислительно-восстановительных состояниях, которые являются флавин-N (5) -оксид, хинон, семихинон, и гидрохинон.[1] FAD преобразуется между этими состояниями, принимая или отдавая электроны. ФАД в полностью окисленной форме или хинон форма, принимает два электрона и два протона, чтобы стать FADH2 (форма гидрохинона). Семихинон (FADH·) может быть образован либо восстановлением FAD, либо окислением FADH2 приняв или отдав один электрон и один протон соответственно. Некоторые белки, однако, генерируют и поддерживают переокисленную форму кофактора флавина, флавин-N (5) -оксида.[2][3]
История
Флавопротеины были впервые обнаружены в 1879 году путем разделения компонентов коровьего молока. Изначально их называли лактохромами из-за их молочного происхождения и желтого цвета. пигмент.[4] Научному сообществу потребовалось 50 лет, чтобы добиться существенного прогресса в идентификации молекул, ответственных за желтый пигмент. 1930-е годы положили начало области кофермент исследования с публикацией многих флавин и никотинамид производные структуры и их облигатные роли в окислительно-восстановительном катализе. Немецкие ученые Отто Варбург и Уолтер Кристиан открыли дрожжевой желтый белок требующийся для клеточное дыхание в 1932 г. Их коллега Хьюго Теорелл разделил этот желтый фермент на апофермент и желтый пигмент, и показал, что ни фермент, ни пигмент не способны окисляющий НАДН сами по себе, но смешивание их вместе восстановит активность. Теорелл подтвердил, что пигмент рибофлавин фосфатный эфир, флавинмононуклеотид (FMN) в 1937 году, что стало первым прямым доказательством фермент кофакторы.[5] Варбург и Кристиан затем обнаружили, что FAD является кофактором Оксидаза D-аминокислот через аналогичные эксперименты в 1938 г.[6] Работа Варбурга по связыванию никотинамида с переносом гидридов и открытие флавинов проложила путь для многих ученых в 40-х и 50-х годах, чтобы открыть огромное количество окислительно-восстановительной биохимии и связать их вместе такими путями, как цикл лимонной кислоты и АТФ синтез.
Характеристики
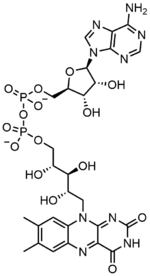
Флавинадениндинуклеотид состоит из двух основных частей: аденин нуклеотид (аденозинмонофосфат ) и флавинмононуклеотид объединились через их фосфат группы. Аденин связан с циклическим рибоза на 1' углерода, а фосфат связан с рибозой на 5' углерод с образованием нуклеедотида аденина. Рибофлавин образуется связью углерод-азот (C-N) между изоаллоксазин и рибитол. Затем фосфатная группа связывается с концевым углеродом рибозы с образованием FMN. Поскольку связь между изоаллоксазином и рибитолом не считается гликозидная связь, мононуклеотид флавина на самом деле не является нуклеотидом.[7] Это вводит в заблуждение название динуклеотида; однако мононуклеотидная группа флавина все еще очень близка к нуклеотиду по своей структуре и химическим свойствам.

FAD может быть уменьшенный в FADH2 путем добавления 2 H+ и 2 е−. FADH2 так же может быть окисленный потерей 1 H+ и 1 е− сформировать FADH. Форма FAD может быть воссоздана за счет дальнейшей потери 1 H+ и 1 е−. Образование FAD также может происходить за счет восстановления и дегидратации флавин-N (5) -оксида.[8] В зависимости от степени окисления флавины приобретают определенный цвет в водный раствор. флавин-N (5) -оксид (суперокисленный) желто-оранжевый, FAD (полностью окисленный) желтый, FADH (полу восстановленный) синий или красный в зависимости от pH, а полностью восстановленная форма бесцветна.[9][10] Изменение формы может сильно повлиять на другие химические свойства. Например, полностью окисленная форма FAD подлежит нуклеофильная атака, полностью восстановленная форма, FADH2 имеет высокий поляризуемость, в то время как полу восстановленная форма нестабильна в водном растворе.[11] FAD - это ароматный кольцевая система, тогда как FADH2 не является.[12] Это означает, что FADH2 значительно выше по энергии, без стабилизации через резонанс что обеспечивает ароматическая структура. FADH2 представляет собой молекулу, несущую энергию, потому что после окисления она восстанавливает ароматичность и высвобождает энергию, представленную этой стабилизацией.
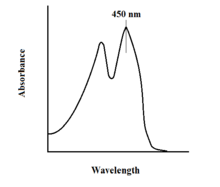
В спектроскопический свойства FAD и его вариантов позволяют контролировать реакцию с помощью УФ-видимое поглощение и флуоресценция спектроскопии. Каждая форма FAD имеет различные спектры поглощения, что упрощает наблюдение за изменениями в степени окисления.[11] Главный локальный максимум поглощения FAD наблюдается на длине волны 450 нм с коэффициентом экстинкции 11300.[13] В несвязанном состоянии флавины обычно обладают флуоресцентной активностью (белки, связанные с производными флавиновой нуклеиновой кислоты, называются флавопротеины ). Это свойство можно использовать при исследовании связывания с белками, наблюдая потерю флуоресцентной активности при переходе в связанное состояние.[11] Окисленные флавины имеют высокую оптическую плотность около 450 нм и флуоресцируют около 515-520 нм.[9]
Химические состояния
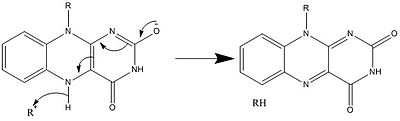
В биологических системах FAD действует как акцептор H+ и е− в полностью окисленной форме, акцептор или донор в форме FADH и донор в восстановленной FADH2 форма. На диаграмме ниже представлены возможные изменения, которым он может подвергнуться.
Наряду с тем, что показано выше, могут образовываться и потребляться другие реактивные формы FAD. Эти реакции включают перенос электронов и включение / выключение химические связи. Через механизмы реакции, FAD может способствовать химической активности в биологических системах. На следующих рисунках показаны общие формы некоторых действий, в которых может участвовать FAD.
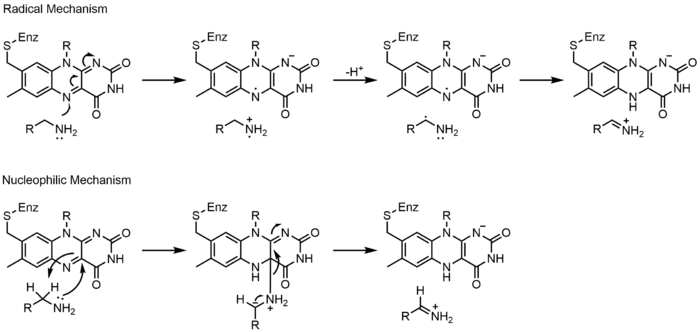
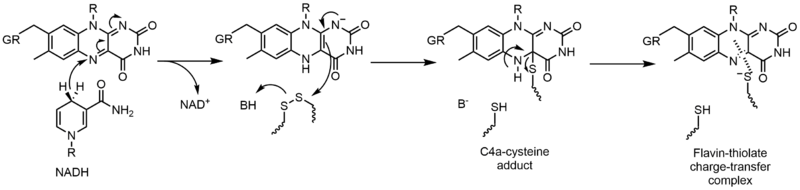
Механизмы 1 и 2 представляют гидрид усиление, при котором молекула получает то, что составляет один ион гидрида. Механизмы 3 и 4 радикальное образование и потери гидридов. Радикальные частицы содержат неспаренные электронные атомы и очень химически активны. Потеря гидридов - это процесс, обратный увеличению гидридов, наблюдаемый ранее. Последние два механизма показывают нуклеофильное присоединение и реакция с использованием углеродного радикала.




Биосинтез
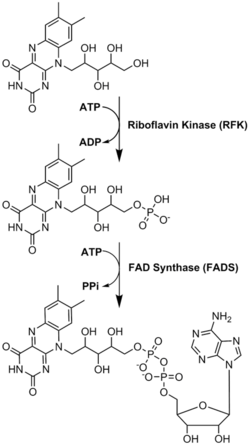
ФАД играет важную роль как фермент кофактор вместе с флавинмононуклеотид, другая молекула, происходящая из рибофлавина.[8] Бактерии, грибы и растения могут производить рибофлавин, но другие эукариоты, такие как люди, потеряли способность делать это.[9] Следовательно, люди должны получать рибофлавин, также известный как витамин В2, из пищевых источников.[14] Рибофлавин обычно попадает в тонкий кишечник, а затем транспортируется в клетки через белки-носители.[9] Рибофлавин киназа (EC 2.7.1.26) добавляет к рибофлавину фосфатную группу для получения флавинмононуклеотида, а затем ФАД синтетаза присоединяет аденин нуклеотид; оба шага требуют АТФ.[9] Бактерии обычно имеют один бифункциональный фермент, но археи а эукариоты обычно используют два разных фермента.[9] Текущие исследования показывают, что разные изоформы существуют в цитозоль и митохондрии.[9] Похоже, что FAD синтезируется в обоих местах и потенциально транспортируется туда, где это необходимо.[11]
Функция
Флавопротеины используют уникальную и универсальную структуру флавиновых фрагментов для катализирования сложных окислительно-восстановительных реакций. Поскольку флавины имеют несколько окислительно-восстановительных состояний, они могут участвовать в процессах, включающих перенос одного или двух электронов, атомов водорода или гидроксоний ионы. N5 и C4a полностью окисленного флавинового кольца также восприимчивы к нуклеофильная атака.[15] Такое широкое разнообразие ионизации и модификации флавиновой части может быть связано с изоаллоксазиновой кольцевой системой и способностью флавопротеинов резко нарушать кинетические параметры флавинов при связывании, включая флавинадениндинуклеотид (FAD).
Количество генов, кодируемых флавин-зависимыми белками, в геноме (флавопротеом) зависит от вида и может варьироваться от 0,1% до 3,5%, при этом у людей имеется 90 генов, кодируемых флавопротеинами.[16] ФАД - более сложная и распространенная форма флавина, которая, как сообщается, связывается с 75% всего флавопротеома.[16] и 84% флавопротеинов, кодируемых человеком.[17] Сообщалось о клеточных концентрациях свободных или нековалентно связанных флавинов в различных культивируемых линиях клеток млекопитающих для FAD (2,2-17,0 амоль / клетка) и FMN (0,46-3,4 амоль / клетка).[18]
FAD имеет более позитивный потенциал сокращения чем НАД + и является очень сильным окислителем. В ячейке это используется во многих энергетически сложных реакциях окисления, таких как дегидрирование связи C-C до алкен. FAD-зависимые белки участвуют в большом количестве метаболических путей, включая транспорт электронов, репарацию ДНК, биосинтез нуклеотидов, бета-окисление жирных кислот, катаболизма аминокислот, а также синтеза других кофакторов, таких как CoA, CoQ и гем группы. Одна хорошо известная реакция является частью цикл лимонной кислоты (также известный как цикл TCA или Кребса); сукцинатдегидрогеназа (комплекс II в электронная транспортная цепь ) требует, чтобы ковалентно связанный FAD катализировал окисление сукцинат к фумарат сочетая его с уменьшением убихинон к убихинол.[11] Электроны с высокой энергией от этого окисления мгновенно сохраняются за счет восстановления FAD до FADH.2. FADH2 затем возвращается к FAD, посылая два своих высокоэнергетических электрона через цепь переноса электронов; энергия в FADH2 достаточно для производства 1,5 эквивалента АТФ[19] к окислительного фосфорилирования. Некоторые редокс-флавопротеины нековалентно связываются с ФАД, как Ацетил-КоА-дегидрогеназы которые участвуют в бета-окисление жирных кислот и катаболизма аминокислот, таких как лейцин (изовалерил-КоА дегидрогеназа ), изолейцин, (ацил-КоА дегидрогеназа с короткой / разветвленной цепью), валин (изобутирил-КоА дегидрогеназа), и лизин (глутарил-КоА дегидрогеназа ).[20] Дополнительные примеры FAD-зависимых ферментов, регулирующих метаболизм: глицерин-3-фосфатдегидрогеназа (синтез триглицеридов) и ксантиноксидаза участвует в пурин катаболизм нуклеотидов.[21] Некаталитические функции, которые FAD может играть во флавопротеинах, включают в себя структурные роли или участие в чувствительном к синему свету фоторецепторы которые регулируют биологические часы и развитие, генерация света в биолюминесцентный бактерии.[20]
Флавопротеины
Флавопротеины иметь либо FMN или молекула FAD в качестве простетической группы, эта простетическая группа может быть тесно связана или ковалентно связана. Только около 5-10% флавопротеинов имеют ковалентно связанный FAD, но эти ферменты обладают более сильной окислительно-восстановительной силой.[11] В некоторых случаях FAD может обеспечивать структурную поддержку активных центров или обеспечивать стабилизацию промежуточных продуктов во время катализа.[20] На основании имеющихся структурных данных известные сайты связывания FAD можно разделить более чем на 200 типов.[22]
В геноме человека кодируется 90 флавопротеинов; около 84% требуют FAD, около 16% - FMN, тогда как 5 белков требуют наличия обоих.[17] Флавопротеины в основном расположены в митохондрии из-за их окислительно-восстановительной способности.[17] Из всех флавопротеинов 90% выполняют окислительно-восстановительные реакции, а остальные 10% являются трансферазы, лиасы, изомеразы, лигазы.[16]
Окисление связей углерод-гетероатом
Углерод-азот
Моноаминоксидаза (МАО) - это широко изученный флавоэнзим из-за его биологической важности для катаболизм из норэпинефрин, серотонин и дофамин. МАО окисляет первичные, вторичные и третичные амины, которые неферментативно гидролизуются из я добываю к альдегид или же кетон. Несмотря на то, что этот класс ферментов широко изучен, механизм его действия все еще обсуждается. Было предложено два механизма: радикальный и нуклеофильный. Радикальный механизм менее общепринят, потому что нет спектральных или электронный парамагнитный резонанс существуют доказательства наличия радикального промежуточного соединения. Нуклеофильный механизм более предпочтителен, потому что он поддерживается сайт-направленный мутагенез исследования, в которых мутировали два остатка тирозина, которые, как ожидалось, увеличили нуклеофильность субстратов.[23]
Углерод-кислород
Глюкозооксидаза (GOX) катализирует окисление β-D-глюкозы до D-глюконо-δ-лактон с одновременным восстановлением связанного с ферментом флавина. GOX существует в виде гомодимера, каждая субъединица которого связывает одну молекулу FAD. Кристаллические структуры показывают, что FAD связывается в глубоком кармане фермента вблизи границы раздела димеров. Исследования показали, что при замене FAD на 8-гидрокси-5-карба-5-деаза FAD стереохимия реакции определялась взаимодействием с повторно лицо флавина. Во время оборота наблюдаются нейтральные и анионные семихиноны, что указывает на радикальный механизм.[23]
Углерод-сера
Пренилцистеинлиаза (PCLase) катализирует расщепление пренилцистеина (модификация белка) с образованием изопреноидного альдегида и освобожденного остатка цистеина на белке-мишени. FAD нековалентно связан с PCLase. Было проведено не так много механистических исследований, посвященных реакциям флавина, но предлагаемый механизм показан ниже. Предлагается перенос гидрида от C1 пренильного фрагмента к FAD, что приводит к восстановлению флавина до FADH.2. COformED - это карбокатион который стабилизируется соседним атомом серы. FADH2 затем вступает в реакцию с молекулярным кислородом, чтобы восстановить окисленный фермент.[23]
Углерод-углерод
UDP-N-ацетиленолпирувилглюкозамин редуктаза (MurB) представляет собой фермент, который катализирует НАДФН-зависимое восстановление энолпирувил-UDP-N-ацетилглюкозамина (субстрат) до соответствующего D-лактильного соединения UDP-N-ацетилмурамовая кислота (продукт). MurB является мономером и содержит одну молекулу FAD. Прежде чем субстрат можно будет преобразовать в продукт, НАДФН должен сначала уменьшить FAD. Однажды НАДП+ диссоциирует, субстрат может связываться, а восстановленный флавин может восстанавливать продукт.[23]
Химия тиолов / дисульфидов
Глутатионредуктаза (GR) катализирует восстановление дисульфида глутатиона (GSSG) до глутатиона (GSH). GR требует FAD и NADPH для облегчения этой реакции; сначала гидрид должен быть переведен из НАДФН в ФАД. Восстановленный флавин может тогда действовать как нуклеофил чтобы атаковать дисульфид, он образует аддукт C4a-цистеин. Удаление этого аддукта приводит к образованию комплекса с переносом заряда флавин-тиолат.[23]
Реакции электронного переноса
Цитохром P450 Ферменты типа, которые катализируют реакции монооксигеназы (гидроксилирования), зависят от переноса двух электронов от FAD к P450. У эукариот обнаружены два типа систем P450. Системы P450, расположенные в эндоплазматическом ретикулуме, зависят от цитохром Р-450 редуктаза (CPR), который содержит как FAD, так и FMN. Два электрона на восстановленном FAD (FADH2) передаются по одному в FMN, а затем один электрон передается из FMN в гем P450.[24]
Системы P450, которые расположены в митохондриях, зависят от двух белков переноса электронов: FAD, содержащего адренодоксинредуктаза (AR) и небольшой белок, содержащий железо-серу, названный адренодоксин. FAD встроен в FAD-связывающий домен AR.[25][26] FAD AR снижается до FADH2 путем переноса двух электронов от НАДФН, который связывается в НАДФ-связывающем домене AR. Структура этого фермента высококонсервативна, чтобы поддерживать точное выравнивание донора электронов NADPH и акцептора FAD для эффективного переноса электронов.[26] Два электрона в восстановленном FAD передаются один раз адренодоксину, который, в свою очередь, отдает один электрон гемовой группе митохондриального P450.[27]
Структуры редуктазы микросом по сравнению с редуктазой митохондриальной системы P450 полностью различаются и не обнаруживают гомологии.[24]
Редокс
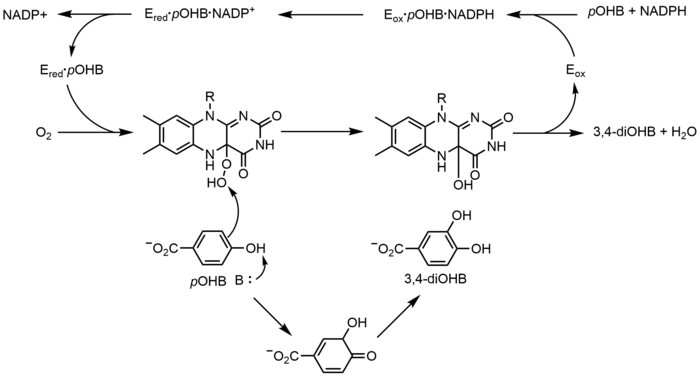
п-Гидроксибензоатгидроксилаза (PHBH) катализирует оксигенацию п-гидроксибензоат (пОНВ) до 3,4-дигидроксибензоата (3,4-диОНВ); Для этой реакции требуются FAD, NADPH и молекулярный кислород. NADPH сначала передает гидридный эквивалент FAD, создавая FADH−, а затем НАДФ+ отделяется от фермента. Восстановленный PHBH затем реагирует с молекулярным кислородом с образованием флавин-C (4a) -гидропероксида. Гидропероксид флавина быстро гидроксилирует пOHB, а затем удаляет воду для регенерации окисленного флавина.[23] Альтернативный механизм оксигенации, опосредованный флавинами, включает использование флавин-N (5) -оксид а не флавин-C (4a) - (гидро) пероксид.[2][3]
Nonredox
Хоризмат-синтаза (CS) катализирует последний шаг в путь шикимата - формирование хоризмата. Известны два класса CS, для каждого из которых требуется FMN, но их потребности в НАДФН в качестве восстановителя разделились. Предлагаемый механизм CS включает радикальные частицы. Радикальные разновидности флавина не были обнаружены спектроскопически без использования аналога субстрата, что позволяет предположить, что он является недолговечным. Однако при использовании фторированного субстрата был обнаружен нейтральный флавин семихинон.[23]
Комплексные флавоэнзимы
Глутаматсинтаза катализирует превращение 2-оксоглутарата в L-глутамат, при этом L-глутамин служит источником азота для реакции. Все синтезы глутамата представляют собой флавопротеины железо-сера, содержащие железо-серный кластер и FMN. Три класса синтеза глутамата классифицируются на основе их последовательностей и биохимических свойств. Несмотря на то, что существует три класса этого фермента, считается, что все они действуют посредством одного и того же механизма, отличаясь только тем, что первым снижает FMN. Фермент производит две молекулы глутамата: одну за счет гидролиза глутамина (с образованием глутамата и аммиака), а вторую за счет аммиака, полученного в первой реакции, атакующей 2-оксоглутарат, который восстанавливается FMN до глутамата.[23]
Клиническое значение
Из-за важности флавопротеины неудивительно, что примерно 60% флавопротеинов человека при мутации вызывают заболевания человека.[17] В некоторых случаях это связано с уменьшением близость для FAD или FMN, и поэтому избыточное потребление рибофлавина может уменьшить симптомы заболевания, например, множественный дефицит ацил-КоА-дегидрогеназы.[9] Кроме того, сам дефицит рибофлавина (и, как следствие, отсутствие FAD и FMN) может вызвать проблемы со здоровьем.[9] Например, в ALS У пациентов наблюдается снижение уровня синтеза ФАД.[9] Оба эти пути могут привести к множеству симптомов, в том числе к аномалиям развития или желудочно-кишечного тракта, ошибочным расщепление жира, анемия, неврологические проблемы, рак или же сердечное заболевание, мигрень, ухудшение зрения и кожные поражения.[9] Поэтому в некоторых случаях фармацевтическая промышленность производит рибофлавин для дополнения рациона. В 2008 году мировая потребность в рибофлавине составляла 6000 тонн в год, а производственная мощность - 10 000 тонн.[4] Этот рынок стоимостью от 150 до 500 миллионов долларов предназначен не только для медицинских приложений, но также используется в качестве добавки к корму для животных в сельскохозяйственной промышленности и в качестве пищевой краситель.[4]
Дизайн лекарств
Новый дизайн Применение антибактериальных препаратов имеет постоянное значение в научных исследованиях, поскольку устойчивость бактериальных антибиотиков к обычным антибиотикам возрастает. Специфический метаболический белок, использующий FAD (Комплекс II ) имеет жизненно важное значение для бактериальной вирулентности, поэтому нацеливание на синтез FAD или создание аналогов FAD может быть полезной областью исследования.[28] Ученые уже определили две структуры, которые FAD обычно предполагает при связывании: либо вытянутую, либо форму бабочки, в которой молекула по существу складывается пополам, что приводит к наложению адениновых и изоаллоксазиновых колец.[14] Имитаторы FAD, которые способны связываться аналогичным образом, но не разрешают функцию белка, могут быть полезными механизмами ингибирования бактериальной инфекции.[14] С другой стороны, той же цели можно достичь лекарствами, блокирующими синтез ФАД; это особенно интригует, потому что синтез человеческого и бактериального FAD зависит от очень разных ферментов, а это означает, что лекарство, созданное для нацеливания на бактериальную FAD-синтазу, вряд ли будет влиять на ферменты FAD-синтазы человека.[29]
Оптогенетика
Оптогенетика позволяет контролировать биологические события неинвазивным способом.[30] В последние годы в этой области появился ряд новых инструментов, в том числе для активации светочувствительности, таких как домены FAD, использующие синий свет (BLUF). BLUF кодируют от 100 до 140 аминокислота последовательность, которая была получена из фоторецепторов растений и бактерий.[30] Подобно другим фоторецепторы, свет вызывает структурные изменения в BLUF-домене, что приводит к нарушению последующих взаимодействий.[30] Текущие исследования исследуют белки с добавленным доменом BLUF и то, как различные внешние факторы могут влиять на белки.[30]
Мониторинг лечения
В организме есть ряд молекул, обладающих естественным флуоресценция включая триптофан, коллаген, FAD, НАДН и порфирины.[31] Ученые воспользовались этим, используя их для отслеживания прогрессирования заболевания, эффективности лечения или помощи в диагностике. Например, собственная флуоресценция FAD и NADH варьируется в нормальной ткани и оральный подслизистый фиброз, что является ранним признаком инвазивного рак ротовой полости.[31] Поэтому врачи использовали флуоресценцию для диагностики и мониторинга лечения, в отличие от стандартных биопсия.[31]
Дополнительные изображения

FADH2
Смотрите также
Рекомендации
- ^ Тойфель, Робин; Агарвал, Винаяк; Мур, Брэдли С. (2016-04-01). «Необычный флавоэнзимный катализ у морских бактерий». Современное мнение в области химической биологии. 31: 31–39. Дои:10.1016 / j.cbpa.2016.01.001. ISSN 1879-0402. ЧВК 4870101. PMID 26803009.
- ^ а б Teufel, R; Миянага, А; Michaudel, Q; Стулл, Ф; Луи, G; Ноэль, JP; Баран, ПС; Палфей, Б; Мур, BS (28 ноября 2013 г.). «Опосредованное флавином двойное окисление контролирует ферментативную перегруппировку типа Фаворского». Природа. 503 (7477): 552–6. Дои:10.1038 / природа12643. ЧВК 3844076. PMID 24162851.
- ^ а б Тойфель, Робин; Стулл, Фредерик; Михан, Майкл Дж .; Мишодель, Квентин; Dorrestein, Pieter C .; Палфей, Брюс; Мур, Брэдли С. (01.07.2015). «Биохимическое создание и характеристика кофактора флавин-N5-оксида EncM». Журнал Американского химического общества. 137 (25): 8078–8085. Дои:10.1021 / jacs.5b03983. ISSN 1520-5126. ЧВК 4720136. PMID 26067765.
- ^ а б c Аббас ЦА, Сибирский АА (июн 2011 г.). «Генетический контроль биосинтеза и транспорта нуклеотидов рибофлавина и флавина и создание надежных биотехнологических производителей». Обзоры микробиологии и молекулярной биологии. 75 (2): 321–60. Дои:10.1128 / ммр. 00030-10. ЧВК 3122625. PMID 21646432.
- ^ Хаяси Х (2013). Витамины группы В и фолиевая кислота: химический состав, анализ, функции и эффекты. Кембридж, Великобритания: Королевское химическое общество. п. 7. ISBN 978-1-84973-369-4.
- ^ Варбург О., Кристиан В. (1938). «Выделение простетической группы аминокислотной оксидазы». Biochemische Zeitschrift. 298: 150–168.
- ^ Метцлер Д.Е., Метцлер С.М., Саук Д.Д. (2003). Биохимия (2-е изд.). Сан-Диего: Harcourt, Academic Press. ISBN 978-0-12-492541-0.
- ^ а б Девлин TM (2011). Учебник биохимии: с клиническими корреляциями (7-е изд.). Хобокен, Нью-Джерси: Джон Уайли и сыновья. ISBN 978-0-470-28173-4.
- ^ а б c d е ж грамм час я j k Бариле М., Джанкасперо Т.А., Брицио С., Панебианко С., Индивери С., Галлуччо М., Вергани Л., Эберини И., Джанацца Е. (2013). «Биосинтез кофакторов флавина в человеке: последствия для здоровья и болезней». Текущий фармацевтический дизайн. 19 (14): 2649–75. Дои:10.2174/1381612811319140014. PMID 23116402.
- ^ Тойфель, Робин; Миянага, Акимаса; Мишодель, Квентин; Стулл, Фредерик; Луи, Гордон; Ноэль, Джозеф П .; Baran, Phil S .; Палфей, Брюс; Мур, Брэдли С. (28 ноября 2013 г.). «Опосредованное флавином двойное окисление контролирует ферментативную перегруппировку типа Фаворского». Природа. 503 (7477): 552–556. Дои:10.1038 / природа12643. ISSN 1476-4687. ЧВК 3844076. PMID 24162851.
- ^ а б c d е ж Ким HJ, Winge DR (май 2013 г.). «Новые концепции флавинилирования сукцинатдегидрогеназы». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1827 (5): 627–36. Дои:10.1016 / j.bbabio.2013.01.012. ЧВК 3626088. PMID 23380393.
- ^ Лю С. (2012). Биопроцессная инженерия: кинетика, устойчивость и конструкция реактора. Newnes. ISBN 978-0-444-63783-3.
- ^ Льюис Дж. А., Эскаланте-Семерена Дж. С. (август 2006 г.). «Фермент FAD-зависимая трикарбаллилатдегидрогеназа (TcuA) Salmonella enterica превращает трикарбаллилат в цис-аконитат». Журнал бактериологии. 188 (15): 5479–86. Дои:10.1128 / jb.00514-06. ЧВК 1540016. PMID 16855237.
- ^ а б c Куппурадж Г., Круиз Д., Юра К. (ноябрь 2014 г.). «Конформационное поведение динуклеотида флавинаденин: консервативная стереохимия в связанном и свободном состояниях». Журнал физической химии B. 118 (47): 13486–97. Дои:10.1021 / jp507629n. PMID 25389798.
- ^ Монтейра М (2013). Витамины группы В и фолиевая кислота: химический состав, анализ, функции и эффекты. Кембридж, Великобритания: Королевское химическое общество.п. 94. ISBN 978-1-84973-369-4.
- ^ а б c Macheroux P, Kappes B, Ealick SE (август 2011 г.). «Флавогеномика - геномный и структурный взгляд на флавин-зависимые белки». Журнал FEBS. 278 (15): 2625–34. Дои:10.1111 / j.1742-4658.2011.08202.x. PMID 21635694. S2CID 22220250.
- ^ а б c d Линхарт WD, Гудипати V, Macheroux P (июль 2013 г.). «Флавопротеом человека». Архивы биохимии и биофизики. 535 (2): 150–62. Дои:10.1016 / j.abb.2013.02.015. ЧВК 3684772. PMID 23500531.
- ^ Hühner J, Ingles-Prieto Á, Neusüß C, Lämmerhofer M, Janovjak H (февраль 2015 г.). «Количественная оценка рибофлавина, флавинмононуклеотида и флавинадениндинуклеотида в модельных клетках млекопитающих с помощью CE с детектированием индуцированной светодиодами флуоресценции». Электрофорез. 36 (4): 518–25. Дои:10.1002 / elps.201400451. PMID 25488801. S2CID 27285540.
- ^ Страйер Л., Берг Дж. М., Тимочко Дж. Л. (2007). Биохимия (6-е изд.). Нью-Йорк: Фриман. ISBN 978-0-7167-8724-2.
- ^ а б c Мансурабади С.О., Тибодо С.Дж., Лю Х.В. (август 2007 г.). «Разнообразные роли флавиновых коферментов - самых разносторонних персонажей природы». Журнал органической химии. 72 (17): 6329–42. Дои:10.1021 / jo0703092. ЧВК 2519020. PMID 17580897.
- ^ Король МВ. «Витамины, минералы, добавки». Страница медицинской биохимии.
- ^ Гарма, Леонардо Д .; Медина, Милагрос; Джуффер, Андре Х. (01.11.2016). «Структурная классификация сайтов связывания FAD: сравнительное исследование инструментов структурного выравнивания». Белки: структура, функции и биоинформатика. 84 (11): 1728–1747. Дои:10.1002 / prot.25158. ISSN 1097-0134. PMID 27580869. S2CID 26066208.
- ^ а б c d е ж грамм час Фаган Р.Л., Палфей Б.А. (2010). «Флавин-зависимые ферменты». Комплексные природные продукты II, химия и биология. 7: 37–113.
- ^ а б Ханукоглу I (1996). «Белки электронного переноса систем цитохрома Р450» (PDF). Adv. Мол. Cell Biol. Достижения в молекулярной и клеточной биологии. 14: 29–55. Дои:10.1016 / S1569-2558 (08) 60339-2. ISBN 9780762301133.
- ^ Циглер Г.А., Фонрайн К., Ханукоглу И., Шульц Г.Э. (июнь 1999 г.). «Структура адренодоксинредуктазы митохондриальных систем P450: перенос электрона для биосинтеза стероидов». Журнал молекулярной биологии. 289 (4): 981–90. Дои:10.1006 / jmbi.1999.2807. PMID 10369776.
- ^ а б Ханукоглу I (2017). «Сохранение интерфейсов фермент-кофермент в FAD и NADP-связывающем адренодоксинредуктазе-А повсеместном ферменте». Журнал молекулярной эволюции. 85 (5): 205–218. Дои:10.1007 / s00239-017-9821-9. PMID 29177972. S2CID 7120148.
- ^ Ханукоглу И., Джефкоат ЧР (апрель 1980 г.). «Митохондриальный цитохром P-450scc. Механизм переноса электронов адренодоксином» (PDF). Журнал биологической химии. 255 (7): 3057–61. PMID 6766943.
- ^ Макнил МБ, Fineran PC (май 2013 г.). «Прокариотические факторы сборки для присоединения флавина к комплексу II». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1827 (5): 637–47. Дои:10.1016 / j.bbabio.2012.09.003. PMID 22985599.
- ^ Серрано А., Феррейра П., Мартинес-Хульвес М., Медина М. (2013). «Семейство прокариотических FAD-синтетаз: потенциальная мишень для лекарств». Текущий фармацевтический дизайн. 19 (14): 2637–48. Дои:10.2174/1381612811319140013. PMID 23116401.
- ^ а б c d Кристи Дж. М., Гоуторн Дж., Янг Дж., Фрейзер Н. Дж., Роу А. Дж. (Май 2012 г.). «LOV для BLUF: вклад флавопротеинов в оптогенетический инструментарий». Молекулярный завод. 5 (3): 533–44. Дои:10.1093 / mp / sss020. PMID 22431563.
- ^ а б c Сивабалан С., Ведесвари С.П., Джаячандран С., Котесваран Д., Правда С., Аруна П.Р., Ганесан С. (2010). «Спектроскопия нативной флуоресценции in vivo и состояние восстановления и окисления подслизистого фиброза полости рта с никотинамид-адининдинуклеотидом / флавинаденин-динуклеотидом для химиопрофилактического мониторинга лекарственных средств». Журнал биомедицинской оптики. 15 (1): 017010. Дои:10.1117/1.3324771. PMID 20210484.
внешняя ссылка
- FAD связан с белками в PDB
- FAD запись в химической базе данных NIH