Мембранный электролиз полимерного электролита - Википедия - Polymer electrolyte membrane electrolysis
| Мембранный электролиз полимерного электролита | |
|---|---|
 Схема реакций электролиза ПЭМ. | |
| Типичные материалы | |
| Тип электролиза: | Электролиз PEM |
| Стиль мембраны / диафрагмы | Твердый полимер |
| Материал биполярной / разделительной пластины | Титан или золото и титан с платиновым покрытием |
| Катализатор на аноде | Иридий |
| Катализатор на катоде | Платина |
| Материал анода PTL | Титан |
| Катодный материал ПТЛ | Копировальная бумага / углеродный флис |
| Современные рабочие диапазоны | |
| Температура ячейки | 50-80С[1] |
| Давление в штабеле | <30 бар[1] |
| Плотность тока | 0,6-2,0 А / см2[1] |
| Напряжение ячейки | 1,75–2,20 В[1] |
| Удельная мощность | до 4,4 Вт / см2[1] |
| Диапазон частичной нагрузки | 0-10%[1] |
| Удельный расход энергии стек | 4,2-5,6 кВтч / Нм3[1] |
| Система удельного энергопотребления | 4,5-7,5 кВтч / Нм3[1] |
| Эффективность напряжения ячейки | 57-69%[1] |
| Скорость производства водорода в системе | 30 Нм3/час[1] |
| Пожизненный стек | <20,000 ч[1] |
| Приемлемая скорость деградации | <14 мкВ / ч[1] |
| Срок службы системы | 10-20 лет[1] |
Полимерная электролитная мембрана (ПЭМ) электролиз это электролиз воды в ячейке с твердым полимерным электролитом (ТПЭ)[2] который отвечает за прохождение протонов, отделение продуктовых газов и электрическую изоляцию электродов. Электролизер PEM был введен для решения проблем частичной нагрузки, низкой плотности тока и работы при низком давлении, которые в настоящее время мешают щелочному электролизеру.[3][1] Это включает протонообменная мембрана.
Однако недавнее научное сравнение показало, что современные электролиз щелочной воды демонстрирует конкурентоспособную или даже лучшую эффективность, чем электролиз воды из ПЭМ.[4] Более того, это сравнение показало, что многие из преимуществ, таких как чистота газа или высокие плотности тока, которые были приписаны электролизу воды из ПЭМ, также достижимы с помощью электролиз щелочной воды. Электролиз это важная технология для производство водорода для использования в качестве энергоносителя.
Благодаря быстрому динамическому времени отклика, широкому рабочему диапазону и высокой эффективности электролиз воды является многообещающей технологией для хранения энергии в сочетании с возобновляемыми источниками энергии.
История
Использование PEM для электролиза было впервые представлено в 1960-х годах компанией General Electric, разработанным для преодоления недостатков технологии щелочного электролиза.[5] Первоначальные характеристики дали 1,88 В при 1,0 А / см.2 что было по сравнению с щелочной электролиз технология того времени, очень производительная. В конце 1970-х годов щелочные электролизеры сообщали о производительности около 2,06 В при 0,215 А / см.2,[6] это вызвало внезапный интерес в конце 1970-х - начале 1980-х годов к полимерным электролитам для электролиза воды.
Подробный обзор исторических показателей от ранних исследований до сегодняшнего дня можно найти в хронологическом порядке со многими рабочими условиями в обзоре Кармо и др. За 2013 год.[1]
Преимущества электролиза ПЭМ
Одним из самых больших преимуществ электролиза PEM является его способность работать при высоких плотностях тока.[1] Это может привести к снижению эксплуатационных расходов, особенно для систем, связанных с очень динамичными источниками энергии, такими как ветер и солнце, где внезапные всплески подводимой энергии в противном случае привели бы к неуловленной энергии. Полимерный электролит позволяет электролизеру PEM работать с очень тонкой мембраной (~ 100-200 мкм), сохраняя при этом высокое давление, что приводит к низким омическим потерям, в первую очередь вызванным проводимостью протонов через мембрану (0,1 См / см) и а сжатый водород выход.[7]
Мембрана из полимерного электролита, благодаря своей твердой структуре, демонстрирует низкую скорость перехода газа, что приводит к очень высокой чистоте газообразного продукта.[1] Поддержание высокой чистоты газа важно для безопасности хранения и для непосредственного использования в топливных элементах. Пределы безопасности для H2 я не2 находятся в стандартных условиях 4мол-% ЧАС2 я не2.[8]
Наука
Электролизер - это электрохимическое устройство для преобразования электричества и воды в водород и кислород, эти газы затем можно использовать в качестве средства для хранения энергии для дальнейшего использования. Это использование может варьироваться от стабилизации электрической сети от динамических источников электроэнергии, таких как ветряные турбины и солнечные элементы, до локальных производство водорода как топливо для автомобили на топливных элементах. В электролизере PEM используется твердый полимерный электролит (ТПЭ) проводить протоны от анода к катоду при электрической изоляции электродов. Под стандартные условия в энтальпия необходимое для образования воды составляет 285,9 кДж / моль. Часть энергии, необходимой для продолжительной реакции электролиза, обеспечивается тепловой энергией, а остальная часть - электрической энергией.[9]
Реакции
Фактическое значение напряжения холостого хода работающего электролизера будет находиться в диапазоне от 1,23 В до 1,48 В в зависимости от того, как конструкция элемента / батареи использует тепловую энергию. Однако это довольно сложно определить или измерить, потому что работающий электролизер также испытывает другие потери напряжения из-за внутренних электрические сопротивления, протонная проводимость, массоперенос через ячейку и использование катализатора, и это лишь некоторые из них.
Анодная реакция
Половина реакции, протекающей на анодной стороне электролизера PEM, обычно называется реакцией выделения кислорода (OER). Здесь жидкий водный реагент подается на катализатор, где подаваемая вода окисляется до кислорода, протонов и электронов.
Катодная реакция
Половинная реакция, происходящая на катодной стороне электролизера PEM, обычно называется реакцией выделения водорода (HER). Здесь подводимые электроны и протоны, которые прошли через мембрану, объединяются для создания газообразного водорода.
На приведенном ниже рисунке показано упрощение того, как работает электролиз PEM, показывая отдельные полуреакции вместе с полной реакцией электролизера PEM. В этом случае электролизер соединен с солнечной панелью для производство водорода Однако солнечную панель можно заменить любым источником электроэнергии.

Второй закон термодинамики
В соответствии с второй закон термодинамики в энтальпия реакции:
Где это Свободная энергия Гиббса реакции, - температура реакции и изменение в энтропия системы.
Общая реакция ячейки с вводом термодинамической энергии становится следующей:
Показанные выше тепловые и электрические вводы представляют собой минимальное количество энергии, которое может быть доставлено электричеством для проведения реакции электролиза. Если предположить, что в реакцию поступает максимальное количество тепловой энергии (48,6 кДж / моль), обратимое напряжение ячейки можно рассчитать.
Напряжение холостого хода (OCV)
куда это количество электронов и является Постоянная Фарадея. Расчет напряжения ячейки, предполагающий, что не существует необратимых факторов и вся тепловая энергия используется в реакции, называется нижней теплотворной способностью (LHV). Альтернативный состав с использованием более высокой теплотворной способности (HHV) рассчитывается исходя из предположения, что вся энергия для запуска реакции электролиза обеспечивается электрическим компонентом требуемой энергии, что приводит к более высокому обратимому напряжению элемента. При использовании HHV расчет напряжения называется термонейтральное напряжение.
Потери напряжения
Производительность электролизеров, например топливные элементы, обычно сравниваются путем построения их поляризационных кривых, которые получают путем построения графика зависимости напряжения ячейки от плотности тока. Первичные источники повышенного напряжения в электролизере PEM (то же самое относится и к Топливные элементы PEM ) можно разделить на три основные области: Омические потери, потери при активации и потери при массовом транспорте. Из-за реверсирования работы топливного элемента с PEM и электролизера с PEM степень воздействия этих различных потерь в этих двух процессах различна.[1]
Производительность системы электролиза PEM обычно сравнивается путем построения графика перенапряжения в зависимости от ячеек. плотность тока. По сути, это приводит к кривой, которая представляет мощность на квадратный сантиметр площади ячейки, необходимую для производства водород и кислород. В отличие от Топливный элемент PEM, чем лучше электролизер ПЭМ, тем ниже напряжение ячейки при данном плотность тока. Рисунок ниже является результатом моделирования из Forschungszentrum Jülich 25 см2 одноэлементный электролизер с ПЭМ в термонейтральном режиме с изображением основных источников потери напряжения и их вкладов в диапазоне текущие плотности.
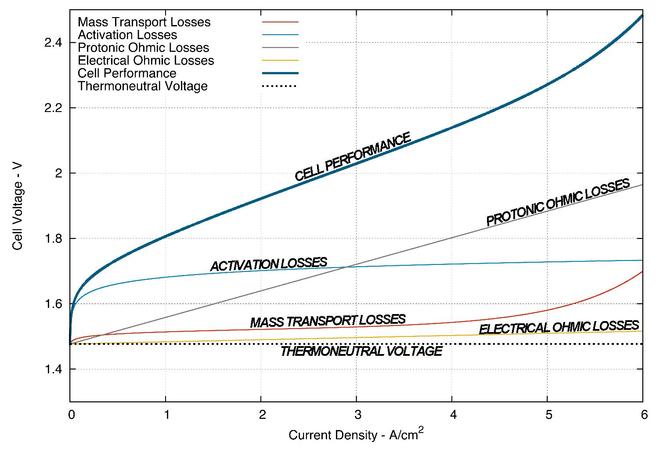
Омические потери
Омические потери - это электрическое перенапряжение, вносимое в процесс электролиза внутренним сопротивлением компонентов ячейки. Затем эта потеря требует дополнительного напряжения для поддержания электролиз реакция, предсказание этой потери следует Закон Ома и имеет линейную зависимость от плотность тока действующего электролизера.
Потери энергии из-за электрического сопротивления не теряются полностью. Падение напряжения из-за удельного сопротивления связано с преобразованием электрической энергии в тепловую посредством процесса, известного как Джоулевое нагревание. Большая часть этой тепловой энергии уносится с подачей реагирующей воды и теряется в окружающую среду, однако небольшая часть этой энергии затем возвращается в виде тепловой энергии в процессе электролиза. Количество тепловой энергии, которая может быть возвращена, зависит от многих аспектов работы системы и конструкции ячейки.
Омические потери из-за проводимости протонов вносят вклад в потерю эффективности, которая также следует Закон Ома, однако без Джоулевое нагревание эффект. Протонная проводимость PEM очень зависит от гидратации, температуры, термической обработки и ионного состояния мембраны.[10]
Фарадеевские потери и кроссовер
Фарадеевские потери описывают потери эффективности, которые коррелируют с током, подаваемым без попадания водорода на выходе катодного газа. Образующиеся водород и кислород могут проникать через мембрану, что называется кроссовером.[10] В результате на электродах происходит смешение обоих газов. На катоде кислород может каталитически реагировать с водородом на платиновой поверхности катодного катализатора. На аноде водород и кислород не реагируют на катализаторе из оксида иридия.[10] Таким образом, может возникнуть угроза безопасности из-за взрывоопасных анодных смесей водорода с кислородом. Энергия, подаваемая на производство водорода, теряется, когда водород теряется из-за реакции с кислородом на катоде и проникновения от катода через мембрану к аноду. Следовательно, соотношение количества потерянного и произведенного водорода определяет фарадеевские потери. При работе электролизера с повышенным давлением кроссовер и соответствующие фарадеевские потери КПД увеличиваются.[10]
Сжатие водорода при электролизе воды
Выделение водорода из-за электролиза под давлением сравнимо с процессом изотермического сжатия, который с точки зрения эффективности предпочтительнее механического изотропического сжатия.[10] Однако вклад вышеупомянутых фарадеевских потерь увеличивается с увеличением рабочего давления. Таким образом, чтобы произвести сжатый водород, сжатие на месте во время электролиза и последующее сжатие газа необходимо учитывать с точки зрения эффективности.
Работа системы электролиза ПЭМ

Способность электролизера PEM работать не только в высокодинамичных условиях, но также в условиях частичной нагрузки и перегрузки является одной из причин недавнего возобновления интереса к этой технологии. Потребности в электрической сети относительно стабильны и предсказуемы, однако, когда они связаны с источниками энергии, такими как ветер и солнце, потребность в сети редко совпадает с производством возобновляемой энергии. Это означает, что энергия, производимая из возобновляемых источников, таких как ветер и солнце, должна иметь буфер или средства хранения внепиковой энергии.
Эффективность PEM
При определении электрического КПД электролиза PEM можно использовать более высокую теплотворную способность (HHV).[11] Это потому, что слой катализатора взаимодействует с водой как пар. Поскольку для электролизеров PEM процесс протекает при 80 ° C, отходящее тепло может быть перенаправлено через систему для создания пара, что приведет к повышению общего электрического КПД. Для щелочных электролизеров необходимо использовать более низкую теплотворную способность (LHV), поскольку процесс в этих электролизерах требует воды в жидкой форме и использует щелочность для облегчения разрыва связи, удерживающей атомы водорода и кислорода вместе. Для топливных элементов также необходимо использовать более низкую теплотворную способность, поскольку пар является выходом, а не входом.
Электролиз PEM имеет электрический КПД около 80% в рабочем режиме в пересчете на водород, произведенный на единицу электроэнергии, используемой для запуска реакции.[12][13] Ожидается, что эффективность электролиза ПЭМ достигнет 82-86%.[14] до 2030 года, при этом сохраняя при этом надежность, поскольку прогресс в этой области продолжается высокими темпами.[15]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р Кармо, М; Fritz D; Mergel J; Столтен Д. (2013). «Комплексный обзор электролиза воды PEM». Международный журнал водородной энергетики. 38 (12): 4901–4934. Дои:10.1016 / j.ijhydene.2013.01.151.
- ^ 2012 - Основы электролиза воды с ПЭМ
- ^ 2014 - Развитие электролиза воды в Европейском Союзе
- ^ Шаленбах, М; Tjarks G; Кармо М; Люке В; Мюллер М; Столтен Д. (2016). «Кислота или щелочь? К новому взгляду на эффективность электролиза воды». Журнал Электрохимического общества. 163 (11): F3197 – F3208. Дои:10.1149 / 2.0271611jes.
- ^ Russell, JH; Nuttall LJ; Фикет А.П. (1973). «Производство водорода электролизом воды с твердым полимерным электролитом». Препринты отдела химии топлива Американского химического общества.
- ^ LeRoy, RL; Джанджуа МБ; Renaud R; Leuenberger U (1979). «Анализ нестационарных эффектов в водных электролизерах». Журнал Электрохимического общества. 126 (10): 1674. Дои:10.1149/1.2128775.
- ^ Slade, S; Кэмпбелл С.А.; Ральф TR; Уолш (2002). «Ионная проводимость экструдированных мембран серии Nafion 1100 EW». Журнал Электрохимического общества. 149 (12): A1556. Дои:10.1149/1.1517281.
- ^ Шредер, В; Emonts B; Janßen H; Шульце HP (2004). «Пределы взрываемости смесей водорода и кислорода при начальном давлении до 200 бар». Химическая инженерия и технологии. 27 (8): 847–851. Дои:10.1002 / ceat.200403174.
- ^ Мергель, Дж; Кармо М; Фриц, Д. (2013). «Состояние технологий производства водорода электролизом воды». В Столтене, Д. (ред.). Переход к системам возобновляемой энергии. Вайнхайм: Wiley-VCH. ISBN 978-3-527-33239-7.
- ^ а б c d е Шаленбах, М; Кармо М; Fritz DL; Mergel J; Столтен Д. (2013). «Электролиз воды из ПЭМ под давлением: КПД и переход газа». Международный журнал водородной энергетики. 38 (35): 14921–14933. Дои:10.1016 / j.ijhydene.2013.09.013.
- ^ Крузе, Бьёрнар. «Водородный статус и мультигетер» (PDF). bellona.org/. Беллона Норвегия. Получено 22 апреля 2018.
- ^ Бернхольц, янв (13 сентября 2018 г.). «Предыдущие, текущие и возможные будущие приложения RWE для хранения энергии» (PDF). RWE. п. 10.
Общий КПД: 70% или 86% (использование отработанного тепла)
- ^ «ITM - Инфраструктура заправки водородом - февраль 2017» (PDF). level-network.com. В архиве (PDF) из оригинала 17 апреля 2018 г.. Получено 17 апреля 2018.
- ^ «Снижение затрат и повышение производительности электролизеров из ПЭМ» (PDF). www.fch.europa.eu. Совместное предприятие по топливным элементам и водороду. Получено 17 апреля 2018.
- ^ «Отчет и финансовая отчетность 30 апреля 2016 г.» (PDF). www.itm-power.com. Получено 17 апреля 2018.








![{ displaystyle { ce {H2O (l) -> [+ overbrace {237,2 { ce {кДж / моль}}} ^ { ce {электричество}}] [+ underbrace {48,6 { ce { кДж / моль}}} _ { ce {heat}}] {H2} + 1 / 2O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1fdaff775c2a40019ce35ffff2aaead211d06a6d)







