Соленость - Salinity
| Часть серии по |
| Соленость воды |
|---|
 |
| Уровни солености |
| Пресная вода (< 0.05%) Солоноватая вода (0.05–3%) Соленая вода (3–5%) Рассол (> 5% до 26% -28% макс.) |
| Водоемы |
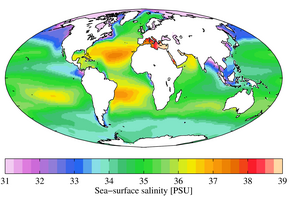

Соленость (/səˈлɪпɪтя/) соленость или количество соль растворился в теле воды, называется соленая вода (смотрите также засоление почвы ). Обычно это измеряется в (обратите внимание, что технически это безразмерно). Соленость - важный фактор, определяющий многие аспекты химия природных вод и биологический процессы внутри него, и является переменная термодинамического состояния это вместе с температура и давление, управляет физическими характеристиками, такими как плотность и теплоемкость воды.
А контурная линия постоянной солености называется изохалин, а иногда isohale.
Определения
Соленость в реках, озерах и океане концептуально проста, но технически сложно определить и точно измерить. Концептуально соленость - это количество растворенной соли в воде. Соли - это такие соединения, как хлорид натрия, сульфат магния, азотнокислый калий, и бикарбонат натрия которые растворяются в ионах. Концентрацию растворенных хлорид-ионов иногда называют хлорностью. С практической точки зрения, растворенное вещество определяется как вещество, которое может проходить через очень тонкий фильтр (исторически это фильтр с размером пор 0,45 мкм, а в настоящее время обычно 0,2 мкм).[2] Соленость можно выразить в виде массовая доля, т.е. масса растворенного вещества в единице массы раствора.
Морская вода обычно имеет массовую соленость около 35 г / кг, хотя более низкие значения характерны для побережья, где реки впадают в океан. Реки и озера могут иметь широкий диапазон солености, от менее 0,01 г / кг.[3] до нескольких г / кг, хотя есть много мест, где встречается более высокая соленость. В Мертвое море имеет соленость более 200 г / кг.[4] Дождевая вода перед тем, как коснуться земли, обычно имеет TDS 20 мг / л или меньше.[5]
Какой бы размер пор не использовался в определении, результирующее значение солености данного образца природной воды не будет отличаться более чем на несколько единиц. процентов (%). Физические океанографы, работающие в бездонный океан однако часто озабочены точностью и взаимной сопоставимостью измерений, выполненных разными исследователями в разное время, почти до пяти значащих цифр.[6] Морская вода в бутылках, известная как стандартная морская вода IAPSO, используется океанографами для стандартизации своих измерений с достаточной точностью, чтобы удовлетворить это требование.
Сочинение
Трудности измерения и определения возникают из-за того, что природные воды содержат сложную смесь многих различных элементов из разных источников (не все из растворенных солей) в различных молекулярных формах. Химические свойства некоторых из этих форм зависят от температуры и давления. Многие из этих форм трудно измерить с высокой точностью, и в любом случае полный химический анализ нецелесообразен при анализе нескольких проб. Различные практические определения солености являются результатом разных попыток учесть эти проблемы с разными уровнями точности, оставаясь при этом достаточно простыми в использовании.
По практическим причинам соленость обычно связана с суммой масс подмножества этих растворенных химических компонентов (так называемых соленость раствора), а не неизвестной массе солей, давших начало этому составу (исключение составляют случаи, когда искусственная морская вода создано). Для многих целей эта сумма может быть ограничена набором из восьми основных ионов в природных водах.[7][8] хотя для морской воды с высочайшей точностью также включены еще семь минорных ионов.[6] Основные ионы преобладают в неорганическом составе большинства (но далеко не всех) природных вод. Исключения включают некоторые карьерные озера и воды из некоторых гидротермальные источники.
Концентрации растворенных газов, например кислород и азот обычно не включаются в описания солености.[2] Тем не мение, углекислый газ газ, который при растворении частично превращается в карбонаты и бикарбонаты, часто включается. Кремний в виде кремниевая кислота, который обычно появляется в виде нейтральной молекулы в pH диапазон большинства природных вод, также может быть включен для некоторых целей (например, когда исследуются отношения солености / плотности).
Морская вода
Термин «соленость» для океанографов обычно ассоциируется с одним из набора конкретных методов измерения. По мере развития доминирующих методов меняются и различные описания солености. Соленость в основном измерялась с использованием титрование -основанные методы до 1980-х годов. Титрование с нитрат серебра может использоваться для определения концентрации галогенид ионы (в основном хлор и бром ) дать хлорность. Затем хлорность умножалась на коэффициент, чтобы учесть все остальные составляющие. Результирующие «солености Кнудсена» выражаются в единицах частей на тысячу (ppt или ‰ ).
Использование электрическая проводимость измерения для оценки ионного содержания морской воды привели к разработке шкалы, названной практическая шкала солености 1978 г. (ПСС-78).[9][10] Солености, измеренные с помощью PSS-78, не имеют единиц. Суффикс psu или же БП (обозначая практическая единица солености) иногда добавляется к значениям измерения PSS-78.[11] Добавление блока питания в качестве единицы после значения «формально неверно и категорически не рекомендуется».[12]
В 2010 году новый стандарт свойств морской воды - термодинамическое уравнение морской воды 2010 (TEOS-10), защищающий абсолютную соленость как замену практической солености, и консервативная температура в качестве замены потенциальная температура.[6] Этот стандарт включает новую шкалу, называемую шкала солености эталонного состава. Абсолютная соленость на этой шкале выражается как массовая доля в граммах на килограмм раствора. Соленость по этой шкале определяется путем объединения измерений электропроводности с другой информацией, которая может объяснить региональные изменения в составе морской воды. Их также можно определить путем прямых измерений плотности.
Образец морской воды из большинства мест с хлористостью 19,37 ppt будет иметь соленость по Кнудсену 35,00 ppt, практическую соленость PSS-78 около 35,0 и абсолютную соленость TEOS-10 около 35,2 г / кг. Электропроводность этой воды при температуре 15 ° C составляет 42,9 мСм / см.[6][13]
Озера и реки
Лимнологи а химики часто определяют соленость как массу соли на единицу объема, выраженную в миллиграммах на литр или граммах на литр.[7] Подразумевается, хотя часто не указывается, что это значение точно применимо только при некоторой эталонной температуре. Представленные таким образом значения обычно имеют точность порядка 1%. Лимнологи также используют электрическая проводимость, или «эталонная проводимость», как показатель солености. Это измерение может быть скорректировано с учетом температурных воздействий и обычно выражается в единицах мкСм / см.
Речная или озерная вода с соленостью около 70 мг / л обычно имеет удельную проводимость при 25 ° C от 80 до 130 мкСм / см. Фактическое соотношение зависит от присутствующих ионов.[14] Фактическая проводимость обычно изменяется примерно на 2% на градус Цельсия, поэтому измеренная проводимость при 5 ° C может быть только в диапазоне 50–80 мкСм / см.
Прямые измерения плотности также используются для оценки солености, особенно в соленые озера.[4] Иногда плотность при определенной температуре используется в качестве показателя солености. В других случаях эмпирическое соотношение соленость / плотность, разработанное для конкретного водоема, используется для оценки солености образцов по измеренной плотности.
| Соленость воды | |||
|---|---|---|---|
| Пресная вода | Солоноватая вода | Соленая вода | Рассол |
| < 0.05% | 0.05 – 3% | 3 – 5% | > 5% |
| < 0.5 ‰ | 0.5 – 30 ‰ | 30 – 50 ‰ | > 50 ‰ |
Классификация водных объектов по солености
| Талассическая серия |
| > 300 п. |
| гипергалин |
| 60–80 чел. |
| метахалин |
| 40 п.п. |
| миксевхалин |
| 30 п.п. |
| полигалинный |
| 18 п.п. |
| мезохалин |
| 5 п.п. |
| олигогалин |
| 0,5 п.п. |
Морские воды - это воды океана, еще один термин, обозначающий Евхалинские моря. Соленость эвхалинных морей от 30 до 35%. Солоноватоводные моря или вода имеет соленость от 0,5 до 29 ppt и метахалинные моря с 36 до 40 п. Все эти воды считаются талассовый потому что их соленость получена из океана и определяется как гомойогалин если соленость не сильно меняется во времени (практически постоянная). Таблица справа, измененная из Por (1972),[15][16] следует «Венецианской системе» (1959).[17]
В отличие от гомо-халинных сред пойкилохалин среды (которые также могут быть талассовый), в котором изменение солености биологически значимо.[18] Пойкилохалин соленость воды может варьироваться от 0,5 до более 300 ppt. Важной характеристикой является то, что эти воды имеют тенденцию различаться по солености в некотором биологически значимом диапазоне в зависимости от сезона или в каком-либо другом примерно сопоставимом временном масштабе. Проще говоря, это водоемы с довольно переменной соленостью.
Сильно соленая вода, из которой кристаллизуются (или вот-вот начнутся) соли, называется рассол.
Экологические соображения
Соленость является важным экологическим фактором, влияющим на типы организмов, обитающих в водоеме. Также соленость влияет на виды растения которые будут расти либо в водоеме, либо на суше, питаемой водой (или грунтовые воды ).[19] Растение, адаптированное к засоленным условиям, называется галофит. Галофит, устойчивый к остаточный карбонат натрия соленость называются стеклозер или же солянка или же барилла растения. Организмы (в основном бактерии), которые могут жить в очень соленых условиях, классифицируются как экстремофилы, или же галофилы конкретно. Организм, который может выдерживать широкий диапазон солености, - это эвригалин.
Удаление соли из воды дорого, а содержание соли является важным фактором при использовании воды (например, пригодность для питья ). Повышение солености наблюдалось в озерах и реках в Соединенных Штатах из-за общего дорожная соль и другие солевые антиобледенители в сток.[20]
Степень солености в океанах является движущей силой циркуляция мирового океана, где изменения плотности из-за изменений солености и температуры на поверхности океана вызывают изменения плавучести, которые вызывают опускание и подъем водных масс. Изменения солености океанов считается, что они способствуют глобальным изменениям в двуокиси углерода, поскольку более соленая вода менее растворима для двуокиси углерода. Кроме того, в ледниковые периоды гидрография такова, что возможной причиной уменьшения циркуляции является образование стратифицированных океанов. В таких случаях труднее провести воду через термохалинную циркуляцию.
Смотрите также
- Опреснение в хозяйственных целях
- Опреснение воды
- Опреснение почвы: контроль засоления почвы
- Коэффициент адсорбции натрия
- Измерение солености
- Соленость по биологическому контексту
- В организмах в целом, с особым упором на здоровье человека
- В растениях
- В рыбе
- Соленость по геологическому контексту
- Пресная вода
- Морская вода
- Засоленность почвы
- Термохалинное кровообращение
- Палеозоленость
- Набор данных CORA данные о солености Мирового океана
- Общие случаи концентрации растворенного вещества
Рекомендации
- ^ Атлас Мирового океана 2009 г.. nodc.noaa.gov
- ^ а б Павлович, Р. (2013). «Ключевые физические переменные в океане: температура, соленость и плотность». Знания о естественном образовании. 4 (4): 13.
- ^ Eilers, J.M .; Салливан, Т. Дж .; Херли, К. С. (1990). «Самое разбавленное озеро в мире?». Гидробиология. 199: 1–6. Дои:10.1007 / BF00007827. S2CID 30279782.
- ^ а б Анати, Д. А. (1999). «Соленость гиперсоленых рассолов: концепции и заблуждения». Int. J. Солт-Лейк. Res. 8: 55–70. Дои:10.1007 / bf02442137.
- ^ «Узнать о солености и качестве воды». Получено 21 июля 2018.
- ^ а б c d МОК, СКОР и IAPSO (2010 г.). Международное уравнение термодинамики морской воды - 2010: Расчет и использование термодинамических свойств.. Межправительственная океанографическая комиссия ЮНЕСКО (на английском языке). стр. 196с.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Ветцель, Р. Г. (2001). Лимнология: озерные и речные экосистемы, 3-е изд.. Академическая пресса. ISBN 978-0-12-744760-5.
- ^ Pawlowicz, R .; Фейстель, Р. (2012). «Лимнологические приложения термодинамического уравнения морской воды 2010 (ТЭОС-10)». Лимнология и океанография: методы. 10 (11): 853–867. Дои:10.4319 / lom.2012.10.853.
- ^ ЮНЕСКО (1981). Практическая шкала солености 1978 г. и Международное уравнение состояния морской воды 1980 г. Tech. Пап. Mar. Sci., 36
- ^ ЮНЕСКО (1981). Справочные документы и подтверждающие данные по Практической шкале солености 1978 г.. Tech. Пап. Mar. Sci., 37
- ^ Миллеро, Ф. Дж. (1993). «Что такое БП?». Океанография. 6 (3): 67.
- ^ https://www.nature.com/scitable/knowledge/library/key-physical-variables-in-the-ocean-temperature-102805293/
- ^ Калкин, Ф .; Смит, Н. Д. (1980). «Определение концентрации раствора хлорида калия, имеющего такую же электропроводность, при 15 ° C и бесконечной частоте, что и в стандартной морской воде с соленостью 35,0000 (хлористость 19,37394)». IEEE J. Oceanic Eng. OE-5 (1): 22–23. Bibcode:1980IJOE .... 5 ... 22C. Дои:10.1109 / JOE.1980.1145443.
- ^ ван Никерк, Гарольд; Зильбербауэр, Майкл; Малулеке, Ммафефо (2014). «Географические различия во взаимосвязи между общим количеством растворенных твердых веществ и электропроводностью в реках Южной Африки». Water SA. 40 (1): 133. Дои:10.4314 / wsa.v40i1.16.
- ^ Пор, Ф. Д. (1972). «Гидробиологические заметки о соленых водах Синайского полуострова». Морская биология. 14 (2): 111–119. Дои:10.1007 / BF00373210. S2CID 86601297.
- ^ «Соленость | Приток пресной воды». www.freshwaterinflow.org. Получено 2020-10-25.
- ^ Венецианская система (1959 г.). Окончательная резолюция симпозиума по классификации солоноватоводных вод. Archo Oceanogr. Лимнол., 11 (доп.): 243–248.
- ^ Даль, Э. (1956). «Границы экологической солености пойкилогалинных вод». Ойкос. 7 (1): 1–21. Дои:10.2307/3564981. JSTOR 3564981.
- ^ Кальчич, Мария, Туровски, Марк; Холл, Калли (22 декабря 2010 г.). «Проект Salinity Drifter в космическом центре Стенниса. Совместный проект со средней школой Хэнкока, Килн, штат Мэриленд». Проект дрифтера солености космического центра Стеннис. НТРС. Получено 2011-06-16.
- ^ «Надеется удержать соль, а вместо этого приготовить свекольный сок и пиво, чтобы дороги оставались чистыми». www.wbur.org.
дальнейшее чтение
- Мантила, А. (1987). «Стандартные сравнения морской воды обновлены». J. Phys. Oceanogr. 17 (4): 543–548. Bibcode:1987JPO .... 17..543M. Дои:10.1175 / 1520-0485 (1987) 017 <0543: sscu> 2.0.co; 2.
- Страница свойств морской воды MIT с подпрограммами библиотеки Matlab, EES и Excel VBA
- Уравнения и алгоритмы для расчета фундаментальных свойств морской воды.
- История определения солености
- Практическая шкала солености 1978 г.
- Калькулятор солености
- Льюис, Э. Л. 1982. Практическая шкала солености 1978 г. и предшествующие ей. Морская геодезия. 5 (4): 350–357.
- Уравнения и алгоритмы для расчета солености внутренних водоемов


