Тафамидис - Википедия - Tafamidis
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Vyndaqel, Vyndamax, другие |
| AHFS /Drugs.com | Монография |
| Данные лицензии | |
| Беременность категория | |
| Маршруты администрация | Устно |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.246.079 |
| Химические и физические данные | |
| Формула | C14ЧАС7Cl2NО3 |
| Молярная масса | 308.11 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Тафамидис, продается под торговыми марками Виндакель и Виндамакс среди прочего,[4] это лекарство, используемое для отсрочки потери периферический нерв функция у взрослых с семейная амилоидная полинейропатия (ФАП).[5] Он работает за счет стабилизации белка транстиретин.[5] У людей с ФАП эти пряди разделяются и образуют скопления, которые повреждают нервы. Он также используется для лечения сердечных заболеваний (кардиомиопатия ), вызванный транстиретин-опосредованным амилоидозом (ATTR-CM).[6]
Соединенные штаты. Управление по контролю за продуктами и лекарствами (FDA) считает, что это первое в своем классе лекарство.[7]
Медицинское использование
Тафамидис применяется для отсрочки ухудшения состояния периферический нерв функция у взрослых с семейная амилоидная полинейропатия (ФАП).[3][8][4] Принято устно.[3][4] Он также используется для лечения сердечного заболевания (кардиомиопатии), вызванного транстиретин-опосредованным амилоидозом (ATTR-CM).[6]
Женщины не должны беременеть, принимая его, и не должны кормить грудью во время приема. Люди с ФАП, перенесшие трансплантацию печени, не должны ее принимать.[3]
Побочные эффекты
Более 10% людей, участвовавших в клинических испытаниях, имели одну или несколько инфекций мочевыводящих путей, вагинальные инфекции, боль в верхней части живота или диарею.[3]
Взаимодействия
Тафамидис не взаимодействует с цитохром P450 но тормозит BCRP, поэтому может влиять на доступность лекарств, включая метотрексат, розувастатин и иматиниб, и ингибирует OAT1 и ОАТ3 поэтому, вероятно, будет взаимодействовать с НПВП и другими препаратами, которые зависят от этих переносчиков.[3]
Фармакология
Тафамидис - это фармакологический шаперон стабилизирует правильно сложенный тетрамерный форма транстиретин (TTR) белок путем связывания в одном из двух тироксин -связывающие сайты тетрамера.[8] У людей с ФАП отдельные мономеры отпадают от тетрамера, неправильно складываются и агрегируются; агрегаты вредят нервам.[8]
Максимальная концентрация в плазме достигается примерно через два часа после приема препарата; в плазме почти полностью связывается с белками. Согласно доклиническим данным, метаболизируется глюкуронизация выводится с желчью; у людей около 59% принятой дозы выводится с калом и примерно 22% с мочой.[3]
Химия
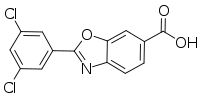
Химическое название тафамидиса - 2- (3,5-дихлорфенил) -1,3-бензоксазол-6-карбоновая кислота. Молекула имеет две кристаллические формы и одну аморфную форму; он производится в одной из возможных кристаллических форм. Он продается как меглумин соль. Слабо растворим в воде.[9]
История
Лаборатория Джеффри В. Келли в Научно-исследовательский институт Скриппса начали искать способы ингибировать образование фибрилл TTR в 1990-х.[10]:210 В конечном итоге команда Келли обнаружила Тафамидис с помощью дизайн лекарств на основе структуры стратегия; химическая структура была впервые опубликована в 2003 году.[11][12] В 2003 году Келли стал соучредителем компании FoldRx с Сьюзан Линдквист Массачусетского технологического института и Института Уайтхеда[12][13] и FoldRx развитый tafamidis, подав заявку на получение разрешения на маркетинг в Европе в начале 2010 года.[11] FoldRx был приобретен Pfizer позже в том же году.[11]
Тафамидис был одобрен Европейское агентство по лекарствам (EMA) в ноябре 2011 г., чтобы отсрочить поражение периферических нервов у взрослых с наследственный амилоидоз, связанный с транстиретином.[8] Соединенные штаты. Управление по контролю за продуктами и лекарствами (FDA) отклонило заявку на маркетинговое одобрение в 2012 году на том основании, что клиническое испытание не показало эффективности на основе функциональной конечной точки, и FDA запросило дальнейшие клинические испытания.[14] В мае 2019 года FDA одобрило два препарата тафамидиса, Виндакель (тафамидис меглумин) и Виндамакс (тафамидис), для лечения транстиретин-опосредованной кардиомиопатии (ATT-CM).[6] Препарат был одобрен в Японии в 2013 году; там регуляторы сделали утверждение зависимым от дальнейших клинических испытаний, показывающих лучшие доказательства эффективности.[15]
FDA одобрило тафамидис меглумин на основании данных клинического исследования (NCT01994889) с участием 441 взрослого пациента.[16] Исследование проводилось в 60 центрах в Бельгии, Бразилии, Канаде, Чехии, Испании, Франции, Греции, Италии, Японии, Нидерландах, Швеции, Великобритании и США.[16]
Было одно испытание, в котором оценивались преимущества и побочные эффекты тафамидиса для лечения ATTR-CM.[16] В испытании пациенты с ATTR ‑ CM были случайным образом распределены для приема тафамидиса (20 или 80 мг) или плацебо в течение 30 месяцев.[16] Около 90% пациентов в исследовании принимали другие препараты от сердечной недостаточности (в соответствии со стандартами лечения).[16]
EMA назвало тафамид лекарством от сирот[5] и FDA назначило тафамидис меглумин орфанный препарат.[17]
Общество и культура
Легальное положение
Тафамидис был одобрен для медицинского применения в Европейском Союзе в 2011 году и в Японии в 2013 году.[5][15] Первоначально он был отклонен в Соединенных Штатах в 2012 году, а затем одобрен в 2019 году.[6] В США два препарата, тафамидис меглумин и тафамидис, были одобрены для лечения транстиретин-опосредованной кардиомиопатии (ATTR-CM).[6][18][16] Эти два препарата имеют одну и ту же активную составляющую, тафамидис, но они не могут быть заменены на основе миллиграмма на миллиграмм.[6]
Тафамидис (Виндамакс) и Тафамидис меглумин (Виндакель) были одобрены для медицинского применения в Австралии в марте 2020 года.[19]
Рекомендации
- ^ а б «Краткое изложение решения Vyndamax и Vyndaqel по рецепту в Австралии». Управление терапевтических товаров (TGA). 17 июля 2020 г.. Получено 16 августа 2020.
- ^ «Применение тафамидиса во время беременности». Drugs.com. 6 сентября 2019 г.. Получено 16 августа 2020.
- ^ а б c d е ж грамм «Мягкие капсулы Vyndaqel 20 мг - Краткое описание характеристик продукта». Сборник электронных лекарств. Получено 2 апреля 2018.
- ^ а б c d «Виндакел-тафамидис меглумин капсула, заполненная жидкостью капсула Виндамакс-тафамидис, заполненная жидкостью». DailyMed. 30 августа 2019 г.. Получено 24 ноября 2019.
- ^ а б c d е «Виндакель ЕПАР». Европейское агентство по лекарствам (EMA). 16 октября 2019 г.. Получено 24 ноября 2019.
- ^ а б c d е ж «FDA одобряет новые методы лечения сердечных заболеваний, вызванных серьезным редким заболеванием, амилоидозом, опосредованным транстиретином». НАС. Управление по контролю за продуктами и лекарствами (FDA). 14 сентября 2019. В архиве из оригинала 14 сентября 2019 г.. Получено 24 ноября 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «Новые разрешения на лекарственную терапию 2019». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 31 декабря 2019 г.. Получено 15 сентября 2020.
- ^ а б c d Сказал, G; Гриппон, S; Киркпатрик, П. (1 марта 2012 г.). «Тафамидис». Обзоры природы. Открытие наркотиков. 11 (3): 185–6. Дои:10.1038 / nrd3675. PMID 22378262.
- ^ «Отчет об оценке: Vyndaqel tafamidis meglumine № процедуры: EMEA / H / C / 002294» (PDF). EMA. 2011 г. См. EMA индексная страница для обновлений.
- ^ Лабодиньер, Ричард (2014). «Глава 9: Открытие и разработка тафамидов для лечения семейной амилоидной полинейропатии TTR». В Прайде, Дэвид К.; Палмер, Майкл Дж (ред.). Орфанные препараты и редкие заболевания. RSC Drug Discovery Series No. 38. Королевское химическое общество. ISBN 978-1-84973-806-4.
- ^ а б c Джонс, Дэн (29 октября 2010 г.). «Модификация неправильного свертывания белков». Обзоры природы Drug Discovery. 9 (11): 825–827. Дои:10.1038 / nrd3316. PMID 21030987. S2CID 30702908.
- ^ а б Борман, Стю (25 января 2010 г.). «Атакующие амилоиды». Новости химии и машиностроения. 88 (4): 30–32. Дои:10.1021 / cen-v088n004.p030.
- ^ Breznitz, Shiri M .; О'Ши, Рори П .; Аллен, Томас Дж. (Март 2008 г.). «Стратегии коммерциализации университетов в развитии региональных биокластеров». Журнал управления инновационными продуктами. 25 (2): 129–142. Дои:10.1111 / j.1540-5885.2008.00290.x.
- ^ Гроган, Кевин (19 июня 2012 г.). «FDA отклоняет препарат Pfizer от редкого заболевания тафамидис». Pharma Times.
- ^ а б «Отчет об итогах обсуждения» (PDF). Отдел оценки и лицензирования, Бюро фармацевтической и пищевой безопасности Министерства здравоохранения, труда и социального обеспечения. 2 сентября 2013 г.
- ^ а б c d е ж "Снимки испытаний лекарственных препаратов: Виндакель / Виндамакс". НАС. Управление по контролю за продуктами и лекарствами (FDA). 28 мая 2019. В архиве с оригинала 19 декабря 2019 г.. Получено 18 декабря 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «Обозначение и одобрение орфанного препарата Тафамидис меглумин». НАС. Управление по контролю за продуктами и лекарствами (FDA). 3 мая 2019. В архиве с оригинала 19 декабря 2019 г.. Получено 18 декабря 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «Пакет одобрения лекарственных средств: Vyndaquel & Vyndamax». НАС. Управление по контролю за продуктами и лекарствами (FDA). 13 июн 2019. Получено 24 ноября 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «AusPAR: Тафамидис и Тафамидис меглумин». Управление терапевтических товаров (TGA). 10 сентября 2020 г.. Получено 23 сентября 2020.
дальнейшее чтение
- Адамс Д. (март 2013 г.). «Последние достижения в лечении семейной амилоидной полинейропатии». Ther Adv Neurol Disord. 6 (2): 129–39. Дои:10.1177/1756285612470192. ЧВК 3582309. PMID 23483184.
- Коэльо Т., Майя Л.Ф., Мартинс да Силва А. и др. (Август 2012 г.). «Тафамидис для лечения транстиретиновой семейной амилоидной полинейропатии: рандомизированное контролируемое исследование». Неврология. 79 (8): 785–92. Дои:10.1212 / WNL.0b013e3182661eb1. ЧВК 4098875. PMID 22843282.
внешняя ссылка
- «Тафамидис». Портал информации о наркотиках. Национальная медицинская библиотека США.
- «Тафамидис меглумин». Портал информации о наркотиках. Национальная медицинская библиотека США.
