Гипоксия опухоли - Tumor hypoxia

Гипоксия опухоли это ситуация, когда опухоль клетки были лишены кислород. По мере роста опухоль быстро истощает кровоснабжение, оставляя участки опухоли с областями, в которых концентрация кислорода значительно ниже, чем в здоровых тканях. Гипоксические микроокружения в солидных опухолях являются результатом потребления доступного кислорода в пределах от 70 до 150 мкм сосудистой сети опухоли быстро пролиферирующими опухолевыми клетками, что ограничивает количество кислорода, доступного для дальнейшей диффузии в опухолевую ткань. Было обнаружено, что для поддержки непрерывного роста и размножения в сложных условиях гипоксии раковые клетки изменяют свой метаболизм. Кроме того, известно, что гипоксия изменяет поведение клеток и связана с ремоделированием внеклеточного матрикса и усилением миграционного и метастатического поведения.[1][2]
Изменения гликолитического пути
Особое изменение метаболизма, исторически известное как Эффект варбурга[3] приводит к высокой скорости гликолиза в обоих нормоксический и гипоксический раковые клетки. Экспрессия генов, ответственных за гликолитические ферменты и переносчики глюкозы, усилена многочисленными онкогенами, включая RAS, SRC и MYC.[4][5]
HIF-1 индуцировал изменения в экспрессии генов

Во время прогрессирования рака опухолевые клетки приобретают комплексное метаболическое перепрограммирование, а гипоксия тканей является характерным признаком солидных опухолей, приводящим к адаптивным изменениям клеточного метаболизма. Гипоксииндуцибельный фактор-1α (HIF-1α) является ключевым кислородно-регулируемым активатором транскрипции, играющим фундаментальную роль в адаптации опухолевых клеток к гипоксии путем активации транскрипции генов-мишеней, связанных с множеством биологических процессов, включая выживание клеток, пролиферацию, ангиогенез. и антиапоптоз. Значительная экспрессия HIF1A была отмечена в большинстве изученных солидных опухолей, включая рак желудка и толстой кишки.[6]
Эти гены включают: семейство носителей растворенных веществ 2 (GLUT1 ), гексокиназа (HK), фосфоглюкозоизомераза (PGI), фосфофруктокиназа (ПФКЛ), фруктозо-бисфосфатальдолаза (ALDO), глицеральдегид-3-фосфатдегидрогеназа (GAPDH), фосфоглицераткиназа (ПГК), фосфоглицератмутаза (PGM), энолаза 1 (ENOA), пируваткиназа (ПК), киназа пируватдегидрогеназы, изофермент 1 (PDK1) и лактатдегидрогеназа А (ЛДГ-А).[7]
Помимо изменений концентрации кислорода, связанных с гипоксической микросредой, градиенты концентрации глюкозы в опухолях также влияют на скорость аэробного и анаэробного гликолиза. Элемент углеводного ответа (ChoRE) отвечает за регулирование экспрессии гена гликолитического фермента в ответ на изменение концентрации глюкозы посредством связывающего взаимодействия в той же консенсусной последовательности, что и HIF-1. Взаимодействие HIF-1 и ChoRE с последовательностью ДНК 5’-RCGTG-3 ’приводит к повышенной экспрессии перечисленных выше генов.[8]
Экспрессия транспортера GLUT1

GLUT1 является членом семейства транспортеров GLUT, состоящего из 14 транспортеров гексозы, ответственных за облегчение транспорта гексозных сахаров по градиенту концентрации. GLUT1 является наиболее экспрессируемым из семейства, которое, как считается, поддерживает базальный транспорт глюкозы почти во всех типах клеток. Было показано, что уровни GLUT1 в ответ на условия гипоксии увеличиваются с изменениями как уровней мРНК, так и белка.[9] Более того, было показано, что транспорт GLUT1 увеличивается в этих условиях гипоксии. Обладая ролью транспорта сахаров из внеклеточной во внутриклеточную среду, GLUT1, наряду с другими членами семейства GLUT, может регулировать скорость клеточного гликолитического метаболизма. Повышенный уровень GLUT1 в случае гипоксических опухолей увеличивает поток глюкозы в клетки, обеспечивая более высокую скорость гликолиза и, следовательно, больший риск метастазирования (как подробно описано ниже).[10]
Экспрессия гексокиназы 2
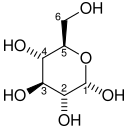
Гексокиназа (HK) - это первый фермент в гликолитическом пути, преобразующий глюкозу в глюкозо-6-фосфат посредством АТФ-зависимого фосфорилирования. Гексокиназная реакция, важная для продолжения гликолиза, активирует глюкозу для последующих стадий. В гипоксических опухолях значительно увеличивается количество мРНК гексокиназы, а также уровни белка.[11] Повышенная экспрессия гексокиназы 2, в некоторых случаях почти 10-кратная, позволяет увеличить поток глюкозы через гликолитический путь вслед за повышенным захватом GLUT1.[12]
| D-Глюкоза | Гексокиназа Экспрессия активируется HIF-1 | α-D-Глюкозо-6-фосфат | |
 |  | ||
| АТФ | ADP | ||
 | |||
| PO3- 4 | ЧАС2О | ||
| Глюкозо-6-фосфатаза | |||
Экспрессия фосфоглюкозоизомеразы
Фосфоглюкозоизомераза (PGI) - это домашний цитозольный фермент, играющий роль как в путях гликолиза, так и в путях глюконеогенеза. Он отвечает за катализирование взаимного превращения глюкозо-6-фосфата и фруктозо-6-фосфата. Внеклеточно PGI известен как аутокринный фактор подвижности (AMF), вызывающий митогенные, мотогенные, дифференцирующие функции, а также прогрессирование опухоли и метастазирование.[13] Активация PGI с помощью предложенных механизмов, индуцированных HIF-1, приводит к увеличению превращения глюкозо-6-фосфата во фруктозо-6-фосфат, а также способствует подвижности клеток и инвазии во время метастазирования рака.
| α-D-Глюкозо-6-фосфат | Фосфоглюкозоизомераза Экспрессия активируется HIF-1 | β-D-Фруктоза 6-фосфат | |
 |  | ||
 | |||
| Фосфоглюкозоизомераза | |||
Экспрессия 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы

6-Фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы (PFKFB) принадлежат к семейству бифункциональных АТФ-зависимых ферментов, ответственных за контроль уровня промежуточного продукта гликолиза фруктозо-1,6-бисфосфата. Вызванная HIF-1 экспрессия этих ферментов (PFK-2 / FBPase-2) впоследствии изменяет баланс фруктозо-2,6-бисфосфата, который играет важную роль в качестве аллостерического активатора фосфофруктокиназы 1 (PFK-1). PFK-1 - это фермент, контролирующий один из наиболее важных этапов гликолиза. Регулирование PFK-1 также опосредуется энергетическим статусом клетки в результате ингибирующего действия АТФ. Повышенное количество фруктозо-2,6-бисфосфата в раковых клетках в результате экспрессии HIF-1 PFK-2 / FBPase-2, таким образом, активирует PFK-1, обеспечивая повышенный гликолитический поток, превращающий фруктозо-6-фосфат во фруктозу-1. , 6-бисфосфат. Аллостерическая регуляция гликолиза фруктозо-2,6-бисфосфатом позволяет раковым клеткам поддерживать гликолитический баланс, соответствующий их биоэнергетическим и биосинтетическим потребностям.[14]
| β-D-Фруктоза 6-фосфат (F6P) | фосфофруктокиназа (ПФК-1) Экспрессия активируется HIF-1 | β-D-1,6-бисфосфат фруктозы (F1,6BP) | |
 |  | ||
| АТФ | ЧАС+ + ADP | ||
 | |||
Экспрессия фруктозо-1,6-бисфосфатальдолазы
Фруктозо-1,6-бисфосфатальдолаза (ALDO) принадлежит к семейству, включающему альдолазы A, B и C. Уникальные в гликолизе ферменты альдолазы расщепляют фруктозо-1,6-бисфосфат на две молекулы 3-C, включая глицеральдегид-3-фосфат ( GAP) и дигидроксиацетонфосфат (DHAP). При опосредованной HIF-1 экспрессии альдолазы А в условиях гипоксии катализатор фруктозо-2,6-бисфосфата до глицеральдегид-3-фосфата и дигидроксиацетонфосфата увеличивается, что приводит к увеличению гликолитического потока.[15]
| β-D-1,6-бисфосфат фруктозы (F1,6BP) | фруктозо-1,6-бисфосфатальдолаза Экспрессия активируется HIF-1 | D-глицеральдегид-3-фосфат (GADP) | Дигидроксиацетонфосфат (DHAP) | ||
 |  | + |  | ||
 | |||||
Экспрессия глицеральдегид-3-фосфатдегидрогеназы
Гликолитический фермент, глицеральдегид-3-фосфатдегидрогеназа (GAPDH), отвечает за окислительное превращение глицеральдегид-3-фосфата (GADP) в 1,3-бисфосфоглицерат (1,3BPG). Повышающая регуляция экспрессии глицеральдегид-3-фосфатдегидрогеназы максимальна (в 4-5 раз) после гипоксических условий ~ 24 часов в эндотелиальных клетках сосудов.[16] Были предложены различные модели точных механизмов активации глицеральдегид-3-фосфатдегидрогеназы.
| глицеральдегид-3-фосфат (GADP) | глицеральдегид фосфатдегидрогеназа Экспрессия активируется HIF-1 | D-1,3-бисфосфоглицерат (1,3BPG) | |
 |  | ||
| НАД+ + пя | НАДН + ЧАС+ | ||
 | |||
Экспрессия фосфоглицераткиназы 1
Было показано, что гипоксия вызывает 10-кратное накопление мРНК фосфоглицераткиназы 1 (PGK-1) в клетках гепатомы мыши (Hepa 1c1c7). Фосфоглицераткиназа 1 - это фермент, участвующий в превращении 1,3-бисфосфоглицерата (1,3-BPG) в 3-фосфоглицерат (3-P-G), ведущий производство АТФ из АДФ. Считается, что индукция экспрессии генов с помощью HIF-1 зависит от присутствия ядерного транслокатора рецептора ароматических углеводородов (ARNT1). Считается, что N-концевой участок Arnt и HIF-1 работают вместе, чтобы индуцировать транскрипцию фосфоглицераткиназы 1.[17]
| 1,3-бисфосфоглицерат (1,3-БПГ) | фосфоглицераткиназа Экспрессия активируется HIF-1 | 3-фосфоглицерат (3-P-G) | |
 |  | ||
| ADP | АТФ | ||
 | |||
| фосфоглицераткиназа | |||
Экспрессия фосфоглицератмутазы
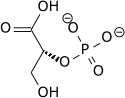
Фосфоглицератмутаза B (PGM-B) - один из последних гликолитических ферментов, ответственных за превращение 3-фосфоглицерата (3PG) в 2-фосфоглицерат (2PG). Было показано, что уровни как белка, так и мРНК увеличиваются в 2-3 раза в исследованиях, в которых фибробласты легких эмбрионов крысы подвергались воздействию гипоксии. Повышенные уровни, по-видимому, регулируются на уровне транскрипции, как и многие другие гликолитические ферменты. Максимальное повышение регуляции было показано через 16 часов, что подтверждает его роль в увеличении гликолитического потока для адаптации клеток к гипоксии.[18]
| 3-фосфоглицерат (3PG) | фосфоглицератмутаза Экспрессия активируется HIF-1 | 2-фосфоглицерат (2PG) | |
 |  | ||
 | |||
Экспрессия энолазы 1
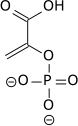
Энолаза 1, также известная как α-енолаза, кодируется геном ENOA и отвечает за превращение 2-фосфоглицерата в фосфоенолпируват в гликолитическом пути. Как сверхэкспрессия енолазы 1, так и ее посттрансляционные модификации могут иметь значение для диагностической и прогностической работы в отношении рака. Хотя точные роли посттрансляционных модификаций полностью не выяснены, показаны закономерности между некоторыми типами раковых клеток, предполагая, что они могут иметь важное влияние на функцию, локализацию и иммуногенность.[19] Помимо своей роли в стимулировании гликолитического потока и выработке анаробной энергии, было показано, что он вызывает специфический гуморальный и клеточный иммунный ответ. На всех уровнях гипоксия-индуцированная сверхэкспрессия енолазы 1 может играть важную роль в гипоксических опухолях, включая наиболее очевидное увеличение анаробного дыхания.
| 2-фосфоглицерат (2PG) | энолаза 1 Экспрессия активируется HIF-1 | фосфоенолпируват (PEP) | |
 |  | ||
| ЧАС2О | |||
 | |||
| энолаза 1 | |||
Экспрессия пируваткиназы
Активированная HIF-1 пируваткиназа M представлена множеством изоформ, известных как PKM1 и PKM2. Показано, что пируваткиназа превращает фосфоенолпируват в пируват, образуя АТФ из АДФ. Наряду с фосфофруктокиназой 1 пируваткиназа также аллостерически активируется фруктозо-2,6-бисфосфатом. Было показано, что в раковых клетках пируваткиназа M2 напрямую взаимодействует с HIF-1α, усиливая связывание HIF-1 и привлечение p300 к элементам ответа на гипоксию. Эта петля положительной обратной связи приводит к трансактивации HIF-1 и усиленному влиянию на метаболизм глюкозы.[20]
Пируваткиназа M2 часто считается основным регулятором метаболизма рака, который играет роль в различных механизмах параллельной, прямой, положительной и отрицательной обратной связи. Генетическая разница между пируваткиназой M1 и пируваткиназой M2 составляет всего 22 из 531 аминокислоты, что имеет огромное значение. Пируваткиназа М2 имеет метаболическую активность, регулируемую посттрансляционными модификациями, включая ацетилирование, окисление, фосфорилирование, гидроксилирование и сумоилирование. Эти различные модификации могут вызывать переход от метаболически активной тетрамерной формы к неактивной мономерной форме. Показано, что хорошо известная EGFR-активируемая внеклеточная регулируемая сигналом киназа 2 (ERK2) и ассоциированная со смертью протеинкиназа связываются и напрямую фосфорилируют пируваткиназу M2, что приводит к повышенной активности в пути гликолиза.[21] В условиях гипоксии, обнаруженных в солидной опухоли, пируваткиназа M2 играет большую роль в стимулировании производства анаробной энергии.
| фосфоенолпируват (PEP) | пируваткиназа Экспрессия активируется HIF-1 | пируват (Pyr) | |
 |  | ||
| ADP + H+ | АТФ | ||
 | |||
Экспрессия киназы пируватдегидрогеназы

Пируватдегидрогеназа непосредственно следует гликолитическому пути и отвечает за превращение пирувата в ацетил-КоА, который входит в цикл TCA. Цикл TCA, хотя и не требует прямого кислорода, требует циклического превращения NADH в NAD +, как это осуществляется цепью переноса электронов в аэробных условиях. В анаэробных условиях, например, при гипоксических опухолях, цикл TCA обеспечивает небольшой выход АТФ из-за отсутствия функции цепи переноса электронов. Чтобы направить гликолитически продуцируемый пируват из цикла TCA, киназа пируватдегидрогеназы чрезмерно экспрессируется в ответ на условия гипоксии. Киназа пируватдегидрогеназы - это не гликолитический фермент, а скорее гликолитический регулятор. Киназы пируватдегидрогеназы, транскрипционно активируемые HIF-1 в условиях гипоксии, отвечают за фосфорилирование субъединицы E1 пируватдегидрогеназы, в конечном итоге подавляя ее функцию.[22] Ингибируя этот специфический путь, гликолитические продукты направляются от митохондриального цикла TCA к лактатдегидрогеназе.[23]
Экспрессия лактатдегидрогеназы
Активированная экспрессия лактатдегидрогеназы A (LDH-A) параллельна с дезактивацией пируватдегидрогеназы, опосредованной киназой пируватдегидрогеназы. Последующая инактивация пируватдегидрогеназы после фосфорилирования и повышенной экспрессии лактатдегидрогеназы A отводит пируват от митохондриального цикла TCA. Во многих различных типах опухолей лактатдегидрогеназа А обнаруживается на повышенных уровнях и даже связана с плохим прогнозом и большим метастатическим потенциалом.[24] Высокий уровень продукции лактата поднимает вопрос о том, влияет ли лактат на агрессивное поведение, проявляющееся при гипоксических опухолях.
| пируват | лактатдегидрогеназа Экспрессия активируется HIF-1 | Лактат | |
 |  | ||
| НАДН | НАД + | ||
 | |||
| лактатдегидрогеназа | |||
Обзор гликолитических изменений и последствий

Повышенная экспрессия почти всех гликолитических ферментов наблюдается при гипоксических опухолевых состояниях. Чрезмерная экспрессия этих белков опосредуется HIF-1 и полностью изменяет нормальный клеточный метаболизм. С уменьшением скорости окисления митохондрий начинает накапливаться лактат и протоны. Высокий уровень гликолиза и выработки лактата, как показано в гипоксических опухолевых клетках, является отличительной чертой раковых клеток даже в присутствии кислорода.
Для избавления от опухолей клетки ацидоз Карбоангидразы, по-видимому, снова сильно экспрессируются после активации HIF-1. Эти ферменты катализируют обратимую гидратацию диоксида углерода в бикарбонат и протоны. Они также способствуют подкислению внеклеточной среды и поддержанию слабощелочной внутриклеточной среды, способствующей выживанию опухолевых клеток.[25] Лактат из гипоксических опухолевых клеток выводится в окружающую среду посредством карбоангидраза 9 и натрий-водородный обменник 1 MCT4. Считается, что местные аэробные раковые клетки поглощают этот лактат, образуя метаболический симбиоз.[26]
Лактат и рак

Принято считать, что раковые клетки (как гипоксические, так и нормоксический ) вырабатывают большое количество лактата в результате большого метаболического сдвига от окислительного фосфорилирования к измененному гликолизу. Высокий уровень высвобожденного лактата способствует ускользанию от иммунной системы опухолевых клеток. Активированные Т-клетки используют гликолиз в качестве источника энергии и поэтому должны регулировать свой собственный уровень лактата. Традиционно это делается с помощью метода секреции, иммунные клетки в среде, богатой лактатом, не могут избавиться от собственного лактата из-за градиента концентрации. Считается, что лейкоциты могут быть задушены лактатом, в то время как низкие внеклеточные pH могут также снижать функцию цитотоксических Т-клеток.[27]
В эндотелиальных клетках также было показано, что лактат стимулирует фактор роста эндотелия сосудов (VEGF), ведущая к усилению клеточной миграции в результате индуцированного лактатом ангиогенеза.[28] Недавняя работа также показала, что захват лактата MCT-1 в эндотелиальных клетках стимулирует активацию NF-κB и, таким образом, экспрессию IL-8. Высвобождения лактата из опухолевых клеток через MCT-4 было достаточно для стимуляции ангиогенеза и роста опухоли через IL-8-зависимый механизм.
Лактат продемонстрировал способность увеличивать выработку гиалуронана, что приводит к повышенной экспрессии CD44. Гиалуронан представляет собой гликозаминогликановый полимер, критически важный для поддержания целостности внеклеточного матрикса и модуляции межклеточных взаимодействий. Гиалуронан прикрепляется к клеточной поверхности с помощью CD44, который закреплен в богатых кавеолином липидных рафтах. Расщеплению и дальнейшей деградации гиалуронана способствуют Hyal2 и Hyal1 соответственно.[29] Повышенный уровень гиалуроновой карциномы, окружающей карциномы, приводит к стимулированию клеточного роста и подвижности. Был идентифицирован чувствительный к лактату элемент ответа для генов в фибробластах, участвующих в метаболизме гиалуроновой кислоты.
Наконец, стоит также отметить, что концентрация лактата положительно коррелирует с радиорезистентность. Многие противораковые методы лечения, включая ионизирующее излучение и многие химиотерапевтические препараты, основаны на избыточной выработке активных форм кислорода, вызывающих нестабильность генома. Лактат, как антиоксидант, может снижать уровни активных форм кислорода, повышая, таким образом, устойчивость к радиации и химиотерапии.[30]
Кислая микросреда и метастазы
Считается, что низкий pH гипоксических опухолей в результате высокого уровня молочной кислоты может способствовать инвазии опухолевых клеток за счет разрушения прилегающих незлокачественных тканей.[31]> Карбоангидраза 9, участвующая в поддержании слабощелочного внутриклеточного pH, делает это путем удаления карбоната из внеклеточного пространства, что приводит к подкислению окружающих клеток. Более того, перекачка протонов из гипоксических опухолевых клеток еще больше снижает pH окружающей среды. С другой стороны, как кратко обсуждалось выше, аутокринная функция фосфоглюкозоизомеразы также способствует подвижности клеток и метастазированию.
Метаболический симбиоз

Когда гипоксические опухолевые клетки потребляют большое количество глюкозы для поддержания энергии гомеостаз, опухоль нашла способ наиболее эффективно использовать свои ресурсы. Конечный гликолитический продукт гипоксических опухолей, лактат, транспортируется из гипоксической клетки транспортером монокарбоксилата 4 (MCT4), который является транспортером, индуцированным гипоксией. Затем свободный лактат во внеклеточном пространстве поглощается транспортером монокарбоксилата 1 (MCT1), который является транспортером, не индуцированным гипоксией, обнаруживаемым на поверхности аэробных клеток. Этот переносчик позволяет аэробным раковым клеткам эффективно поглощать лактат, преобразовывать его обратно в пируват с кислородозависимой экспрессией лактатдегидрогеназы B (LDH-B) и использовать его в качестве источника энергии. Это освобождает эти клетки от потребности в большом количестве глюкозы, позволяя гипоксическим клеткам поглощать большую часть доступных ресурсов.
Опухолевые клетки также показали замечательную способность адаптироваться к региональным изменениям доступности кислорода. Раковые клетки демонстрируют способность быть гипоксическими в один момент времени и аэробными в следующий.[32] Это показывает циклические вариации оксигенации, подразумевающие динамическое регулирование метаболического симбиоза между лактат-продуцирующим и потребляющим лактат состояниями.
Пентозофосфатный путь
Чтобы соответствовать требованиям быстрого роста опухоли, опухоль должна найти способы поддерживать синтез полной дочерней клетки, сталкиваясь с истощением запасов питательных веществ. Они должны координировать производство предшественников для синтеза макромолекул, а также поддерживать биоэнергетику клеток, не нарушая рост, пролиферацию и жизнеспособность клеток. Один из способов сделать это - перетасовать гликолитические промежуточные соединения, такие как глюкозо-6-фосфат, в пентозофосфатный путь с образованием рибозо-5-фосфата и НАДФН. Рибозо-5-фосфат действует как промежуточное соединение для производства нуклеотидов, обеспечивая связь между гликолизом и синтезом нуклеотидов в гипоксических опухолевых клетках. В тех случаях, когда гликолиз остается высокоактивным в нормоксических условиях, НАДФН действует как медиатор антиоксидантных реакций для защиты клеток от окислительного повреждения.[33]
Лечение рака и гипоксия опухоли
Лучевая терапия
Наличие или отсутствие кислорода оказывает сильное влияние на ионизирующее излучение, вызывая гибель опухолевых и нормальных клеток.[34] Это называется кислородный эффект. Было показано, что в условиях гипоксии клетки приобретают радиорезистентность через механизмы, опосредованные HIF-1. Чтобы преодолеть эту проблему, онкологи-радиологи разработали мощные инструменты и подходы, такие как одновременная интегрированная усиленная лучевая терапия с модуляцией интенсивности (SIB-IMRT), которая позволяет доставлять повышенную дозу излучения к небольшим целевым фракциям в злокачественной опухоли, гипоксии. селективные цитотоксины / препараты и ингибиторы HIF-1.[35]Более того, можно лечить гипоксическую опухоль с помощью ионно-лучевой терапии, в частности с помощью 12С. Поскольку повреждение ионов прямое, OER (Коэффициент увеличения кислорода ) равно 1, поэтому влияние кислорода не имеет значения.
Другие варианты лечения
Биоредуктивные пролекарства играют важную роль в борьбе с этими типами клеток: они могут избирательно убивать дефицитные по кислороду опухолевые клетки. активированные гипоксией пролекарства. Примеры лекарств включают Тирапазамин и Эвофосфамид. Первыми в изучении опухолей в таких условиях выступили Д-р Л. Х. Грей.
Ориентация на гипоксию опухоли для преодоления метастазов
Связь между гипоксией опухоли и метастатическим прогрессированием показана в многочисленных публикациях.[36][37]
Разработка лекарств
Было принято несколько подходов к решению проблемы гипоксии опухоли. Некоторые компании пытались разработать препараты, которые активируются в гипоксических средах (Novacea, Inc., Proacta, Inc и Threshold Pharmaceuticals, Inc.), в то время как другие в настоящее время стремятся уменьшить гипоксию опухоли (Diffusion Pharmaceuticals, Inc. и NuvOx Pharma, LLC).
Несколько компаний пытались разработать лекарства, которые активируются в гипоксической среде. Эти кандидаты в лекарства нацелены на уровни гипоксии, которые обычны для опухолей, но редки в нормальных тканях. В гипоксических зонах опухолей обычно не действуют традиционные химиотерапевтические препараты, что в конечном итоге способствует рецидиву. В литературе показано, что гипоксия связана с худшим прогнозом, что делает ее определяющей для прогрессирования рака и терапевтического ответа.[36] В нескольких обзорных статьях суммировано текущее состояние гипоксических цитотоксинов (гипоксически активированные пролекарства ).[38][39][40] Компании, которые пробовали лекарства, активируемые в гипоксических средах, включали Novacea, Inc., Proacta и Threshold Pharmaceuticals. Novacea Inc прекратила разработку своего препарата, активирующего гипоксию.[41] Препарат Proacta PR610 не прошел клинические испытания фазы I из-за токсичности.[42] Компания Threshold Pharmaceuticals прекратила выпуск пролекарства, активируемого гипоксией, TH-302, после того, как испытания фазы III не показали статистически значимой общей выживаемости.[43]
Ниацинамид, активная форма витамина B3, действует как химио- и радиосенсибилизирующий агент, усиливая кровоток опухоли, тем самым уменьшая гипоксию опухоли. Ниацинамид также ингибирует поли (АДФ-рибоза) полимеразы (PARP-1), ферменты, участвующие в повторном соединении разрывов цепи ДНК, вызванных радиацией или химиотерапией.[44] По состоянию на август 2016 года клинических испытаний по этому показанию не проводилось.
Еще один подход к лечению гипоксии опухоли - применение соединение, усиливающее диффузию кислорода для реоксигенации гипоксических зон опухолей. Разработчик соединений, улучшающих диффузию кислорода, Диффузионные фармацевтические препараты, проверил его свинец, транс-кроцетинат натрия (TSC) в клиническом исследовании фазы II с участием 59 пациентов с впервые установленным диагнозом мультиформная глиобластома.[45] Результаты фазы II показали, что 36% пациентов, получавших полную дозу TSC, были живы через 2 года, по сравнению с историческими значениями выживаемости в диапазоне от 27% до 30% для стандартного лечения.[46] Главной конечной точкой исследования была выживаемость через два года, а не общая выживаемость.[45]
Еще один разрабатываемый препарат, предназначенный для уменьшения гипоксии опухоли, - это NVX-108 NuvOx Pharma. NVX-108 представляет собой перфторуглерод, додекафторпентан (DDFPe). NVX-108 вводится внутривенно, проходит через легкие и поглощает кислород, затем проходит через артерии и выделяет кислород в присутствии гипоксической ткани. В настоящее время проводится клиническое исследование фазы Ib / II для недавно диагностированной мультиформной глиобластомы.[47] Первые результаты показали, что гипоксия опухоли полностью изменилась, и испытания продолжают развиваться.[48]
Смотрите также
Рекомендации
- ^ Гилкес Д.М., Семенца Г.Л., Виртц Д. (июнь 2014 г.). «Гипоксия и внеклеточный матрикс: драйверы метастазирования опухоли». Обзоры природы. Рак. 14 (6): 430–9. Дои:10.1038 / nrc3726. ЧВК 4283800. PMID 24827502.
- ^ Разлив F, Рейнольдс Д.С., Камм Р.Д., Заман М.Х. (август 2016 г.). «Влияние физической микросреды на прогрессирование опухоли и метастазирование». Текущее мнение в области биотехнологии. 40: 41–48. Дои:10.1016 / j.copbio.2016.02.007. ЧВК 4975620. PMID 26938687.
- ^ Vander Heiden MG, Cantley LC, Thompson CB (май 2009 г.). «Понимание эффекта Варбурга: метаболические потребности клеточной пролиферации». Наука. 324 (5930): 1029–33. Bibcode:2009Научный ... 324.1029V. Дои:10.1126 / наука.1160809. ЧВК 2849637. PMID 19460998.
- ^ Флиер Дж. С., Мюклер М. М., Ашер П., Лодиш Х. Ф. (март 1987 г.). «Повышенные уровни транспорта глюкозы и транспортной матричной РНК индуцируются онкогенами ras или src». Наука. 235 (4795): 1492–5. Bibcode:1987Научный ... 235.1492F. Дои:10.1126 / science.3103217. PMID 3103217.
- ^ Остхус Р.К., Шим Х., Ким С., Ли К., Редди Р., Мукерджи М. и др. (Июль 2000 г.). «Нарушение регуляции экспрессии переносчика глюкозы 1 и гликолитического гена с помощью c-Myc». Журнал биологической химии. 275 (29): 21797–800. Дои:10.1074 / jbc.C000023200. PMID 10823814.
- ^ Ezzeddini R, Taghikhani M, Somi MH, Samadi N, Rasaee, MJ (май 2019 г.). «Клиническое значение FASN по отношению к HIF-1α и SREBP-1c при аденокарциноме желудка». Науки о жизни. 224: 169–176. Дои:10.1016 / j.lfs.2019.03.056. PMID 30914315.
- ^ Канехиса М (2013). «Молекулярно-сетевой анализ болезней и лекарств в KEGG». Методы молекулярной биологии. 939: 263–75. Дои:10.1007/978-1-62703-107-3_17. ISBN 978-1-62703-106-6. PMID 23192552.
- ^ Dang CV, Semenza GL (февраль 1999 г.). «Онкогенные изменения обмена веществ». Тенденции в биохимических науках. 24 (2): 68–72. Дои:10.1016 / S0968-0004 (98) 01344-9. PMID 10098401.
- ^ Чжан Дж. З., Бехруз А., Исмаил-Бейги Ф. (июль 1999 г.). «Регулирование транспорта глюкозы при гипоксии». Американский журнал болезней почек. 34 (1): 189–202. Дои:10.1016 / s0272-6386 (99) 70131-9. PMID 10401038.
- ^ Эйрли Р., Лонкастер Дж., Дэвидсон С., Бромли М., Робертс С., Паттерсон А. и др. (Апрель 2001 г.). «Экспрессия транспортера глюкозы glut-1 коррелирует с гипоксией опухоли и предсказывает выживаемость без метастазов при запущенной карциноме шейки матки». Клинические исследования рака. 7 (4): 928–34. PMID 11309343.
- ^ Ясуда, Сейичи и др.«Экспрессия гексокиназы II и VEGF в опухолях печени: корреляция с фактором, индуцируемым гипоксией-1α, и его значение». Журнал гепатологии 40.1 (2004): 117-123.
- ^ Нацуизака М., Озаса М., Дарманин С., Миямото М., Кондо С., Камада С. и др. (Сентябрь 2007 г.). «Синергетическое повышение регуляции гексокиназы-2, переносчиков глюкозы и ангиогенных факторов в раковых клетках поджелудочной железы путем депривации глюкозы и гипоксии». Экспериментальные исследования клеток. 313 (15): 3337–48. Дои:10.1016 / j.yexcr.2007.06.013. HDL:2115/29921. PMID 17651733.
- ^ Фунасака Т., Янагава Т., Хоган В., Раз А. (сентябрь 2005 г.). «Регулирование экспрессии фосфоглюкозоизомеразы / аутокринного фактора подвижности посредством гипоксии». Журнал FASEB. 19 (11): 1422–30. Дои:10.1096 / fj.05-3699com. PMID 16126909.
- ^ Рос С., Шульце А. (февраль 2013 г.). «Уравновешивание гликолитического потока: роль 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы в метаболизме рака». Рак и метаболизм. 1 (1): 8. Дои:10.1186/2049-3002-1-8. ЧВК 4178209. PMID 24280138.
- ^ Лоренцен Э., Зиберс Б., Хенсель Р., Поль Э (март 2005 г.). «Механизм образования основания Шиффа фруктозо-1,6-бисфосфат альдолаза: структурный анализ промежуточных продуктов реакции». Биохимия. 44 (11): 4222–9. Дои:10.1021 / bi048192o. PMID 15766250.
- ^ Грейвен К.К., Макдональд Р.Дж., Фарбер Х.В. (февраль 1998 г.). «Гипоксическая регуляция эндотелиальной глицеральдегид-3-фосфатдегидрогеназы». Американский журнал физиологии. 274 (2): C347-55. Дои:10.1152 / ajpcell.1998.274.2.C347. PMID 9486123.
- ^ Ли Х, Ко ХП, Уитлок Дж. П. (август 1996 г.). «Индукция экспрессии гена фосфоглицераткиназы 1 гипоксией. Роль Arnt и HIF1alpha». Журнал биологической химии. 271 (35): 21262–7. Дои:10.1074 / jbc.271.35.21262. PMID 8702901.
- ^ Такахаши Ю., Такахаши С., Ёсими Т., Миура Т. (июнь 1998 г.). «Гипоксия-индуцированная экспрессия фосфоглицератмутазы B в фибробластах». Европейский журнал биохимии. 254 (3): 497–504. Дои:10.1046 / j.1432-1327.1998.2540497.x. PMID 9688259.
- ^ Капелло М., Ферри-Боргоньо С., Капелло П., Новелли Ф (апрель 2011 г.). «α-Энолаза: многообещающая терапевтическая и диагностическая мишень для опухолей». Журнал FEBS. 278 (7): 1064–74. Дои:10.1111 / j.1742-4658.2011.08025.x. PMID 21261815.
- ^ Луо В., Ху Х, Чанг Р., Чжун Дж., Кнабель М., О'Милли Р. и др. (Май 2011 г.). «Пируваткиназа M2 представляет собой коактиватор, стимулируемый PHD3, для индуцируемого гипоксией фактора 1». Клетка. 145 (5): 732–44. Дои:10.1016 / j.cell.2011.03.054. ЧВК 3130564. PMID 21620138.
- ^ Филипп Ф.В. (2013). «Метаболизм рака соответствует системной биологии: изоформа пируваткиназы PKM2 является основным регулятором метаболизма». Журнал канцерогенеза. 12: 14. Дои:10.4103/1477-3163.115423. ЧВК 3746496. PMID 23961261.
- ^ Кукуракис М.И., Гиатроманолаки А., Сивридис Э., Гаттер К.С., Харрис А.Л. (январь 2005 г.). «Экспрессия киназы пируватдегидрогеназы и пируватдегидрогеназы при немелкоклеточном раке легкого и опухоль-ассоциированной строме». Неоплазия. 7 (1): 1–6. Дои:10.1593 / neo.04373. ЧВК 1490315. PMID 15736311.
- ^ Kim JW, Dang CV (сентябрь 2006 г.). «Молекулярные сладкоежки рака и эффект Варбурга». Исследования рака. 66 (18): 8927–30. Дои:10.1158 / 0008-5472.CAN-06-1501. PMID 16982728.
- ^ Серганова И., Ризван А., Ни Икс, Такур С.Б., Видер Дж., Рассел Дж. И др. (Октябрь 2011 г.). «Метаболическая визуализация: связь между лактатдегидрогеназой А, лактатом и фенотипом опухоли». Клинические исследования рака. 17 (19): 6250–6261. Дои:10.1158 / 1078-0432.CCR-11-0397. ЧВК 4217119. PMID 21844011.
- ^ Chiche J, Ilc K, Laferrière J, Trottier E, Dayan F, Mazure NM и др. (Январь 2009 г.). «Индуцируемая гипоксией карбоангидраза IX и XII способствует росту опухолевых клеток, противодействуя ацидозу за счет регулирования внутриклеточного pH». Исследования рака. 69 (1): 358–68. Дои:10.1158 / 0008-5472.CAN-08-2470. PMID 19118021.
- ^ Sonveaux P, Végran F, Schroeder T., Wergin MC, Verrax J, Rabbani ZN и др. (Декабрь 2008 г.). «Нацеливание на дыхание, питаемое лактатом, выборочно убивает гипоксические опухолевые клетки у мышей». Журнал клинических исследований. 118 (12): 3930–42. Дои:10.1172 / JCI36843. ЧВК 2582933. PMID 19033663.
- ^ Фишер К., Хоффманн П., Воелкл С., Мейденбауэр Н., Аммер Дж., Эдингер М. и др. (Май 2007 г.). «Ингибирующее действие молочной кислоты, полученной из опухолевых клеток, на Т-клетки человека». Кровь. 109 (9): 3812–9. Дои:10.1182 / blood-2006-07-035972. PMID 17255361.
- ^ Beckert S, Farrahi F, Aslam RS, Scheuenstuhl H, Königsrainer A, Hussain MZ, Hunt TK (2006). «Лактат стимулирует миграцию эндотелиальных клеток». Ремонт и регенерация ран. 14 (3): 321–4. Дои:10.1111 / j.1743-6109.2006.00127.x. PMID 16808811.
- ^ Стерн Р. (август 2008 г.). «Гиалуронидазы в биологии рака». Семинары по биологии рака. 18 (4): 275–80. Дои:10.1016 / j.semcancer.2008.03.017. PMID 18485730.
- ^ Sattler UG, Mueller-Klieser W (ноябрь 2009 г.). «Антиоксидантная способность опухолевого гликолиза». Международный журнал радиационной биологии. 85 (11): 963–71. Дои:10.3109/09553000903258889. PMID 19895273.
- ^ Gort EH, Groot AJ, van der Wall E, van Diest PJ, Vooijs MA (февраль 2008 г.). «Гипоксическая регуляция метастазирования с помощью факторов, индуцируемых гипоксией». Современная молекулярная медицина. 8 (1): 60–7. Дои:10.2174/156652408783565568. PMID 18289014.
- ^ Карденас-Навиа Л.И., Мейс Д., Ричардсон Р.А., Уилсон Д.Ф., Шан С., Дьюхерст М.В. (июль 2008 г.). «Повсеместное присутствие колеблющейся оксигенации в опухолях». Исследования рака. 68 (14): 5812–9. Дои:10.1158 / 0008-5472.CAN-07-6387. PMID 18632635.
- ^ ДеБерардинис Р.Дж. (ноябрь 2008 г.). «Является ли рак заболеванием аномального клеточного метаболизма? Новый взгляд на старую идею». Генетика в медицине. 10 (11): 767–77. Дои:10.1097 / GIM.0b013e31818b0d9b. ЧВК 2782690. PMID 18941420.
- ^ Грей Л.Х., Конгер А.Д., Эберт М., Хорнси С., Скотт О.К. (декабрь 1953 г.). «Концентрация кислорода, растворенного в тканях во время облучения, как фактор лучевой терапии». Британский журнал радиологии. 26 (312): 638–48. Дои:10.1259/0007-1285-26-312-638. PMID 13106296.
- ^ Харада Х (2011). «Как мы можем преодолеть гипоксию опухоли при лучевой терапии?». Журнал радиационных исследований. 52 (5): 545–56. Bibcode:2011JRadR..52..545H. Дои:10.1269 / jrr.11056. PMID 21952313.
- ^ а б Хокель М., Шленгер К., Арал Б., Митце М., Шаффер Ю., Ваупель П. (октябрь 1996 г.). «Связь между гипоксией опухоли и злокачественным прогрессированием при распространенном раке шейки матки». Исследования рака. 56 (19): 4509–15. PMID 8813149.
- ^ Вергис Р., Корбишли С.М., Норман А.Р., Бартлетт Дж., Джавар С., Борре М. и др. (Апрель 2008 г.). «Внутренние маркеры опухолевой гипоксии и ангиогенеза при локализованном раке простаты и исход радикального лечения: ретроспективный анализ двух рандомизированных исследований лучевой терапии и одного хирургического когортного исследования». Ланцет. Онкология. 9 (4): 342–51. Дои:10.1016 / S1470-2045 (08) 70076-7. PMID 18343725.
- ^ Браун Дж. М., Уилсон В. Р. (июнь 2004 г.). «Использование гипоксии опухоли в лечении рака». Обзоры природы. Рак. 4 (6): 437–47. Дои:10.1038 / nrc1367. PMID 15170446.
- ^ Ан Г.О., Браун М. (май 2007 г.). «Ориентация на опухоли с помощью цитотоксинов, активируемых гипоксией». Границы биологических наук. 12 (8–12): 3483–501. Дои:10.2741/2329. PMID 17485316.
- ^ McKeown SR, Cowen RL, Williams KJ (август 2007 г.). «Биоредуктивные препараты: от концепции к клинике». Клиническая онкология. 19 (6): 427–42. Дои:10.1016 / j.clon.2007.03.006. PMID 17482438.
- ^ «Transcept Pharmaceuticals объединяется с Novacea и продвигает лекарства для сна». bizjournals.com. Август 2016 г.
- ^ «Испытание увеличения дозы PR610 для лечения пациентов с солидными опухолями». ClinicalTrials.gov. Август 2016 г.
- ^ "Threshold Pharmaceuticals объявляет о сокращении штата". Жестокая биотехнология. Декабрь 2015 г.
- ^ «Определение ниацинамида - Словарь лекарств Национального института рака - Национальный институт рака». Cancer.gov. 2011-02-02. Получено 2011-12-21.
- ^ а б «Исследование безопасности и эффективности транс-кроцетината натрия (TSC) с сопутствующей лучевой терапией и темозоломидом при недавно диагностированной глиобластоме (GBM)». ClinicalTrials.gov. Ноябрь 2011 г.
- ^ Гейнер Дж. Л., Шихан Дж. П., Ларнер Дж. М., Джонс Д. Р. (февраль 2017 г.). «Транс-кроцетинат натрия с темозоломидом и лучевая терапия мультиформной глиобластомы». Журнал нейрохирургии. 126 (2): 460–466. Дои:10.3171 / 2016.3.JNS152693. PMID 27177177.
- ^ «Эффекты NVX-108 как радиационного сенсибилизатора при глиобластоме (GBM)»). ClinicalTrials.gov. Август 2016 г.
- ^ «NuvOx сообщает о благоприятных данных о клинических испытаниях фазы Ib при глиобластоме». AZBio. Июль 2015 г.
дальнейшее чтение
- Салливан Р., Грэм СН (июнь 2007 г.). «Гипоксический отбор метастатического фенотипа». Отзывы о метастазах рака. 26 (2): 319–31. Дои:10.1007 / s10555-007-9062-2. PMID 17458507.
