UCK2 - UCK2
Уридин-цитидинкиназа 2 (UCK2) - это фермент что у людей кодируется UCK2 ген.[5]
Белок, кодируемый этим геном, катализирует фосфорилирование уридина и цитидина до уридинмонофосфата (UMP) и цитидинмонофосфата (CMP) соответственно. Это первый шаг в производстве трифосфатов пиримидиновых нуклеозидов, необходимых для синтеза РНК и ДНК. Кроме того, аллель этого гена может играть роль в обеспечении негуморального иммунитета к Hemophilus influenzae типа B.[5]
Устройство и механизм
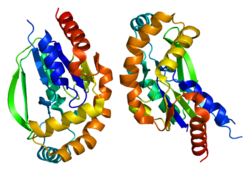
Уридин-цитидинкиназа 2 представляет собой тетрамер с молекулярной массой около 112 кДа.[6] В мономере UCK2 активный сайт состоит из пятицепочечного β-лист в окружении пяти α-спирали и β-петля для шпильки.[7] Петля β-шпильки, в частности, образует значительную часть глубокого кармана связывания для уридин /цитидин субстрат для умеренного связывания и высвобождения субстрата и продуктов. Специфичность связывания нуклеозидов определяется остатками His-117 и Tyr-112, которые водородная связь с 4-аминогруппой или 6-оксогруппой цитидина и уридина соответственно.[7] А магний ион координируется в активном центре Glu-135, Ser-34 и Asp-62.

Остаток Asp-62 отвечает за каталитическую активность в активном центре фермента;[8] Кислая боковая цепь остатка Asp-62 депротонирует 5’-гидроксильную группу на субстрате и активирует ее, чтобы атаковать γ-фосфор АТФ.[9] Структурный анализ показал, что боковая цепь каталитического Asp-62 меняет конформацию до и после реакции. Было высказано предположение, что это конформационное изменение происходит после фосфорилирования, когда отрицательно заряженный Asp-62 перемещается от недавно присоединенного 5’-фосфата UMP /CMP товар.[7]
Специфичность субстрата
Хотя уридин и цитидин являются физиологически предпочтительными субстраты для фермента было показано, что UCK2 фосфорилирует другие нуклеозид аналоги. Примеры успешно фосфорилированных субстратов включают 6-азауридин, 5-азацитидин, 4-тиоуридин, 5-фторцитидин и 5-гидроксиуридин.[10] В качестве альтернативы АТФ, GTP было показано, что он действует как донор фосфата.[11] Эта распущенность делает возможным важную роль UCK2 как in vivo активатор клинически активных пролекарств нуклеозидов, таких как циклопентенилцитидин.[12]
Несмотря на гибкость для различных аналогов нуклеозидов, UCK уникален среди других киназ нуклеиновых кислот своей специфичностью к аналогам рибозы по сравнению с формами 2’-дезоксирибозы; тогда как другие белки семейства киназ NMP будут без разбора фосфорилировать оба дезоксирибонуклеозиды и рибонуклеозиды, UCK2 принимает только рибонуклеозиды.[6] Эта уникальная селективность может быть вызвана механизмами соответствия и структурными особенностями, которые уникальны для UCK2 среди семейства киназ NMP. Исследования показали, что связывание фрагмента цитидин / уридиновый сахар приводит к конформационному изменению, уменьшающему расстояние между остатками His-117 и Arg-176. Без 2’-гидроксильной группы в сахарном фрагменте водородная связь с Asp-84 и Arg-166 будет значительно снижена, что приведет к уменьшению конформационных изменений и ослаблению связывания с субстратом.[6]
Физиологическая роль

UCK2 - одна из двух уридин-цитидинкиназ человека. Другой белок UCK - уридин-цитидинкиназа 1, на долю которой приходится около 70% идентичность последовательности с UCK2.[7] В то время как UCK1 повсеместно экспрессируется в различных здоровых тканях, включая печень, скелетные мышцы и сердце, UCK2 был обнаружен только в ткани плаценты.[10] UCK2, однако, представляет особый научный интерес из-за его чрезмерное выражение в опухоль Сотовые линии,[13] что делает его целью в противораковые методы лечения.
Исследования, определяющие Михаэлис-Ментен кинетические параметры для этих ферментов показали, что UCK2 имеет в четыре-шесть раз больше связывающая аффинность, более высокие максимальные скорости и более высокая эффективность для субстратов уридина и цитидина, чем у UCK1.[10]
Обе уридин-цитидинкиназы, однако, играют решающую роль в биосинтезе пиримидин нуклеотиды которые составляют РНК и ДНК. Биосинтез пиримидина может происходить двумя путями: синтез de novo, который зависит от L-глутамин в качестве предшественника пути и спасения, который перерабатывает клеточный уридин и цитидин.[14] UCK2 катализирует первую стадию утилизации пиримидина и является ограничение скорости фермент в пути.[15]
Актуальность болезни
UCK1 повсеместно экспрессируется в здоровых тканях, но обнаруживается в небольших количествах в опухолевых тканях. Напротив, UCK2 был обнаружен в основном в раковых клетках и здоровой ткани плаценты. Селективная экспрессия в тканях-мишенях привела к идентификации UCK2 в качестве мишени в противораковой терапии.[16]
Одна из стратегий противораковой и противовирусной терапии включает использование UCK2 для активации противоопухолевых препаратов. пролекарства через фосфорилирование.[17] Например, 1- (3-C-этинил-β-D-рибопентофуранозил) цитозин (ECyd) и 1- (3-C-этинил-β-D-рибопентофуранозил) уридин (EUrd) являются РНК-полимераза ингибиторы которые исследуются для использования в качестве противораковых препаратов.[18] Однако нуклеозид приобретает свою клиническую активность только после трех фосфорилирования; следовательно, UCK2 играет ключевую роль в инициации активации препарата. Альтернативная стратегия включает ингибирование UCK2 для блокирования спасения пиримидина в раковых клетках.[19] В некоторых линиях раковых клеток биосинтез пиримидина в основном происходит по спасительному пути.[20] Блокирование спасения пиримидина может предотвратить биосинтез ДНК и РНК, что приведет к снижению пролиферации клеток.
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ФторпиримидинActivity_WP1601».
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000143179 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000026558 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б «Ген Entrez: уридин-цитидинкиназа 2 UCK2».
- ^ а б c Судзуки Н.Н., Коидзуми К., Фукусима М., Мацуда А., Инагаки Ф. (май 2004 г.). «Структурные основы специфичности, катализа и регуляции уридин-цитидинкиназы человека». Структура. 12 (5): 751–64. Дои:10.1016 / j.str.2004.02.038. PMID 15130468.
- ^ а б c d Эпплби Т.К., Ларсон Дж., Чейни И.В., Уокер Х., Ву Дж.З., Чжун В., Хонг З., Яо Н. (март 2005 г.). «Структура уридин-цитидинкиназы 2 человека, определенная SIRAS с использованием генератора рентгеновских лучей с вращающимся анодом и одного производного самария». Acta Crystallographica Раздел D. 61 (Pt 3): 278–84. Дои:10.1107 / s0907444904032937. PMID 15735337.
- ^ Сьерра Х, Кордова М., Чен С.Дж., Раджадхьякша М. (февраль 2015 г.). «Лазерная абляция базальноклеточных карцином под контролем конфокальной визуализации: исследование ex vivo». Журнал следственной дерматологии. 135 (2): 612–615. Дои:10.1038 / jid.2014.371. ЧВК 4289436. PMID 25178106.
- ^ Томоике Ф, Накагава Н., Курамицу С., Масуи Р. (декабрь 2015 г.). «Структурные и биохимические исследования механизма реакции уридин-цитидинкиназы» (PDF). Белковый журнал. 34 (6): 411–20. Дои:10.1007 / s10930-015-9636-8. PMID 26510656.
- ^ а б c Ван Ромпей А.Р., Норда А., Линден К., Йоханссон М., Карлссон А. (май 2001 г.). «Фосфорилирование уридиновых и цитидиновых аналогов нуклеозидов двумя человеческими уридин-цитидин-киназами». Молекулярная фармакология. 59 (5): 1181–6. Дои:10.1124 / моль 59.5.1181. PMID 11306702.
- ^ Коидзуми К., Симамото Ю., Адзума А., Ватая Ю., Мацуда А., Сасаки Т., Фукусима М. (сентябрь 2001 г.). «Клонирование и экспрессия кДНК уридин / цитидинкиназы из клеток фибросаркомы человека». Международный журнал молекулярной медицины. 8 (3): 273–8. Дои:10.3892 / ijmm.8.3.273. PMID 11494055.
- ^ Канг Дж. Дж., Куни Д. А., Мойер Дж. Д., Келли Дж. А., Ким Х. Ю., Маркес В. Е., Джонс Д. Дж. (Январь 1989 г.). «Циклопентенилцитозинтрифосфат. Образование и ингибирование CTP-синтетазы». Журнал биологической химии. 264 (2): 713–8. PMID 2910861.
- ^ Schumacher FR, Wang Z, Skotheim RI, Koster R, Chung CC, Hildebrandt MA, Kratz CP, Bakken AC, Bishop DT, Cook MB, Erickson RL, Fosså SD, Greene MH, Jacobs KB, Kanetsky PA, Kolonel LN, Loud JT , Korde LA, Le Marchand L, Lewinger JP, Lothe RA, Pike MC, Rahman N, Rubertone MV, Schwartz SM, Siegmund KD, Skinner EC, Turnbull C, Van Den Berg DJ, Wu X, Yeager M, Nathanson KL, Chanock SJ, Cortessis VK, McGlynn KA (июль 2013 г.). «Восприимчивость к опухоли зародышевых клеток яичка, связанная с локусом UCK2 на хромосоме 1q23». Молекулярная генетика человека. 22 (13): 2748–53. Дои:10.1093 / hmg / ddt109. ЧВК 3674801. PMID 23462292.
- ^ Динс Р.М., Моргенс Д.В., Окесли А., Пиллэй С., Хорлбек М.А., Кампманн М., Гилберт Л.А., Ли А., Матео Р., Смит М., Гленн Дж. С., Каретт Дж. Э., Хосла С., Бассик М.С. (май 2016 г.). «Параллельные экраны shRNA и CRISPR-Cas9 позволяют идентифицировать мишени противовирусных препаратов». Природа Химическая Биология. 12 (5): 361–6. Дои:10.1038 / nchembio.2050. ЧВК 4836973. PMID 27018887.
- ^ Андерсон Э, Брокман Р. (1964). «Подавление обратной связи уридинкиназы цитидинтрифосфатом и уридинтрифосфатом». Biochimica et Biophysica Acta (BBA) - Специализированный раздел по нуклеиновым кислотам и связанным с ними предметам. 91 (3): 380–386. Дои:10.1016/0926-6550(64)90067-2. PMID 14254009.
- ^ Симамото Ю., Коидзуми К., Окабе Х., Казуно Х., Мураками Й., Накагава Ф., Мацуда А., Сасаки Т., Фукусима М. (01.07.2002). «Чувствительность раковых клеток человека к новому противораковому рибо-нуклеозиду TAS-106 коррелирует с экспрессией уридин-цитидинкиназы 2». Японский журнал исследований рака. 93 (7): 825–833. Дои:10.1111 / j.1349-7006.2002.tb01325.x. ЧВК 5927072. PMID 12149149.
- ^ Голицына Н.Л., Данехи FT, Fellows R, Cretton-Scott E, Standring DN (март 2010 г.). «Оценка роли трех кандидатов киназ человека в превращении 2'-C-метилцитидина ингибитора вируса гепатита C в его 5'-монофосфатный метаболит». Противовирусные исследования. 85 (3): 470–81. Дои:10.1016 / j.antiviral.2009.10.020. PMID 19883694.
- ^ Мурата Д., Эндо Ю., Обата Т., Сакамото К., Сёдзи И., Кадохира М., Мацуда А., Сасаки Т. (октябрь 2004 г.). «Решающая роль уридин / цитидинкиназы 2 в противоопухолевой активности 3'-этинил нуклеозидов». Метаболизм и утилизация лекарств. 32 (10): 1178–82. Дои:10.1124 / дмд.104.000737. HDL:2297/2651. PMID 15280220.
- ^ Малами И., Абдул А.Б., Абдулла Р., Бт Кассим Н.К., Вазири П., Кристофер Этти I. (апрель 2016 г.). «Открытие in Silico потенциальных ингибиторов уридин-цитидинкиназы 2 из корневища Alpinia mutica». Молекулы. 21 (4): 417. Дои:10.3390 / молекулы21040417. ЧВК 6274218. PMID 27070566.
- ^ ван ден Берг А. А., ван Ленте Х., Буш С., де Корте Д., ван Куйленбург А. Б., ван Геннип А. Х. (август 1994 г.). «Роли уридин-цитидинкиназы и CTP-синтетазы в синтезе CTP в злокачественных Т-лимфоцитарных клетках человека». Лейкемия. 8 (8): 1375–8. PMID 8057676.
дальнейшее чтение
- Сатлин А., Кучерлапати Р., Раддл Ф. Х. (1976). «Отнесение гена уридинмонофосфаткиназы человека к хромосоме 1 с использованием панелей гибридных клонов соматических клеток». Цитогенетика и клеточная генетика. 15 (3): 146–52. Дои:10.1159/000130513. PMID 172293.
- Джамиль Т.П., Swallow DM, Povey S (декабрь 1978 г.). «Сравнительное исследование возрастных закономерностей распада некоторых нуклеозидмонофосфаткиназ в эритроцитах человека». Биохимическая генетика. 16 (11–12): 1219–32. Дои:10.1007 / BF00484542. PMID 220950.
- Одзаки К., Куроки Т., Хаяси С., Накамура И. (сентябрь 1996 г.). «Выделение трех генов, специфичных для семенников (TSA303, TSA806, TSA903) методом дифференциального отображения мРНК». Геномика. 36 (2): 316–9. Дои:10.1006 / geno.1996.0467. PMID 8812458.
- Ван Ромпей А.Р., Йоханссон М., Карлссон А. (сентябрь 1999 г.). "Фосфорилирование монофосфатов аналога дезоксицитидина киназой UMP-CMP: молекулярная характеристика человеческого фермента". Молекулярная фармакология. 56 (3): 562–9. Дои:10,1124 / моль 56.3.562. PMID 10462544.
- Ван Ромпей А.Р., Норда А., Линден К., Йоханссон М., Карлссон А. (май 2001 г.). «Фосфорилирование уридиновых и цитидиновых аналогов нуклеозидов двумя человеческими уридин-цитидин-киназами». Молекулярная фармакология. 59 (5): 1181–6. Дои:10.1124 / моль 59.5.1181. PMID 11306702.
- Комацу Н., Кимура Ю., Кидо А., Оя М. (декабрь 1990 г.). «Полиморфизм уридинмонофосфаткиназы: популяционное исследование на японском языке и фенотипирование в пятнах крови». Международный журнал судебной медицины. 104 (1): 13–6. Дои:10.1007 / BF01816477. PMID 11453085.
- Коидзуми К., Шимамото Ю., Адзума А., Ватая Ю., Мацуда А., Сасаки Т., Фукусима М. (сентябрь 2001 г.). «Клонирование и экспрессия кДНК уридин / цитидинкиназы из клеток фибросаркомы человека». Международный журнал молекулярной медицины. 8 (3): 273–8. Дои:10.3892 / ijmm.8.3.273. PMID 11494055.
- Пирман А.Т., Кастро-Фариа-Нето ХК, Макинтайр TM, Прескотт С.М., Стаффорини Д.М. (октябрь 2001 г.). «Характеристика ферментативной активности киназы UMP-CMP человека и 5'-нетранслируемой области». Науки о жизни. 69 (20): 2361–70. Дои:10.1016 / S0024-3205 (01) 01322-4. PMID 11681623.
- Лиу Дж.Й., Дучман Г.Е., Лам В., Цзян Цз., Ченг Ю.С. (март 2002 г.). «Характеристика человеческой киназы UMP / CMP и ее фосфорилирование монофосфатов аналога D- и L-формы дезоксицитидина». Исследования рака. 62 (6): 1624–31. PMID 11912132.
- Кашуба Е., Кашуба В., Сандалова Т., Кляйн Г., Секели Л. (август 2002 г.). «Ядерный белок EBNA-3, кодируемый вирусом Эпштейна-Барра, связывает новую человеческую уридинкиназу / урацилфосфорибозилтрансферазу». BMC Cell Biology. 3: 23. Дои:10.1186/1471-2121-3-23. ЧВК 126255. PMID 12199906.
- Геваерт К., Гётальс М., Мартенс Л., Ван Дамм Дж., Стаес А., Томас Г. Р., Вандекеркхове Дж. (Май 2003 г.). «Изучение протеомов и анализ процессинга белков с помощью масс-спектрометрической идентификации отсортированных N-концевых пептидов». Природа Биотехнологии. 21 (5): 566–9. Дои:10.1038 / nbt810. PMID 12665801.
- Pasti C, Gallois-Montbrun S, Munier-Lehmann H, Veron M, Gilles AM, Deville-Bonne D (апрель 2003 г.). «Реакция киназы UMP-CMP человека с природными и аналоговыми субстратами». Европейский журнал биохимии. 270 (8): 1784–90. Дои:10.1046 / j.1432-1033.2003.03537.x. PMID 12694191.
- Судзуки Н.Н., Коидзуми К., Фукусима М., Мацуда А., Инагаки Ф. (август 2003 г.). «Кристаллизация и предварительный рентгеноструктурный анализ уридин-цитидинкиназы 2 человека». Acta Crystallographica Раздел D. 59 (Pt 8): 1477–8. Дои:10.1107 / S0907444903011533. PMID 12876357.
- Судзуки Н.Н., Коидзуми К., Фукусима М., Мацуда А., Инагаки Ф. (май 2004 г.). «Структурные основы специфичности, катализа и регуляции уридин-цитидинкиназы человека». Структура. 12 (5): 751–64. Дои:10.1016 / j.str.2004.02.038. PMID 15130468.
- Мурата Д., Эндо И., Обата Т., Сакамото К., Сёдзи И., Кадохира М., Мацуда А., Сасаки Т. (октябрь 2004 г.). «Решающая роль уридин / цитидинкиназы 2 в противоопухолевой активности 3'-этинил нуклеозидов». Метаболизм и утилизация лекарств. 32 (10): 1178–82. Дои:10.1124 / дмд.104.000737. HDL:2297/2651. PMID 15280220.
- Альденховен Дж, Чен Й, Моран С. (2006). «Отнесение UCK2, ATF3 и RGS18 из хромосомы 1 человека к хромосомам 4, 9 и 10 свиньи с соматическими и радиационными гибридными панелями». Цитогенетические и геномные исследования. 112 (3–4): 341F. Дои:10.1159/000089896. PMID 16484797.