Ксенон окситетрафторид - Xenon oxytetrafluoride
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ChemSpider | |
| |
| |
| Характеристики | |
| XeOF4 | |
| Молярная масса | 223,23 г / моль |
| Внешность | бесцветная жидкость |
| Плотность | 3,17 г / см3, жидкость |
| Температура плавления | -46,2 ° С (-51,2 ° F, 227,0 К) |
| Реагирует с водой | |
| Структура | |
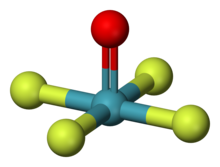
| квадратно-пирамидальный[1][2] | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Ксенон окситетрафторид (XeОF4) является неорганический химическое соединение. Бесцветная стабильная жидкость.[3][2] с температурой плавления −46,2 ° C[4] которые могут быть синтезированы частичным гидролизом XeF
6, или реакция XeF
6 с кремнезем[3] или же NaNO
3:[5]
- NaNO
3 + XeF
6 → NaF + XeOF
4 + FNO
2
Синтез с высоким выходом протекает по реакции XeF
6 с POF
3 при -196 ° С.[6]
Как и большинство оксидов ксенона, он чрезвычайно реакционноспособен и нестабилен и гидролизуется в воде с образованием опасно опасных и коррозионных продуктов, включая фтороводород:
- 2 XeOF4 + 4 часа2О → 2 Хе + 8 ВЧ + 3 О2
Кроме того, некоторые озон и фтор также образуются. Эта реакция чрезвычайно опасна, поэтому окситетрафторид ксенона следует хранить вдали от любых следов воды или водяного пара при любых условиях.
Реакции
XeOF4 реагирует с H2O в следующих шагах:
- XeOF4 + H2O → XeO2F2 + 2 ВЧ
- XeO2F2 + H2O → XeO3 + 2 ВЧ
В XeO3 образуется опасное взрывчатое вещество, взрывчатое разлагающееся на Xe и O2:
- 2 XeO3 → 2 Хе + 3 О2
В жидкой форме XeOF
4 проявляет амфотерное поведение, образуя комплексы с обоими сильными основаниями Льюиса, такими как CSF и сильные кислоты Льюиса, такие как SbF
5.[7] Он образует аддукт 1: 1 с XeF
2, изоструктурный с XeF
2·ЕСЛИ
5,[8] а также различные фториды тяжелых щелочных металлов.[4]
Реакция XeOF
4 с XeO
3 обеспечивает удобный путь синтеза для XeO
2F
2.[9]
внешняя ссылка
Рекомендации
- ^ Джозеф Мартинс; Э. Брайт Уилсон младший (1964). «Микроволновый спектр окситетрафторида ксенона». J. Chem. Phys. 41 (570): 570–571. Дои:10.1063/1.1725910.
- ^ а б Д. Ф. Смит (24 мая 1963 г.). «Ксенон оксифторид». Наука. 140 (3569): 899–900. Дои:10.1126 / science.140.3569.899. PMID 17810680. S2CID 42752536.
- ^ а б Джеймс А. Иберс (октябрь 1965 г.). "Молекулярная структура". Ежегодный обзор физической химии. 16: 375–396. Дои:10.1146 / annurev.pc.16.100165.002111.
- ^ а б Генри Селиг (1 февраля 1966 г.). «Комплексы тетрафторида оксида ксенона». Неорг. Chem. 5 (2): 183–186. Дои:10.1021 / ic50036a004.CS1 maint: дата и год (связь)
- ^ Карл О. Кристе; Уильям У. Уилсон (апрель 1988 г.). «Удобный синтез тетрафторида оксида ксенона». Неорг. Chem. 27 (7): 1296–1297. Дои:10.1021 / ic00280a043.CS1 maint: дата и год (связь)
- ^ Нильсен, Джон Б .; Kinkead, Scott A .; Эллер, П. Гэри (1 сентября 1990 г.). "Новый синтез окситетрафторида ксенона, XeOF
4". Неорг. Chem. 29 (18): 3621–3622. Дои:10.1021 / ic00343a063.CS1 maint: дата и год (связь) - ^ Д. Мартин-Рове; C.Angelié; M.Cauchetier; Г. Дж. Шробилген (сентябрь 1982 г.). «Различные аспекты реакционной способности оксифторида ксенона (VI): XeOF
4". Журнал химии фтора. 21 (1): 10. Дои:10.1016 / S0022-1139 (00) 85330-0. - ^ Н. Бартлетт; М. Вексберг (октябрь 1971 г.). "Комплексы дифторида ксенона XeF
2 · XeOF
4; XeF
2 · XeF
6 · AsF
5 и XeF
2 · 2 XeF
6 · 2 AsF
5 и их значение для полярности связи и донорской способности фторид-ионов XeF
2 и XeF
6". Z. Anorg. Allg. Chem. 385 (1). Дои:10.1002 / zaac.19713850103. - ^ Джон Л. Хьюстон (сентябрь 1967 г.). «Дифторид диоксида ксенона: выделение и некоторые свойства». J. Phys. Chem. 71 (10): 3339–3341. Дои:10.1021 / j100869a035.CS1 maint: дата и год (связь)
| Этот неорганический сложный –Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |
