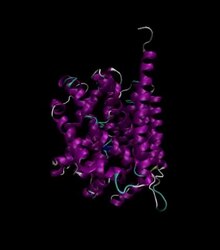
Бактериальный переносчик лейцина - Bacterial Leucine Transporter
| Бактериальный переносчик лейцина | |||||||
|---|---|---|---|---|---|---|---|
Молекулярно-динамическое моделирование LeuT, созданного с помощью GROMACS | |||||||
| Идентификаторы | |||||||
| Символ | LeuT | ||||||
| PDB | 3F3E | ||||||
| RefSeq | NC_000918.1. & Rn = 1 NP_214423.1. NC_000918.1. | ||||||
| UniProt | O67854 | ||||||
| |||||||
Бактериальный переносчик лейцина (LeuT) - это связка из двенадцати альфа спираль белок который принадлежит к семейству транспортеров, которые шаттл аминокислоты в и из бактериальный клетки. Специализируется на малых гидрофобный аминокислоты, такие как лейцин и аланин, этот транспортер питается от градиента натрий ионы, которые обычно поддерживаются здоровыми клетками через их мембраны. LeuT действует как сторонник, что означает, что он связывает прохождение иона натрия через клеточная мембрана с транспортом аминокислоты в том же направлении. Он был впервые кристаллизован, чтобы понять внутренние молекулярные механизмы антидепрессант '', так как он очень похож на переносчики нейромедиаторов человека (которые труднее кристаллизовать), которые эти препараты блокируют, тем самым подавляя обратный захват химических мессенджеров через клеточную мембрану нервов. аксоны и глиальные клетки.[1][2]
Структура

LeuT - это гомодимер состоит из двух одинаковых подразделения которые соприкасаются в двух точках. Каждая из этих полипептидных цепей имеет высоту около 70 и диаметр 48. Его формульный вес 58078,2 Да.[3]
В основном он состоит из гидрофобных остатков. Они контактируют с внутренней частью двухслойный, а гидрофильные остатки контактируют с внеклеточным и внутриклеточным пространством. Учитывая, что это трансмембранный белок, это важная характеристика, поскольку она может взаимодействовать как с водой, так и с фосфолипидами.
Вторичная конструкция этого транспортера состоит из двенадцати альфа спирали и два коротких бета-нити. Немного петли также можно найти, связав их.
Поскольку LeuT является симпортером и использует электрохимический потенциал ионов натрия для облегчения транспорта лейцина, как ионов натрия, так и гидрофобной аминокислоты, Лейцин (Leu), связываются с центром этого белка. Остатки, участвующие в этом связывании, расположены на 1, 3, 6 и 8 сегментах трансмембранной альфа-спирали.[3]
Функция
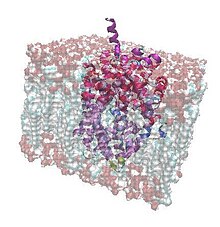
Бактериальный переносчик лейцина импортирует лейцин из внешней части клетки внутрь с помощью двух ионов натрия. Это гомолог белков, которые удаляют химические передатчики из синапса и помогают нейротрансмиссии, например серотонин, дофамин, норадреналин, глицин или же ГАМК Переносчики (-аминомасляной кислоты) в нейронах. Эти специфические транспортные белки очищают синапс после нервного сигнала, транспортируя нейромедиаторы обратно в аксон и делая его готовым к другому сигналу.[1][2]
LeuT - один из десятков переносчиков, которые переносят аминокислоты в бактериальные клетки и из них. Лейцин и аланин - основные аминокислоты, которые этот белок переносит через мембрану, поскольку он имеет высокое сродство к этим небольшим гидрофобным молекулам. Более того, гидрофобный характер поверхности белка хорошо дополняет гидрофобный характер клеточной мембраны. Транспорт приводится в движение градиентом ионов натрия, который создает разность электрических потенциалов между внутренним и внеклеточным пространством. LeuT действует как сторонник, интегральный мембранный белок, который работает как котранспортер соединение прохождения двух ионов натрия через мембрану с переносом аминокислоты в одном направлении, что делает процесс энергетически выгодным. Разница концентраций создает градиент электрохимического потенциала, который используется для катализирования поглощения органических субстратов (в данном случае лейцина). Транспорт не зависит от других источников энергии (например, АТФ).[3]
Переносчик лейцина, как и переносчики нейротрансмиттеров в нервных клетках, имеет связку из двенадцати альфа-спиралей, которые образуют транспортный канал через мембрану. Для этого этот бактериальный белок представляет собой мощную модель для изучения атомных деталей этих нервных белков. Гомологи LeuT человека зависят от ионов хлора, а также от концентрации ионов натрия: все они принадлежат к классу Na + / Cl-зависимых переносчиков.
Конформационное изменение
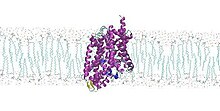
Считается, что белок действует как тумблер. Он открывается во внеклеточное пространство, так что ионы лейцина и натрия могут проникать в него и связываться с ним. После этого LeuT проходит конформационное изменение который выпускает обе частицы внутрь клетки. Считается, что два набора альфа-спиралей выполняют раскачивающее действие, непосредственно изменяя свою форму после связывания аминокислоты со структурой.[1][2]Это изменение необходимо для того, чтобы белок функционировал. Если с ним связано такое лекарство, как антидепрессант, транспортная активность резко снижается.
Связывание с антидепрессантами

LeuT был впервые кристаллизован Нью-Йоркским консорциумом по структуре мембранного белка (NYCOMPS) и другими исследователями из видов бактерий. Aquifex aeolicus с целью понимания основных молекулярных механизмов связывания антидепрессантов с их белками-мишенями, переносчики нейромедиаторов. Поскольку оказалось, что эти белки трудно кристаллизовать, LeuT стал многообещающим гомологом для стыковка этих препаратов.
Антидепрессанты, такие как селективные ингибиторы обратного захвата серотонина (СИОЗС) связываются в большой полости на внешнем входе в белок, не напрямую путем конкурентного ингибирования сайта связывания лейцина, но предположительно блокируя движение белка, которое необходимо для прохождения конформационного изменения, которое приводит к высвобождению лейцина. . Они удерживаются петлей для шпильки и соляным мостиком, окруженным лейцин (Leu25 / Leu29), глицин (Gly26), аргинин (Arg30), тирозин (Tyr108), изолейцин (Ile111) и фенилаланин (Phe253).[4]
Однако есть некоторые свидетельства того, что антидепрессанты могут немного глубже связываться с открытием переносчиков нейромедиаторов человека из-за их различий с LeuT; они представляют собой более упакованную структуру и удлинения на концах цепи, которые позволяют им взаимодействовать с другими белками нервной клетки.[2] В соответствии с этим, как видно на изображении ниже, гомология последовательностей между натрийзависимым переносчиком серотонина человека (мишенью SSRI) и LeuT составляет всего 21,5%, хотя трехмерная структура обоих белков имеет большое сходство.
LeuT - это лишь первый шаг в этой увлекательной истории. В 2013 г. в структуре переносчик дофамина был рентген кристаллизованный; такой успех проложил путь к лучшему пониманию этого процесса.

Выравнивание последовательностей переносчика серотонина человека и LeuT, полученное с использованием Clustal Omega:
"*" соответствует одной и той же аминокислоте // ":" соответствует консервативной замене (те же химические свойства) // "." учитывает полуконсервативную замену (аналогичная структура)
Смотрите также
- Активный транспорт
- Мембранный транспортный белок
- Транспортер нейротрансмиттера
- Фармакология антидепрессантов
Рекомендации
- ^ а б c Zhou Z, Zhen J, Karpowich NK, Goetz RM, Law CJ, Reith ME, Wang DN (сентябрь 2007 г.). «Структура LeuT-дезипрамина показывает, как антидепрессанты блокируют обратный захват нейротрансмиттера». Наука. Нью-Йорк, штат Нью-Йорк. 317 (5843): 1390–1393. Дои:10.1126 / science.1147614. ЧВК 3711652. PMID 17690258.
- ^ а б c d Сингх С.К., Ямасита А., Гуо Э. (август 2007 г.). «Сайт связывания антидепрессанта в бактериальном гомологе переносчиков нейромедиаторов». Природа. 448 (7156): 952–956. Дои:10.1038 / природа06038. PMID 17687333.
- ^ а б c PDB: 5F3E; Сингх С.К., Пискителли С.Л., Ямасита А., Гуо Э. (декабрь 2008 г.). «Конкурентоспособный ингибитор улавливает LeuT в открытой конформации». Наука. Нью-Йорк, штат Нью-Йорк. 322 (5908): 1655–1661. Дои:10.1126 / science.1166777. ЧВК 2832577. PMID 19074341.
- ^ Zhou Z, Zhen J, Karpowich NK, Law CJ, Reith ME, Wang DN (июнь 2009 г.). «Антидепрессивная специфичность транспортера серотонина, предложенная тремя структурами LeuT-SSRI». Структурная и молекулярная биология природы. 16 (6): 652–657. Дои:10.1038 / nsmb.1602. ЧВК 2758934. PMID 19430461.