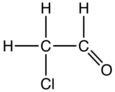
Хлорацетальдегид - Chloroacetaldehyde
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Хлорацетальдегид | |||
| Систематическое название ИЮПАК Хлорэтаналь | |||
| Другие имена 2-хлорацетальдегид 2-хлорэтаналь | |||
| Идентификаторы | |||
| |||
3D модель (JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.158 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C2ЧАС3ClO | |||
| Молярная масса | 78,50 г моль−1 | ||
| Внешность | Бесцветная жидкость | ||
| Запах | едкий, пронзительный[1] | ||
| Плотность | 1,117 г / мл | ||
| Температура плавления | -16,3 ° С (2,7 ° F, 256,8 К) | ||
| Точка кипения | От 85 до 85,5 ° C (от 185,0 до 185,9 ° F; от 358,1 до 358,6 K) | ||
| растворимый[1] | |||
| Растворимость | органические растворители | ||
| Опасности | |||
| Главный опасности | алкилирующий агент | ||
| точка возгорания | 87,7 ° C (189,9 ° F) (закрытая чашка) | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 89 мг / кг (перорально, крыса) 82 мг / кг (перорально, мышь)[3] | ||
LC50 (средняя концентрация ) | 200 частей на миллион (крыса, 1 час)[4] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | C 1 ppm (3 мг / м3)[2] | ||
REL (Рекомендуемые) | C 1 ppm (3 мг / м3)[2] | ||
IDLH (Непосредственная опасность) | 45 частей на миллион[2] | ||
| Родственные соединения | |||
Родственные соединения | 2-хлорэтанол, Хлоруксусная кислота | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Хлорацетальдегид является органическое соединение с формулой ClCH2СНО. Как и некоторые родственные соединения, это очень электрофильный реагент и потенциально опасный алкилирующий агент. Соединение обычно не встречается в безводный форма, а скорее как полуацеталь (ClCH2СН (ОН))2О.
Хлорацетальдегид является полезным промежуточным продуктом в синтезе 2-аминотиазол[1] включая фармацевтические препараты альтизид, политиазид, бротизолам и циклотизолам.[5] Еще одно применение - облегчить удаление коры со стволов деревьев.[1]
Синтез и реакции
Гидратированный хлорацетальдегид производится хлорирование водных винилхлорид:
- ClCH = CH2 + Cl2 + H2O → ClCH2CHO + 2 HCl
Его также можно приготовить из винилацетат[6] или осторожным хлорированием ацетальдегид.[1] Родственный бромацетальдегид получают путем бромирования винилацетат. Он также быстро образует ацетали в присутствии спиртов.[7]
Будучи бифункциональным, хлорацетальдегид является универсальным предшественником многих гетероциклические соединения. Он конденсируется с тиомочевина производные, чтобы дать аминотиазолы. Эта реакция была важна как предвестник сульфатиазол, один из первых сульфамидных препаратов.[6]
Безводный
Не содержащий воды хлорацетальдегид получают из гидрата путем азеотропная дистилляция с хлороформ, толуол или же четыреххлористый углерод. Безводный хлорацетальдегид обратимо превращается в полиацетали.[5][1] Вместо этого можно использовать менее реакционноспособные производные хлорацетальдегида для получения хлорацетальдегида или полного обхода его промежуточного образования: например, хлорацетальдегид диметилацеталь (2-хлор-1,1-диметоксиэтан) гидролизуется в кислых условиях с образованием хлорацетальдегида, который затем может быстро реагировать с другими реагентами[5] вместо полимеризации.
Полугидрат
Полугидрат образуется, как показано ниже. Он имеет температуру плавления 43–50 ° C, температуру кипения 85,5 ° C.[1]

Экологические аспекты
Хлорацетальдегид - это метаболит в деградации 1,2-дихлорэтан, который изначально преобразуется в хлорэтанол. Этот метаболический путь актуален, потому что 1,2-дихлорэтан вырабатывается в основном как предшественник винилхлорид.[8]
Безопасность
Хлорацетальдегид вызывает коррозию слизистые оболочки. Раздражает глаза, кожу и дыхательные пути.[1]
На основании данных, собранных в результате исследований на людях в 1962 году, было обнаружено, что воздействие 45 ppm хлорацетальдегида неприятно и вызывает раздражение конъюнктивы у субъектов.[9] В Управление по охране труда создал допустимый предел воздействия при максимальном уровне 1 ppm (3 мг / м3) для воздействия хлорацетальдегида.[10]
Рекомендации
- ^ а б c d е ж грамм час Индекс Merck. С. Будавари, М. О'Нил, А. Смит (12 изд.). Merck. 1996. стр. 2108. ISBN 9780911910124.CS1 maint: другие (связь)
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0118". Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Хлорацетальдегид». Национальный институт охраны труда и здоровья. 4 декабря 2014 г.. Получено 20 февраля 2015.
- ^ «Хлорацетальдегид». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c Кейджи, Т. (1992-10-30). «α-Хлоркарбонильные соединения: их синтез и применение (выпуск, посвященный памяти профессора Шигео Танимото в связи с выходом на пенсию)». Бюллетень Института химических исследований Киотского университета. 70 (3): 341. HDL:2433/77455. ISSN 0023-6071.
- ^ а б Джира, Рейнхард; Копп, Эрвин; McKusick, Blaine C .; Рёдерер, Герхард; Бош, Аксель; Флейшманн, Джеральд (2007). «Хлорацетальдегиды». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a06_527.pub2.
- ^ С. М. МакЭлвейн и Д. Кундигер. Органический синтез "Бромацеталь", 1943, том 23, с. 8. Дои:10.15227 / orgsyn.023.0008.
- ^ Janssen, D. B .; van der Ploeg, J. R. и Pries, F., "Генетика и биохимия разложения 1,2-дихлорэтана", Biodegradation, 1994, 5, 249-57.Дои:10.1007 / BF00696463
- ^ Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH)
- ^ CDC - Карманный справочник NIOSH по химической опасности