Циклоприсоединение - Википедия - Cycloaddition
А циклоприсоединение это химическая реакция, в котором «две или несколько ненасыщенных молекул (или частей одной и той же молекулы) объединяются с образованием циклического аддукта, в котором происходит чистое уменьшение кратности связи». Результирующая реакция представляет собой циклизация реакция. Многие, но не все циклоприсоединения согласованный и поэтому перициклический.[1] Неконцентрированные циклоприсоединения не являются перициклическими.[2] Как класс реакция присоединения, циклоприсоединения позволяют образовывать углерод-углеродную связь без использования нуклеофил или же электрофил.
Циклоприсоединения можно описать с помощью двух систем обозначений. Старые, но все еще распространенные обозначения основаны на размере линейного расположения атомов в реагентах. Оно использует скобки: (я + j + ...), где переменные - это числа линейных атомов в каждом реагенте. Изделие представляет собой цикл размеров (я + j + ...). В этой системе стандарт Реакция Дильса-Альдера является (4 + 2) -циклоприсоединением, 1,3-диполярное циклоприсоединение является (3 + 2) -циклоприсоединением и циклопропанирование карбена с алкеном a (2 + 1) -циклоприсоединение.[1]
Более поздняя, предпочтительная нотация IUPAC, впервые введенная Woodward и Hoffmann, использует квадратных скобках указать количество электроны, а не атомы углерода, участвующие в образовании продукта. В [я + j + ...], стандартная реакция Дильса-Альдера представляет собой [4 + 2] -циклоприсоединение, в то время как 1,3-диполярное циклоприсоединение также является [4 + 2] -циклоприсоединением.[1]
Термические циклоприсоединения и их стереохимия
Термические циклоприсоединения - это такие циклоприсоединения, при которых реагенты находятся в основном электронном состоянии. Обычно они имеют (4п + 2) π электронов, участвующих в исходном материале, для некоторого целого n. Эти реакции возникают по причинам: орбитальная симметрия в надфасциальный -упрофациальный или антарафациальный -антрафациальная манера (редко). Есть несколько примеров термических циклоприсоединений, которые имеют 4п π-электроны (например, [2 + 2] -циклоприсоединение). Они протекают в супрафациально-антарафациальном смысле, например, димеризация кетен, в которой ортогональный набор из p орбитали позволяет реакции протекать через скрещенный переходное состояние.
Фотохимические циклоприсоединения и их стереохимия
Циклоприсоединение с участием 4n π-электронов также может происходить через фотохимический активация. Здесь у одного компонента есть электрон, продвинутый из HOMO (π-связь) с LUMO (π * разрушение ). Таким образом, орбитальная симметрия такова, что реакция может протекать супрафациально-надфасциальным образом. Примером может служить Реакция ДеМайо. Другой пример показан ниже, фотохимическая димеризация коричная кислота.[3] Два транс алкены реагируют лицом к лицу, а изолированные изомеры называются труксилловые кислоты.
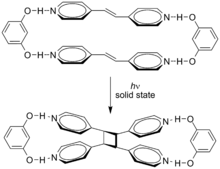
Супрамолекулярные эффекты может влиять на эти циклоприсоединения. Циклоприсоединение транс-1,2-бис (4-пиридил) этен направляется резорцин в твердое состояние в 100% урожай.[4]
Некоторые циклоприсоединения вместо π-связей действуют через напряженные циклопропан кольца, так как они имеют значащий π-характер. Например, аналогом реакции Дильса-Альдера является квадрициклан -DMAD реакция:
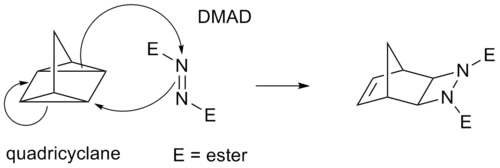
В обозначениях (i + j + ...) циклоприсоединения i и j относятся к числу атомов, участвующих в циклоприсоединении. В этих обозначениях реакция Дильса-Альдера представляет собой (4 + 2) циклоприсоединение и 1,3-диполярное присоединение, такое как первая стадия в озонолиз является (3 + 2) циклоприсоединением. В ИЮПАК однако предпочтительное обозначение с [i + j + ...] учитывает электроны, а не атомы. В этих обозначениях реакция DA и диполярная реакция становятся [4 + 2] циклоприсоединением. Реакция между норборнадиен и активированный алкин является [2 + 2 + 2] циклоприсоединением.
Типы циклоприсоединения
Реакции Дильса-Альдера
В Реакция Дильса-Альдера это, пожалуй, самая важная и обычно изучаемая реакция циклоприсоединения. Формально это реакция [4 + 2] циклоприсоединения и существует в огромном диапазоне форм, включая обратная реакция Дильса – Альдера с требованием электронов, Гексадегидро реакция Дильса-Альдера и связанные тримеризация алкинов. Реакцию также можно запустить в обратном направлении. ретро-реакция Дильса – Альдера.
Известны реакции с участием гетероатомов; в том числе аза-Дильс – Ольха и Реакция Имина Дильса – Альдера.
Циклоприсоединения Huisgen
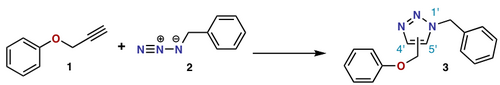
В Циклоприсоединение Huisgen реакция представляет собой (2 + 3) циклоприсоединение.
Циклоприсоединение нитрон-олефинов
В Циклоприсоединение нитрон-олефинов является (3 + 2) циклоприсоединением.
Катализируемое железом циклоприсоединение 2 + 2 олефинов
Железо [пиридин (диимин)] катализаторы содержат активный окислительно-восстановительный лиганд, в котором центральный атом железа может координироваться с двумя простыми нефункционализированными двойными связями олефина. Катализатор может быть записан как резонанс между структурой, содержащей неспаренные электроны с центральным атомом железа в степени окисления II, и структурой, в которой железо находится в степени окисления 0. Это дает ему гибкость для связывания двойных связей, когда они подвергаются реакции циклизации, генерируя циклобутановую структуру за счет C-C восстановительного отщепления; в качестве альтернативы циклобутеновую структуру можно получить отщеплением бета-водорода. Эффективность реакции существенно меняется в зависимости от используемых алкенов, но рациональный дизайн лиганда может позволить расширить диапазон реакций, которые могут быть катализированы.[5][6]
Хелетропные реакции
Хелетропные реакции являются подклассом циклоприсоединений. Ключевой отличительной чертой хелетропных реакций является то, что на одном из реагентов обе новые связи образуются с одним и тем же атомом. Классический пример - реакция диоксид серы с диен.
Другой
Существуют и другие реакции циклоприсоединения: [4 + 3] циклоприсоединения, [6 + 4] циклоприсоединения, [2 + 2] фотоциклоприсоединения, и [4 + 4] фотоциклоприсоединения
Формальные циклоприсоединения
Циклоприсоединения часто катализируются металлами и ступенчато. радикальный аналоги, однако это, строго говоря, не перициклические реакции. Когда в циклоприсоединении участвуют заряженные или радикальные промежуточные соединения или когда результат циклоприсоединения достигается в серии стадий реакции, их иногда называют формальные циклоприсоединения чтобы провести различие с истинными перициклическими циклоприсоединениями.
Один пример формального [3 + 3] циклоприсоединения между циклическими Enone и енамин катализируется п-бутиллитий это Аист енамин / 1,2-сложение каскадная реакция:[7]
![Межмолекулярная формальная [3 + 3] реакция циклоприсоединения](http://upload.wikimedia.org/wikipedia/commons/thumb/2/26/3%2B3-cycloaddition.svg/600px-3%2B3-cycloaddition.svg.png)
Рекомендации
- ^ а б c "циклоприсоединение", Сборник химической терминологии ИЮПАК, ИЮПАК, Дои:10.1351 / goldbook.C01496, получено 2018-10-13
- ^ «перициклическая реакция», Сборник химической терминологии ИЮПАК, ИЮПАК, Дои:10.1351 / goldbook.P04491, получено 2018-10-13
- ^ Хайн, Сара М. (июнь 2006 г.). «Исследование фотохимической перициклической реакции с использованием данных ЯМР». Журнал химического образования. 83 (6): 940–942. Bibcode:2006JChEd..83..940H. Дои:10.1021 / ed083p940.
- ^ Л. Р. Макгилливрей; Дж. Л. Рейд; Дж. А. Рипмистер (2000). «Супрамолекулярный контроль реакционной способности в твердом состоянии с использованием линейных молекулярных шаблонов». Варенье. Chem. Soc. 122 (32): 7817–7818. Дои:10.1021 / ja001239i.
- ^ Джордан М. Хойт; Валерия А. Шмидт; Аарон М. Тондро; Пол Дж. Чирик (2015-08-28). «Катализируемые железом межмолекулярные [2 + 2] циклоприсоединения неактивированных алкенов». Наука. 349 (6251): 960–963. Bibcode:2015Научный ... 349..960H. Дои:10.1126 / science.aac7440. PMID 26315433.
- ^ Майлз В. Смит; Фил С. Баран (28 августа 2015 г.). «Просто как [2 + 2]». Наука. 349 (6251): 925–926. Bibcode:2015Научный ... 349..925S. Дои:10.1126 / science.aac9883.
- ^ Мовассаги, Мохаммад; Бин Чен (2007). «Стереоселективная межмолекулярная формальная [3 + 3] реакция циклоприсоединения циклических енаминов и енонов». Энгью. Chem. Int. Эд. 46 (4): 565–568. Дои:10.1002 / anie.200603302. ЧВК 3510678. PMID 17146819.