Тримеризация алкинов - Alkyne trimerisation
An тримеризация алкинов реакция [2 + 2 + 2] реакция циклоприсоединения в котором три алкин единицы реагируют на формирование бензол звенеть. Для реакции требуется металлический катализатор. Процесс представляет исторический интерес, а также применим к органический синтез.[1] Являясь реакцией циклоприсоединения, имеет высокий атомная экономика. Было разработано множество вариантов, включая циклизацию смесей алкинов и алкенов, а также алкинов и нитрилы.
Механизм и стереохимия
Тримеризация ацетилена до бензола очень эксергонична, поскольку изменение свободной энергии составляет 142 ккал / моль при комнатной температуре. Однако кинетические барьеры мешают плавному протеканию реакции. Прорыв произошел в 1948 году, когда Reppe и Schweckendiek сообщили о своих результатах военного времени, показывая, что никель соединения являются эффективными катализаторами:[2][3]
- 3 RC2H → C6р3ЧАС3
Со времени этого открытия было сообщено о многих других циклотримеризациях.[4]
Механизм
Механически реакции начинаются с образования металлоалкиновые комплексы. Комбинация двух алкинов в координационной сфере дает металлациклопентадиен.[5] Исходя из интермедиата металлациклопентадиена, можно рассмотреть множество путей, включая металлоциклогептатриены, металланорборнадиены и более сложную структуру, содержащую карбеноидный лиганд.[4]
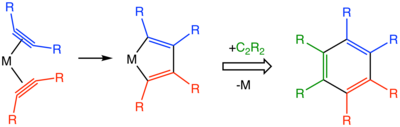
Используемые катализаторы включают циклопентадиенилкобальт дикарбонил и Катализатор Уилкинсона.
Стереохимия и региохимия
Тримеризация несимметричных алкинов дает два изомерных бензола. Например, фенилацетилен дает 1,3,5- и 1,2,4-C6р3ЧАС3. Картина замещения в продукте арена определяется в два этапа: образование промежуточного металлоциклопентадиена и включение третьего эквивалента алкин. Стерическая масса на алкин партнеры по сочетанию и катализатор рассматриваются как контролирующие элементы региоселективности.

Хиральный катализаторы использовались в сочетании с аринами для получения нерацемических атропоизомерный товары.[6]
Объем и ограничения
Катализаторы циклотримеризации селективны по тройным связям, что дает реакции достаточно широкий диапазон субстратов. Допускаются многие функциональные группы. Региоселективная межмолекулярная тримеризация несимметричных алкинов остается нерешенной проблемой.[4]
Возможно, наиболее полезной разработкой в этой области, по крайней мере с коммерческой точки зрения, является котмеризация нитрилы и алкины. Эта реакция - практический путь к некоторым замещенным пиридины.[7]
Некоторые катализаторы дезактивируются путем образования стабильной 18-электронной η4-комплексы. Циклобутадиен, циклогексадиен, и арена Все комплексы наблюдались как инактивированные катализаторы вне цикла.[8] Помимо полимеров высокого порядка, димеров и тримеров, которые происходят из-за низкой регио- и хемоселективности, Enyne наблюдались побочные продукты, полученные в результате димеризации алкинов. Родиевые катализаторы особенно хорошо подходят для образования енинов (см. Ниже).[9] За никель катализ, образование более крупных колец (особенно циклооктатетраен ) может быть проблемой.

Синтетические приложения
Циклизация с участием субстратов, в которых некоторые или все алкиновые звенья привязанный вместе могут обеспечить системы с плавкими кольцами. Длина троса (-ов) контролирует размеры дополнительных колец. Добавление 1,5-Diyne с алкином производит бензоциклобутен, а напряженный структура, которая затем может быть побуждена к дальнейшим реакциям.[10]

Все три алкиновых звена могут быть связаны, что приводит к созданию трех колец за один шаг, причем каждый из двух дополнительных размеров кольца контролируется соответствующей длиной привязи.[11]

Переполненные триыны могут переходить на продукты, выставленные спиральная хиральность. В одном примере, примечательном образованием трех новых ароматических колец за одну стадию, показанный трин превращается в спиральный продукт посредством обработки циклопентадиенилкобальт дикарбонил.[12] По состоянию на 2004 год этот процесс еще не стал асимметричным,[оригинальное исследование? ] но продукты можно разделить с помощью хирального ВЭЖХ.[12]Циклизация осуществляется с помощью Diyne а отдельный алкин обеспечивает больший контроль.[требуется разъяснение ] Использование имеющихся в продаже циклопентадиенилкобальт дикарбонил, CpCo (CO)2, как катализатор, бис (триметилсилил) ацетилен (BTMSA) будет реагировать с диин-1,2-дизамещенным бензолом с образованием антрохинон ароматическая система:[13]
Бензин, сгенерированный на месте от подшипника бензольного кольца орто -распределенный тройной и триметилсилил заместители, могут быть использованы для создания Арина вместо ацетилена и в сочетании с подходящим диином. Такое производное бензола реагирует с 1,7-октадиином в присутствии подходящего катализатора с образованием нафталиновой системы.[14] Это пример гексадегидро реакция Дильса – Альдера.

Сравнение с другими методами
Циклотримеризация представляет собой альтернативу функционализации предварительно образованных ароматических соединений посредством электрофильный или же нуклеофильный замена, региоселективность из которых иногда бывает трудно контролировать.
Другие методы прямого образования ароматических колец из замещенных ненасыщенных предшественников включают: Реакция Дёца, катализируемые палладием [4 + 2] бензаннуляция енинов с алкинами,[15] и опосредованное кислотой Льюиса [4 + 2] циклоприсоединение енинов к алкинам.[16] Циклизация переходных форм бензина с алкинами, катализируемая палладием, также может давать замещенные ароматические соединения.[17]

дальнейшее чтение
- Musso, F .; Solari, E .; Флориани, К. (1997). «Активация углеводородов с помощью галогенидов металлов: тетрахлорид циркония, катализирующий реакцию Якобсена и способствующий тримеризации алкинов посредством образования η6-Арен-циркониевые (IV) комплексы ». Металлоорганические соединения. 16 (22): 4889. Дои:10.1021 / om970438g.
- Родригес, Х. Гонсало; Мартин-Вильямил, Роза; Фонсека, Изабель (1997). «Трис (2,4-пентандионато) ванадий-катализируемая циклотримеризация и полимеризация 4- (N, N-диметиламино) фенилэтина: рентгеновская структура 1,2,4-трис [4- (N, N-диметиламино) фенила ]бензол". Журнал химического общества, Perkin Transactions 1 (6): 945–948. Дои:10.1039 / a605474i. ISSN 0300-922X.
- Sakurai, H .; Nakadaira, Y .; Хосоми, А .; Eriyama, Y .; Hirama, K .; Кабуто, К. (1984). «Химия кремнийорганических соединений. 193. Внутримолекулярная циклотримеризация макроциклических и ациклических триинов с карбонилами металлов 6 группы. Образование фульвена и бензола». Варенье. Chem. Soc. 106 (26): 8315. Дои:10.1021 / ja00338a063.
- Amer, I .; Бернштейн, Т .; Eisen, M .; Blum, J .; Воллхардт, К. П. С. (1990). «Олигомеризация алкинов с помощью RhCl.3Каталитическая система -аликват 336 Часть 1. Образование производных бензола ». J. Mol. Катал. 60 (3): 313. Дои:10.1016 / 0304-5102 (90) 85254-Ф.
- Lee, C.L .; Хант, К. Т .; Балч, А. Л. (1981). «Новые реакции связи металл-металл. Реакции Pd.2{(C6ЧАС5)2PCH2ПК6ЧАС5)2}2Cl2 с ацетиленами, олефинами и изотиоцианатами ». Неорг. Chem. 20 (8): 2498. Дои:10.1021 / ic50222a026.
- Aalten, H.L .; van Koten, G .; Riethorst, E .; Стам, К. Х. (1989). «Реакция Хертли. 2. Новые комплексы дизамещенных ацетиленов с бензоатами меди (I), имеющими реактивную орто-углерод-хлорную или углерод-бромную связь. Рентгеноструктурная характеристика тетракис (2-хлорбензоат) бис (диэтилацетилендикарбоксилат) тетракоппера ( Я)". Неорг. Chem. 28 (22): 4140. Дои:10.1021 / ic00321a020.
- Hardesty, J. H .; Koerner, J. B .; Олбрайт, Т. А .; Ли, Г. Б. (1999). «Теоретическое исследование тримеризации ацетилена с CpCo». Варенье. Chem. Soc. 121 (25): 6055. Дои:10.1021 / ja983098e.
- Озеров, О. В .; Патрик, Б. О .; Ладипо, Ф. Т. (2000). «Высоко региоселективное [2 + 2 + 2] циклоприсоединение терминальных алкинов, катализируемых η6-ареновыми комплексами титана, поддерживаемыми диметилсилил-мостиковым пара-трет-бутилкаликс [4] ареновым лигандом». Варенье. Chem. Soc. 122 (27): 6423. Дои:10.1021 / ja994543o.
Рекомендации
- ^ Agenet, N .; Buisine, O .; Словински, Ф .; Gandon, V .; Обер, С .; Малакрия, М. (2007). Котримеризация ацетиленовых соединений. Орг. Реагировать. 68. С. 1–302. Дои:10.1002 / 0471264180.or068.01. ISBN 978-0471264187.
- ^ Reppe, W .; Schweckendiek, W. J. (1948). "Cyclisierende Polymerisation von Acetylen. III Benzol, Benzolderivate und hydroaromatische Verbindungen". Liebigs Ann. Chem. 560: 104–116. Дои:10.1002 / jlac.19485600104.
- ^ Reppe, W .; Веттер, Х. (1953). "Carbonylierung VI. Synthesen mit Metallcarbonylwasserstoffen". Liebigs Ann. Chem. 585: 133–161. Дои:10.1002 / jlac.19535820107.
- ^ а б c d Broere, Daniel L.J .; Руйтер, Элко (2012). «Последние достижения в реакциях [2 + 2 + 2] -цикло (со) тримеризации, катализируемых переходными металлами». Синтез. 44: 2639–2672. Дои:10.1055 / с-0032-1316757.
- ^ Ма, Ванъян; Ю, Чао; Чен, Тяньян; Сюй, Линь; Чжан, Вэнь-Сюн; Си, Чжэньфэн (2017). «Металлациклопентадиены: синтез, строение и реакционная способность». Обзоры химического общества. 46 (4): 1160–1192. Дои:10.1039 / C6CS00525J. ISSN 0306-0012.
- ^ Шибата, Таканори; Цучикама, Кёдзи (2008). «Последние достижения в энантиоселективном [2 + 2 + 2] циклоприсоединении». Органическая и биомолекулярная химия. 6 (8): 1317. Дои:10.1039 / b720031e. ISSN 1477-0520.
- ^ Варела, Иисус; Саа, Карлос (20 марта 2003 г.). «Конструирование пиридиновых колец методом металл-опосредованного [2 + 2 + 2] циклоприсоединения». Химические обзоры. 103 (9): 3787–3802. Дои:10.1021 / cr030677f.
- ^ Kölle, U .; Фусс, Б. (1986). "Пентаметилциклопентадиенил-Übergangsmetall-Komplexe, X. Neue Co-Komplexe aus η"5-C5Мне5Co-Fragmenten und Acetylenen ". Chem. Ber. 119: 116–128. Дои:10.1002 / cber.19861190112.
- ^ Ardizzoia, G.A .; Brenna, S .; Cenini, S .; LaMonica, G .; Masciocchi, N .; Масперо, А. (2003). «Олигомеризация и полимеризация алкинов, катализируемых комплексами пиразолата родия (I)». J. Mol. Катал. A: химический. 204–205: 333–340. Дои:10.1016 / S1381-1169 (03) 00315-7.
- ^ Воллхардт, К. Питер К. (1984). «Кобальтсодержащие [2 + 2 + 2] циклоприсоединения: стратегия синтеза достигает зрелости». Angewandte Chemie. 96 (8): 525–41. Дои:10.1002 / ange.19840960804.
- ^ Neeson, S.J .; Стивенсон, П. Дж. (1988). «Катализируемые родием [2 + 2 + 2] циклоприсоединения - эффективный региоспецифический путь образования каломеланолактона». Tetrahedron Lett. 29 (7): 813. Дои:10.1016 / S0040-4039 (00) 80217-8.
- ^ а б Теплый, Ф .; Стара, И. Г .; Старый, И .; Колларович, А .; Саман, Д .; Рулисек, Л .; Фидлер, П. (2002). «Синтез 5-, 6- и 7-гелицена посредством катализируемой Ni (0) - или Co (I) изомеризации ароматических цис, цис-диентриинов». Варенье. Chem. Soc. 124 (31): 9175–80. Дои:10.1021 / ja0259584. PMID 12149022.
- ^ Hillard, R.L .; Воллхардт, К. П. С. (1977). «Замещенные бензоциклобутены, инданы и тетралины посредством катализируемой кобальтом кулигомеризации α, ω-диинов с замещенными ацетиленами. Образование и синтетическая полезность триметилсилилированных бензоциклоалкенов». Журнал Американского химического общества. 99 (12): 4058–4069. Дои:10.1021 / ja00454a026.
- ^ Hsieh, J.-C .; Cheng, C.-H. (2005). «Катализируемая никелем коциклотримеризация аринов с диинами; новый метод синтеза производных нафталина». Химические коммуникации. 2005 (19): 2459–2461. Дои:10.1039 / b415691a. PMID 15886770.
- ^ Геворгян, В .; Takeda, A .; Homma, M .; Sadayori, N .; Radhakrishnan, U .; Ямамото, Ю. (1999). «Катализируемая палладием [4 + 2] реакция кросс-бензаннулирования конъюгированных енинов с дийнами и триинами». Варенье. Chem. Soc. 121 (27): 6391. Дои:10.1021 / ja990749d.
- ^ Wills, M.S.B .; Данхайзер, Р. Л. (1998). "Реакции внутримолекулярного [4 + 2] циклоприсоединения конъюгированных инонов. Образование полициклических фуранов посредством образования и перегруппировки напряженных гетероциклических алленов". Варенье. Chem. Soc. 120 (36): 9378. Дои:10.1021 / ja9819209.
- ^ Sato, Y .; Тамура, Т .; Мори, М. (2004). «Арилнафталиновые лигнаны посредством катализируемой палладием 2 + 2 + 2 коциклизации аринов и диинов: полный синтез тайваньинов C и E». Энгью. Chem. Int. Эд. Англ.. 43 (18): 2436–40. Дои:10.1002 / anie.200453809. PMID 15114584.

