Соответствие Сейферта – Гилберта - Seyferth–Gilbert homologation
| Соответствие Сейферта – Гилберта | |
|---|---|
| Названный в честь | Дитмар Сейферт Джон С. Гилберт |
| Тип реакции | Реакция омологации |
| Идентификаторы | |
| Портал органической химии | Seyferth-Gilbert-омологация |
| RSC ID онтологии | RXNO: 0000387 |
В Соответствие Сейферта – Гилберта это химическая реакция из арил кетон 1 (или же альдегид ) с диметил (диазометил) фосфонатом 2 и трет-бутоксид калия дать замененный алкины 3.[1][2] Диметил (диазометил) фосфонат 2 часто называют Реагент Зейферта-Гилберта.[3]
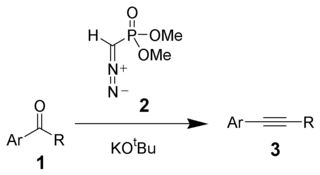
Эта реакция называется омологация потому что у товара ровно один дополнительный углерод больше, чем исходный материал.
Механизм реакции
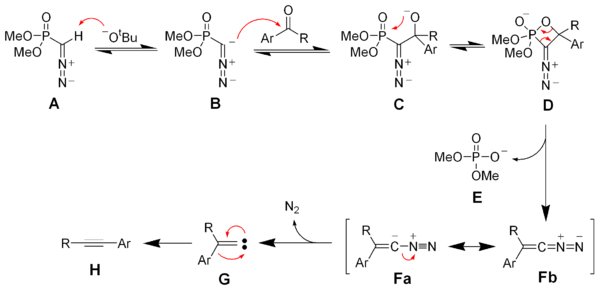
Депротонирование реактива Зейферта – Гильберта. А дает анион B, который реагирует с кетоном с образованием оксафосфетан D. Устранение диметилфосфата E дает винил диазо -средний Fa и Fb. Поколение азот газ дает винил карбен грамм, который через 1,2-миграция образует желаемый алкин ЧАС.
Модификация Bestmann
 | |
| Имена | |
|---|---|
| Название ИЮПАК диметил (1-диазо-2-оксопропил) фосфонат | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C5ЧАС9N2О4п | |
| Молярная масса | 192.11 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Диметил (диазометил) фосфонат может образовываться на месте из диметил-1-диазо-2-оксопропилфосфоната (также называемого Реагент Охира-Бестманна) по реакции с метанол и карбонат калия. Реакция реагента Бестмана с альдегидами дает концевые алкины часто с очень высоким выходом.[4][5]

Использование более мягкого карбоната калия делает эту процедуру более совместимой с широким спектром функциональные группы.
Улучшенный на месте создание реагента Охира-Бестманна

Недавно был разработан более безопасный и масштабируемый подход к синтезу алкинов из альдегидов. Этот протокол использует стабильный сульфонилазид, а не тозилазид, для на месте генерация реактива Охира-Бестманна.[6]
Прочие модификации
Другая модификация для менее реакционноспособных альдегидов заключается в замене карбоната калия на карбонат цезия в MeOH и приводит к резкому увеличению выхода.[7]
Смотрите также
Рекомендации
- ^ Д. Сейферт; Р. С. Мармор и П. Гильберт (1971). «Реакции диметилфосфонозамещенных диазоалканов. Перенос (MeO) 2P (O) CR на олефины и 1,3-диполярные добавки (MeO) 2P (O) C (N2) R». J. Org. Chem. 36 (10): 1379–1386. Дои:10.1021 / jo00809a014.
- ^ Дж. К. Гилберт и У. Вирасурия (1982). «Диазоэтены: их попытка синтеза из альдегидов и ароматических кетонов посредством модификации Хорнера-Эммонса реакции Виттига. Простой синтез алкинов». J. Org. Chem. 47 (10): 1837–1845. Дои:10.1021 / jo00349a007.
- ^ Д. Г. Браун; Э. Дж. Велтуйзен; Дж. Р. Коммерфорд; Р. Г. Брисбуа и Т. Х. Хой (1996). «Удобный синтез диметил (диазометил) фосфоната (реагент Сейферта / Гилберта)». J. Org. Chem. 61 (7): 2540–2541. Дои:10.1021 / jo951944n.
- ^ С. Мюллер; Б. Липольд; Г. Рот и Х. Дж. Бестманн (1996). «Улучшенная процедура в одном горшке для синтеза алкинов из альдегидов». Synlett. 1996 (6): 521–522. Дои:10.1055 / с-1996-5474.
- ^ Г. Рот; Б. Липольд; С. Мюллер и Х. Дж. Бестманн (2004). «Дальнейшее улучшение синтеза алкинов из альдегидов». Синтез. 2004 (1): 59–62. Дои:10.1055 / с-2003-44346.
- ^ Джепсен, T.H, Кристенсен, J.L. J. Org. Chem. 2014, "На месте Получение реагента Охира – Бестмана из стабильного сульфонилазида: масштабируемый синтез алкинов из альдегидов ». http://pubs.acs.org/doi/abs/10.1021/jo501803f
- ^ Лидия Бондаренко; Ина Дикс; Хайно Хинрихс; Хеннинг Хопф (2004). «Циклофаны. Часть LII: 1 Этинил [2.2] парациклофаны - Новые строительные блоки для молекулярных каркасов». Синтез. 2004 (16): 2751–2759. Дои:10.1055 / с-2004-834872.
