Восстановление нитрила - Nitrile reduction
В восстановление нитрила а нитрил является уменьшенный либо амин или альдегид подходящим химическим реагентом.[1][2]
Каталитическое гидрирование
В каталитический гидрирование нитрилов часто является наиболее экономичным способом производства начальный амины.[3] Катализаторы реакции часто включают: группа 10 металлы, такие как Никель Ренея,[4][5][6] палладий черный, или же диоксид платины.[1] Однако другие катализаторы, такие как борид кобальта, также может быть селективный для производства первичного амина:
- R-C≡N + 2 H2 → R-CH2NH2
Коммерческое применение этой технологии включает производство гексаметилендиамин из адипонитрил, а предшественник к Нейлон 66.[7]
В зависимости от условия реакции, средний имины может также подвергаться атаке аминов, чтобы позволить вторичный и высшее амины:
- 2 р-C≡N + 4 ч.2 → (R-CH2)2NH + NH3
- 3 р-C≡N + 6 ч2 → (R-CH2)3N + 2 NH3
Такие реакции протекают через енамин промежуточные звенья.[8] Наиболее важным условием реакции для селективного получения первичного амина является выбор катализатора.[1] Другие важные факторы включают: растворитель выбор, решение pH, стерические эффекты, температура и давление водорода.
Стехиометрические сокращения
Восстановители для некаталитического превращения в амины включают литийалюминийгидрид, борогидрид лития,[9] диборан,[10] или элементаль натрий в алкоголь растворители.[11]
Альдегидам
Нитрилы также могут быть восстановлены до альдегиды. В Синтез альдегида Стивена использует Хлорид олова (II) и соляная кислота чтобы получить альдегид через гидролиз итогового иминий соль. Альдегиды также могут образовываться с использованием донор водорода с последующим на месте гидролиз имина. Полезный реагенты для этой реакции включают муравьиная кислота с катализатором гидрирования[12] или металл гидриды которые используются для добавления одного моля водорода к нитрилу. Например, борогидрид натрия восстанавливает нитрилы в спиртовых растворителях с CoCl2 катализатор или Никель Ренея.[13] Восстановитель Гидрид диизобутилалюминия, или DIBAL-H, является другим обычно используемым гидридом металла. DIBAL-H действует как источник гидрида, добавляя ион гидрида к углероду нитрила. Полученный имин является относительно стабильным промежуточным продуктом, который может быть гидролизованный к альдегиду.[14]
Механизм
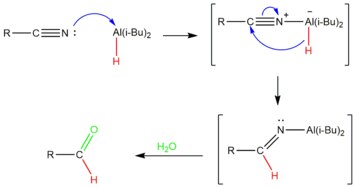
DIBAL-H добавляют в контролируемых количествах при низких температурах для частичного восстановления нитрила.[15] Атом алюминия в DIBAL действует как Кислота Льюиса, принимая электронную пару от нитрила. Затем нитрил восстанавливается переносом иона гидрида на углерод тройной связи углерод-нитрил с образованием имина. После тренировка с водой алюминиевый комплекс гидролизуется с образованием желаемого альдегида.[16] Поскольку гидролитическая обработка приводит к образованию альдегида, нитрил не подвергается чрезмерному восстановлению.
Электрохимические методы
Бензонитрилы также могут быть восстановлены электрохимически.[17][18]
Смотрите также
Рекомендации
- ^ а б c Нисимура, Шигео (2001). Справочник по гетерогенному каталитическому гидрированию для органического синтеза (1-е изд.). Нью-Йорк: Wiley-Interscience. С. 254–277. ISBN 9780471396987.
- ^ Марш, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7
- ^ Карстен, Эллер; Хенкес, Эрхард; Россбахер, Роланд; Хёке, Хартмут (2000). «Амины алифатические». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a02_001. ISBN 3527306730.
- ^ Biggs, B.S .; Bishop., W. S. (1947). «Декаметилендиамин». Органический синтез. 29: 18. Дои:10.15227 / orgsyn.027.0018.
- ^ Allen, C.F.H .; Уилсон, К. В. (1947). «2,4-Дифенилпиррол». Органический синтез. 27: 33. Дои:10.15227 / orgsyn.027.0033.
- ^ Робинсон, Джон С .; Снайдер, Х. Р. (1943). «β-Фенилэтиламин». Органический синтез. 23: 71. Дои:10.15227 / orgsyn.023.0071.
- ^ Массер, Майкл Таттл (2000). «Адипиновая кислота». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a01_269. ISBN 3527306730.
- ^ Барро, Дж. (1997). «Синтез жирных аминов. Контроль селективности в присутствии многофункциональных катализаторов». Катализ сегодня. 37 (2): 137–153. Дои:10.1016 / S0920-5861 (97) 00006-0.
- ^ Оокава, Атсухиро; Соай, Кенсо (1986). «Смешанные растворители, содержащие метанол в качестве полезной реакционной среды для уникального хемоселективного восстановления борогидрида лития». Журнал органической химии. 51 (21): 4000–4005. Дои:10.1021 / jo00371a017.
- ^ Hutchins, R.O .; Марьянов, Б. Э. (1973). «2-трет-Бутил-1,3-диаминопроан». Органический синтез. 53: 21. Дои:10.15227 / orgsyn.053.0021.
- ^ Suter, C.M .; Моффетт, Юджин В. (1934). «Восстановление алифатических цианидов и оксимов натрием и н-бутиловым спиртом». Журнал Американского химического общества. 56 (2): 487. Дои:10.1021 / ja01317a502.
- ^ van Es, T .; Стаскун, Б. (1971). «4-Формилбензолсульфонамид». Органический синтез. 51: 20. Дои:10.15227 / orgsyn.051.0020.
- ^ 17-, Смит, Майкл, октябрь 1946 г. (2001 г.). Продвинутая органическая химия марта: реакции, механизмы и структура. Марш, Джерри, 1929–1997 гг., Марш, Джерри, 1929–1997 годы. (5-е изд.). Нью-Йорк: Вили. ISBN 9780471585893. OCLC 43936853.CS1 maint: числовые имена: список авторов (связь)
- ^ Кэри, Ф. А .; Sundberg, R.J .; Продвинутая органическая химия, часть B: Реакции и синтез
- ^ 1937-, Кэри, Фрэнсис А. (2000). Продвинутая органическая химия. Сандберг, Ричард Дж., 1938- (4-е изд.). Нью-Йорк: Kluwer Academic / Plenum Pub. ISBN 0306462435. OCLC 43555205.CS1 maint: числовые имена: список авторов (связь)
- ^ Solomons, T. W. G, Craig B. Fryhle и S. A. Snyder. Органическая химия. , 2014. Печать.
- ^ В. Кришнан; А. Мутукумаран; Х. В. К. Удупа (1979). «Электровосстановление цианида бензила на катодах из железа и кобальта». Журнал прикладной электрохимии. 9 (5): 657–659. Дои:10.1007 / BF00610957.
- ^ В. Кришнан; А. Мутукумаран; Х. В. К. Удупа (1983). Процесс электрохимического получения бета-фенилэтиламина с использованием кобальтового черного катода (PDF). Калькутта: Патентное ведомство Индии.
