Олигопептид - Oligopeptide
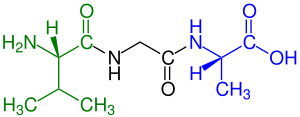
зеленый отмечен амино конец (L-валин ) и
синий отмечен карбоксильный конец (L-аланин )

зеленый отмечен амино конец (L-валин ) и
синий отмечен карбоксильный конец (L-аланин )
An олигопептид, часто просто звонят пептид (олиго-, "несколько"), состоит из двух-двадцати аминокислоты и может включать дипептиды, трипептиды, тетрапептиды, и пентапептиды. Некоторые из основных классов встречающихся в природе олигопептидов включают: аэругинозины, цианопептолины, микроцистины, микровиридины, микрогинины, анабаенопептины, и цикламиды. Микроцистины лучше всего изучены из-за их потенциального токсического воздействия на питьевую воду.[1] Обзор некоторых олигопептидов показал, что самый большой класс - это цианопептолины (40,1%), за которыми следуют микроцистины (13,4%).[2]
Производство
Классы олигопептидов производятся нерибосомальные пептиды синтазы (NRPS), за исключением цикламидов и микровиридинов, синтезируются через рибосомный пути.[3]
Примеры
Примеры олигопептидов включают:[4]
- Аманитины - Циклические пептиды, полученные из карпофоров нескольких различных видов грибов. Они являются мощными ингибиторами РНК-полимеразы у большинства видов эукариот они предотвращают производство мРНК и синтез белка. Эти пептиды важны при изучении транскрипции. Альфа-аманитин - главный токсин вида Мухомор фаллоидный, ядовит при проглатывании людьми или животными.
- Antipain - олигопептид, продуцируемый различными бактериями, который действует как протеаза ингибитор.
- Церулетид - Специфический декапептид, обнаруженный в коже Hyla Caerulea, то Австралийская зеленая квакша. Церулетид имеет много общего в отношении действия и состава холецистокинин. Стимулирует секрецию желудка, желчных путей и поджелудочной железы; и некоторые гладкая мышца. Он используется, чтобы побудить панкреатит в экспериментальных моделях животных.
- Глутатион - Трипептид, выполняющий множество функций в клетках. Он соединяется с лекарствами, чтобы сделать их более растворимыми для выведения, является кофактором некоторых ферментов, участвует в перегруппировке дисульфидных связей белка и снижает количество пероксидов.
- Лейпептины - Группа ацилированных олигопептидов, продуцируемых актиномицетами, которые действуют как ингибиторы протеаз. Известно, что они в разной степени подавляют трипсин, плазмин, калликрейнс, папаин и катепсины.
- Нетропсин - Основной олигопептид, выделенный из Streptomyces netropsis. Он цитотоксичен, и его сильное специфическое связывание с участками А-Т ДНК полезно для генетических исследований.
- Пепстатины - N-ацилированные олигопептиды, выделенные из фильтрата культур актиномицетов, которые действуют специфически, ингибируя кислотные протеазы, такие как пепсин и ренин.
- Пептид Т - N-(N-(N(2)-(N-(N-(N-(N-D-Аланил L-серил) -L-треонил) -L-треонил) L-треонил) -L-аспарагинил) -L-тирозил) L-реонин. Гомология последовательности октапептида с белком оболочки gp120 ВИЧ. Он может быть полезен в качестве противовирусного средства при лечении СПИДа. Основная пентапептидная последовательность TTNYT, состоящая из аминокислот 4-8 в пептиде Т, представляет собой последовательность оболочки ВИЧ, необходимую для прикрепления к рецептору CD4.
- Фаллоидин - Очень токсичный полипептид, выделенный в основном из Мухомор фаллоидный (Agaricaceae) или смертельный колпак; вызывает смертельное поражение печени, почек и ЦНС при отравлении грибами; используется при изучении поражения печени.
- Тепротид - Искусственный нонапептид (Pyr-Trp-Pro-Arg-Pro-Gln-Ile-Pro-Pro), который точно такой же, как пептид из яда змеи, Bothrops jararaca. Он ингибирует кининазу II и АНГИОТЕНСИН I и был предложен в качестве антигипертензивного средства.
- Tuftsin - N(2)-((1-(N(2)-L-Треонил) -L-лизил) -L-пролил) -L-аргинин. Тетрапептид, продуцируемый в селезенке ферментативным расщеплением лейкофильного гамма-глобулина. Стимулирует фагоцитарную активность полиморфно-ядерных лейкоцитов крови и, в частности, нейтрофилов. Пептид находится во фрагменте Fd молекулы гамма-глобулина.
Смотрите также
использованная литература
- ^ Мартин Велкер и Ханс фон Дёрен (2006). «Цианобактериальные пептиды - комбинаторный биосинтез природы». Обзор микробиологии FEMS. 30 (4): 530–563. Дои:10.1111 / j.1574-6976.2006.00022.x. PMID 16774586.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Джордж Э. Члипала, Шуньян Мо и Джимми Орджала (2011). «Химическое разнообразие пресноводных и наземных цианобактерий - источник для открытия лекарств». Curr Drug Targets. 12 (11): 1654–73. Дои:10.2174/138945011798109455. ЧВК 3244969. PMID 21561419.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Рамси Ага, Самуэль Сирес, Ларс Вёрмер и Антонио Кесада (2013). «Ограниченная стабильность микроцистинов в олигопептидных композициях Microcystis aeruginosa (Cyanobacteria): значение для определения хемотипов». Токсины. 5 (6): 1089–1104. Дои:10.3390 / токсины5061089. ЧВК 3717771. PMID 23744054.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Аргос, Патрик. «Исследование связывающих доменов олигопептидов в третичных структурах белков и возможных кандидатов для общего слияния генов» (PDF). Европейская лаборатория молекулярной биологии. Архивировано из оригинал (PDF) 28 июля 2014 г.. Получено 28 июля 2014.
внешние ссылки
- Структурная биохимия / Белки / Аминокислоты (Викиучебники)
