Дипептид - Dipeptide
А дипептид является органическое соединение полученный из двух аминокислоты. Составляющие аминокислоты могут быть одинаковыми или разными. Если они различны, возможны два изомера дипептида в зависимости от последовательности. Некоторые дипептиды имеют физиологическое значение, а некоторые имеют как физиологическое, так и коммерческое значение. Хорошо известный дипептид - это аспартам, заменитель сахара.[1]
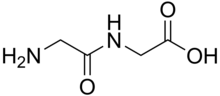
Дипептиды - белые твердые вещества. Многие из них гораздо более растворимы в воде, чем исходные аминокислоты.[1] Например, дипептид Ala-Gln имеет растворимость на 586 г / л, что более чем в 10 раз превышает растворимость Gln (35 г / л). Дипептиды также могут обладать различной стабильностью, например в отношении гидролиза. Gln не выдерживает процедур стерилизации, в отличие от этого дипептида. Поскольку дипептиды склонны к гидролизу, их высокая растворимость используется в инфузиях, то есть для обеспечения питания.[2]
Примеры

Коммерческая ценность
Коммерческий интерес представляют около шести дипептидов.[1]
- Аспартам (N-L-α-аспартил-L-фенилаланин 1-метиловый эфир) является искусственным подсластитель.
- Карнозин (бета-аланил-L-гистидин) и Ансерин (бета-аланил-N-метилгистидин) высококонцентрированы в мышца и ткани мозга. Они используются в спортивных лекарствах.
- Ацетилкарнозин, профилактика катаракты
- Ала-Глн и Гли-Тюр, настой[2]
- Вал-Тир, гипотензивный
Другие дипептиды
- Гомоансерин (N- (4-аминобутирил) -L-гистидин) - еще один дипептид, обнаруженный в мозге и мышцах млекопитающих.
- Киоторфин (L-тирозил-L-аргинин) является нейроактивный дипептид который играет роль в регуляции боли в мозге.
- Баленин (или офидин) (бета-аланил-N тау-метилгистидин) был обнаружен в мышцах нескольких видов млекопитающих (включая человека), а курица.
- Глорин (N-пропионил-γ-L-глутамил-L-орнитин-δ-лак этиловый эфир) представляет собой хемотаксический дипептид для слизь Polysphondylium violaceum.
- Бареттин (цикло - [(6-бром-8-ен-триптофан) -аргинин]) представляет собой циклический дипептид от морская губка Геодия Барретти.
- Псевдопролин
- Диаланин обычно используется в качестве модели в Молекулярная динамика.
Производство
Синтетические дипептиды
Дипептиды производятся связыванием аминокислот. Аминогруппа одной аминокислоты становится ненуклеофильной (P в экв.), А группа карбоновой кислоты во второй аминокислоте дезактивируется как ее метиловый эфир. Затем две модифицированные аминокислоты объединяют в присутствии связующего агента, который облегчает образование амидной связи:
- RCH (NHP) CO2H + R'CH (NH2) CO2CH3 → RCH (NHP) C (O)NH (CHR ') CO2CH3 + H2О
После этой реакции сочетания аминозащитная группа P и сложный эфир превращаются в свободный амин и карбоновую кислоту соответственно.[3]
Для многих аминокислот вспомогательными функциональными группами являются защищенный. При конденсации амина и карбоновой кислоты с образованием пептидной связи обычно используются связующие агенты для активации карбоновой кислоты.[4]
В Синтез азлактонового пептида Бергмана это классика органический синтез для приготовления дипептидов.[1]
Биосинтез
Дипептиды производятся из полипептиды действием гидролаза фермент дипептидилпептидаза.[5] Пищевые белки перевариваются до дипептидов и аминокислот, и дипептиды всасываются быстрее, чем аминокислоты, поскольку их поглощение включает отдельный механизм. Дипептиды активируют G-клетки найдено в желудке для выделения гастрин.
Дикетопиперазины (циклические дипептиды)

Дикетопиперазины представляют собой особый класс дипептидов, которые являются циклическими. Они образуются как побочные продукты при синтезе пептидов. Многие из них были произведены из неканонических аминокислот.[7]
Рекомендации
- ^ а б c d Ягасаки, Макото; Хашимото, Син-ичи (2008). «Синтез и применение дипептидов; современное состояние и перспективы». От прикладной микробиологии и биотехнологии. 81 (1): 13–22. Дои:10.1007 / s00253-008-1590-3. PMID 18795289.
- ^ а б Ферст, Питер; Поган, Карин; Стеле, Питер (1997). «Дипептиды глутамина в лечебном питании». Питание. 13 (7–8): 731–7. Дои:10.1016 / S0899-9007 (97) 83035-3. PMID 9263278.
- ^ Субирос-Фуносас, Айман эль-Фахам; Фернандо Альберисио (2013). «Образование пептидной связи с низкой эпимеризацией с помощью Oxyma Pure: получение Z-L-Phg-Val-OMe». Орг. Синтезатор. 90: 306. Дои:10.15227 / orgsyn.090.0306.
- ^ Жан-Симон Суппо; Рената Марсия де Фигейредо; Жан-Марк Кампань (2015). «Дипептидные синтезы с помощью активированных α-аминоэфиров». Орг. Синтезатор. 92: 296–308. Дои:10.15227 / orgsyn.092.0296.
- ^ Стейн, Ричард. «Гидролиз дипептида». БиоТопики. Получено 28 июля 2014.
- ^ Бортвик А.Д., Лиддл Дж. (Январь 2013 г.). «Ретосибан и Эпельсибан: мощные и селективные пероральные антагонисты окситоцина». В Domling A (ред.). Методы и принципы медицинской химии: белок-белковые взаимодействия в открытии лекарств. Вайнхайм: Wiley-VCH. С. 225–256. ISBN 978-3-527-33107-9.
- ^ Бортвик, А. Д. (2012). «2,5-Дикетопиперазины: синтез, реакции, медицинская химия и биоактивные натуральные продукты». Chem. Rev. 112 (7): 3641–716. Дои:10.1021 / cr200398y. PMID 22575049.
внешняя ссылка
- Введение в дипептиды в PeptideGuide.
