Патофизиология болезни Паркинсона - Википедия - Pathophysiology of Parkinsons disease
| Смерть нейронов в головном мозге БП | |
|---|---|
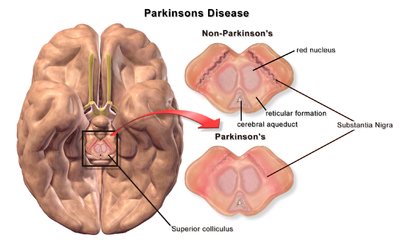 | |
| Мозг без болезни Паркинсона и с ней в сравнении с черной субстанцией |
В патофизиология болезни Паркинсона является смерть из дофаминергический нейроны в результате изменения биологической активности головного мозга по отношению к болезнь Паркинсона (PD). Предлагается несколько механизмов для нейронный смерть в ПД; однако не все из них хорошо изучены. Пять предложенных основных механизмов гибели нейронов при болезни Паркинсона включают агрегацию белков в Тела Леви, нарушение аутофагия, изменения клеточного метаболизма или митохондриальный функция нейровоспаление, и гематоэнцефалический барьер (BBB) разрушение, приводящее к утечке сосудов.[1]
Агрегация белков
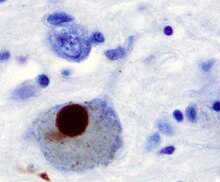
Первой основной предполагаемой причиной гибели нейронов при болезни Паркинсона является связывание или олигомеризация белки. Протеин альфа-синуклеин имеет повышенное присутствие в мозге пациентов с болезнью Паркинсона и, поскольку α-синуклеин нерастворим, он агрегаты формировать Тела Леви (показано слева) в нейронах. Традиционно тельца Леви считались основной причиной гибели клеток при болезни Паркинсона; однако более поздние исследования показывают, что тельца Леви вызывают другие эффекты, вызывающие гибель клеток.[2] Тем не менее, тельца Леви широко известны как патологический маркер болезни Паркинсона.
Тела Леви впервые появляются в обонятельная луковица, продолговатый мозг, и pontine tegmentum; пациенты на этой стадии протекают бессимптомно. По мере прогрессирования болезни тельца Леви развиваются в черная субстанция, районы средний мозг и базальный передний мозг, а в неокортекс.
Этот механизм подтверждается тем фактом, что α-синуклеин не обладает токсичностью, когда не может образовывать агрегаты; что белки теплового шока, которые способствуют рефолдингу белков, чувствительных к агрегации, благотворно влияют на PD при сверхэкспрессии; и те реагенты, которые нейтрализуют агрегированные виды, защищают нейроны в клеточных моделях сверхэкспрессии α-синуклеина.[3]
Альфа-синуклеин является ключевым звеном между сокращенным Ремонт ДНК и болезнь Паркинсона.[4] Альфа-синуклеин активирует АТМ (атаксия-телеангиэктазия мутировал), крупный Повреждение ДНК ремонт сигнализации киназа. Альфа-синуклеин связывается с разрывами в двухцепочечной ДНК и облегчает процесс восстановления ДНК негомологичное соединение концов.[5] Было предложено [5] что цитоплазматическая агрегация альфа-синуклеина с образованием Тела Леви снижает его ядерные уровни, что приводит к снижению репарации ДНК, увеличению двухцепочечных разрывов ДНК и увеличению запрограммированная гибель клеток из нейроны.
Нарушение аутофагии

Второй основной предложенный механизм гибели нейронов при болезни Паркинсона, аутофагия, представляет собой механизм, с помощью которого внутренние компоненты ячейки разрушаются и используются повторно.[2][6] Было показано, что аутофагия играет важную роль в здоровье мозга, помогая регулировать клеточные функции. Нарушение механизма аутофагии может привести к нескольким различным типам заболеваний, таким как болезнь Паркинсона.[6][7]
Также было показано, что дисфункция аутофагии при болезни Паркинсона приводит к нарушению регуляции деградация митохондрий.[8]
Изменения клеточного метаболизма

Третья основная предполагаемая причина гибели клеток при болезни Паркинсона связана с выработкой энергии. митохондрия органелла. При болезни Паркинсона нарушается функция митохондрий, что препятствует выработке энергии и приводит к смерти.[9][10]
Предполагается, что механизм митохондриальной дисфункции при болезни Паркинсона заключается в следующем: РОЗОВЫЙ1 и Паркин комплекс, который, как было показано, управляет аутофагией митохондрий (также известный как митофагия ).[9][10][11] PINK1 - это белок, который обычно транспортируется в митохондрии, но также может накапливаться на поверхности поврежденных митохондрий. Накопленный PINK1 затем набирает Паркин; Паркин инициирует распад дисфункциональных митохондрий, механизм, который действует как «контроль качества».[9] Считается, что при болезни Паркинсона гены, кодирующие PINK1 и Parkin, мутированы, что предотвращает распад поврежденных митохондрий, вызывая аномальную функцию и морфология митохондрий и, в конечном итоге, гибель клеток[9][10] Мутации митохондриальной ДНК (мтДНК) также накапливаются с возрастом.[12] что указывает на то, что восприимчивость к этому механизму гибели нейронов увеличивается с возрастом.
Другой связанный с митохондриями механизм гибели клеток при болезни Паркинсона - это генерация активные формы кислорода (ROS).[12][13] ROS представляют собой высокореактивные молекулы, которые содержат кислород и могут нарушать функции митохондрий и остальной части клетки. С возрастом митохондрии теряют способность удалять АФК, но при этом продолжают производить АФК, что приводит к увеличению чистого производства АФК и, в конечном итоге, к гибели клеток.[12][13]
В обзоре Puspita et al.[14] исследования показали, что в митохондрии и эндоплазматический ретикулум, альфа-синуклеин и дофамин уровни, вероятно, участвуют в содействии окислительный стресс а также симптомы БП. Окислительный стресс по-видимому, играет роль в опосредовании отдельных патологических событий, которые вместе в конечном итоге приводят к гибели клеток при БП.[14] Окислительный стресс, приводящий к гибели клеток, может быть общим знаменателем, лежащим в основе множества процессов. Причины окислительного стресса окислительное повреждение ДНК. Такое повреждение увеличивается в митохондриях черная субстанция пациентов с БП и может привести к гибели нигральных нейрональных клеток.[15][16]
Нейровоспаление
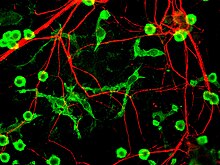
Четвертый предполагаемый основной механизм гибели нейронов при болезни Паркинсона, нейровоспаление, обычно понимается для нейродегенеративных заболеваний, однако конкретные механизмы для БП не полностью описаны.[17] Одним из основных типов клеток, участвующих в нейровоспалении, является микроглия. Микроглия признана клетки врожденного иммунитета из Центральная нервная система. Микроглия активно изучает окружающую среду и значительно изменяет морфологию своих клеток в ответ на нервное повреждение. Острое воспаление в головном мозге обычно характеризуется быстрой активацией микроглии. В этот период периферический иммунный ответ отсутствует. Однако со временем хроническое воспаление вызывает деградацию тканей и гематоэнцефалического барьера. За это время микроглия производит активные формы кислорода и высвобождают сигналы для привлечения периферических иммунных клеток для воспалительного ответа.
Кроме того, микроглия известны два основных состояния: M1, состояние, при котором клетки активируются и секретируют провоспалительный факторы; и M2, состояние, в котором клетки дезактивированы и секретируют противовоспалительное средство факторы.[18] Микроглия обычно находится в состоянии покоя (M2), но при болезни Паркинсона может проникать в M1 из-за наличия агрегатов α-синуклеина. Микроглия M1 выделяет провоспалительные факторы, которые могут вызвать гибель мотонейронов. В этом случае умирающие клетки могут высвобождать факторы, увеличивающие активацию микроглии M1, что приводит к петля положительной обратной связи что вызывает постоянно увеличивающуюся гибель клеток.[17]
BBB разбивка

Пятый предполагаемый основной механизм гибели клеток - это распад гематоэнцефалический барьер (BBB). ГЭБ имеет три типа клеток, которые жестко регулируют поток молекул в мозг и из него: эндотелиальные клетки, перициты, и астроциты. При нейродегенеративных заболеваниях распад ГЭБ был измерен и идентифицирован в определенных областях мозга, включая черная субстанция при болезни Паркинсона и гиппокамп при болезни Альцгеймера.[19] Белковые агрегаты или цитокины от нейровоспаления могут влиять на клеточные рецепторы и изменить их функцию в BBB.[19][20] В частности, фактор роста эндотелия сосудов (VEGF) и Рецепторы VEGF считаются нарушенными регуляции при нейродегенеративных заболеваниях. Взаимодействие между белком VEGF и его рецепторами приводит к пролиферации клеток, но, как полагают, нарушается при болезни Паркинсона и болезни Альцгеймера.[20][21] Затем это приводит к прекращению роста клеток и, следовательно, предотвращает появление новых капилляр формирование через ангиогенез. Нарушение клеточного рецептора также может повлиять на способность клеток прикрепляться друг к другу с помощью прилипает к стыкам.[22]
Без образования новых капилляров существующие капилляры разрушаются, и клетки начинают отделяться друг от друга. Это, в свою очередь, приводит к пробою щелевых контактов.[23][24] Щелевые соединения в эндотелиальных клетках ГЭБ помогают предотвратить попадание больших или вредных молекул в мозг, регулируя поток питательных веществ в мозг. Однако по мере разрушения щелевых контактов белки плазмы могут проникать в внеклеточный матрикс мозг.[23] Этот механизм также известен как проницаемость сосудов, когда дегенерация капилляров приводит к "утечке" крови и белков крови в мозг. Сосудистая проницаемость может в конечном итоге привести к изменению функций нейронов и их сдвигу в сторону апоптотический поведение или гибель клеток.
Влияние на передвижение

Дофаминергические нейроны являются наиболее распространенным типом нейронов в черная субстанция, часть мозга, регулирующая двигательный контроль и обучение. Дофамин это нейротрансмиттер что активирует двигательные нейроны в Центральная нервная система. Затем активированные двигательные нейроны передают свои сигналы через потенциал действия, к мотонейронам в ногах.[25] Однако, когда значительный процент двигательных нейронов умирает (около 50-60%), это снижает уровень дофамина до 80%.[10] Это подавляет способность нейронов генерировать и передавать сигнал. Это торможение передачи в конечном итоге вызывает характерную Паркинсоническая походка с такими симптомами, как сутулость и замедленная ходьба или тремор.
Рекомендации
- ^ Танси MG, Голдберг MS (2010). «Нейровоспаление при болезни Паркинсона: его роль в гибели нейронов и значение для терапевтического вмешательства». Нейробиология болезней. 37 (3): 510–518. Дои:10.1016 / j.nbd.2009.11.004. ЧВК 2823829. PMID 19913097.
- ^ а б Шапира А.Х. (2009). «Этиология и патогенез болезни Паркинсона». Неврологические клиники. 27 (3): 583–603. Дои:10.1016 / j.ncl.2009.04.004.
- ^ Стефанис, Леонид (2012). «α-Синуклеин при болезни Паркинсона». Cold Spring Harb Perspect Med. 4.
- ^ Abugable AA, Morris JL, Palminha NM, Zaksauskaite R, Ray S, El-Khamisy SF (сентябрь 2019 г.). «Ремонт ДНК и неврологические заболевания: от молекулярного понимания до разработки диагностических и модельных организмов». Ремонт ДНК (Amst). 81: 102669. Дои:10.1016 / j.dnarep.2019.102669. PMID 31331820.
- ^ а б Schaser AJ, Osterberg VR, Dent SE, Stackhouse TL, Wakeham CM, Boutros SW, Weston LJ, Owen N, Weissman TA, Luna E, Raber J, Luk KC, McCullough AK, Woltjer RL, Unni VK (июль 2019 г.). «Альфа-синуклеин представляет собой ДНК-связывающий белок, который модулирует восстановление ДНК с последствиями для расстройств с тельцами Леви». Sci. Представитель. 9 (1): 10919. Дои:10.1038 / s41598-019-47227-z. ЧВК 6662836. PMID 31358782.
- ^ а б Стерн С.Т., Джонсон Д.Н. (2008). «Роль взаимодействия наноматериалов и аутофагии в нейродегенеративных заболеваниях». Аутофагия. 4 (8): 1097–1100. Дои:10.4161 / авто.7142.
- ^ Гавами С., Соджаи С., Еганех Б., Анд С.Р., Джангамредди Дж.Р., Мехрпур М., Ос М.Дж. (2014). «Дисфункция аутофагии и апоптоза при нейродегенеративных расстройствах». Прогресс в нейробиологии. 112: 24–49. Дои:10.1016 / j.pneurobio.2013.10.004.
- ^ Ху З, Ян Б., Мо Х, Сяо Х (2014). «Механизм и регуляция аутофагии и ее роль в нервных заболеваниях». Молекулярная нейробиология. 52 (3): 1190–1209. Дои:10.1007 / s12035-014-8921-4.
- ^ а б c d Чен Х, Чан, округ Колумбия (2009). «Митохондриальная динамика - слияние, деление, движение и митофагия - при нейродегенеративных заболеваниях». Молекулярная генетика человека. 18: R169 – R176. Дои:10.1093 / hmg / ddp326.
- ^ а б c d Пикрелл А., Юле Р. (2015). «Роль PINK1, Паркина и верности митохондрий в болезни Паркинсона». Нейрон. 85 (2): 257–273. Дои:10.1016 / j.neuron.2014.12.007.
- ^ Нарендра Д., Танака А., Суен Д., Юле Р. Дж. (2008). «Паркин избирательно задействуется в поврежденных митохондриях и способствует их аутофагии». Журнал клеточной биологии. 183 (5): 795–803. Дои:10.1083 / jcb.200809125.
- ^ а б c Линь MT, Бил MF (2006). «Дисфункция митохондрий и оксидативный стресс при нейродегенеративных заболеваниях». Природа. 443 (7113): 787–795. Дои:10.1038 / природа05292. PMID 17051205.
- ^ а б Джомова К., Вондракова Д., Лоусон М., Валко М. (2010). «Металлы, оксидативный стресс и нейродегенеративные расстройства». Mol Cell Biochem. 345 (1–2): 91–104. Дои:10.1007 / s11010-010-0563-х.
- ^ а б Пушита Л., Чунг С.Ю., Шим Дж.В. (ноябрь 2017 г.). «Окислительный стресс и клеточные патологии при болезни Паркинсона». Мол мозг. 10 (1): 53. Дои:10.1186 / s13041-017-0340-9. ЧВК 5706368. PMID 29183391.
- ^ Шимура-Миура Х., Хаттори Н., Кан Д., Мияко К., Накабеппу Й., Мизуно Й. (декабрь 1999 г.). «Увеличение 8-оксо-dGTPase в митохондриях нейронов черного вещества при болезни Паркинсона». Анна. Neurol. 46 (6): 920–4. PMID 10589547.
- ^ Накабеппу Ю., Цучимото Д., Ямагути Х., Сакуми К. (апрель 2007 г.). «Окислительное повреждение нуклеиновых кислот и болезнь Паркинсона». J. Neurosci. Res. 85 (5): 919–34. Дои:10.1002 / jnr.21191. HDL:2324/8296. PMID 17279544.
- ^ а б Glass CK, Saijo K, Победитель B, Marchetto MC, Gage FH (2010). «Механизмы, лежащие в основе воспаления при нейродегенерации». Клетка. 140 (6): 918–934. Дои:10.1016 / j.cell.2010.02.016. ЧВК 2873093. PMID 20303880.
- ^ Злокович Б.В. (2008). «Гематоэнцефалический барьер в здоровье и хронических нейродегенеративных заболеваниях». Нейрон. 57 (2): 178–201. Дои:10.1016 / j.neuron.2008.01.003.
- ^ а б Злокович Б.В. (2011). «Нейроваскулярные пути к нейродегенерации при болезни Альцгеймера и других расстройствах». Nat Rev Neurosci. 12: 723–738. Дои:10.1038 / nrn3114. ЧВК 4036520. PMID 22048062.
- ^ а б Хао Т., Роквелл П. (2013). «Передача сигналов через рецептор фактора роста эндотелия сосудов VEGFR-2 защищает нейроны гиппокампа от митохондриальной дисфункции и окислительного стресса». Свободная радикальная биология и медицина. 63: 421–431. Дои:10.1016 / j.freeradbiomed.2013.05.036. ЧВК 3756493. PMID 23732519.
- ^ Альмодовар CR, Lambrechts D, Mazzone M, Carmeliet P (2009). «Роль и терапевтический потенциал VEGF в нервной системе». Физиологические обзоры. 89 (2): 607–648. Дои:10.1152 / Physrev.00031.2008.
- ^ Förster C, Burek M, Romero IA, Weksler B, Couraud P, Drenckhahn D (2008). «Дифференциальные эффекты гидрокортизона и TNFα на белки плотного соединения в модели гематоэнцефалического барьера человека in vitro». Журнал физиологии. 586 (7): 1937–1949. Дои:10.1113 / jphysiol.2007.146852. ЧВК 2375735. PMID 18258663.
- ^ а б Нагасава К., Чиба Х, Фудзита Х, Кодзима Т, Сайто Т, Эндо Т, Савада Н. (2006). «Возможное участие щелевых контактов в барьерной функции плотных контактов эндотелиальных клеток головного мозга и легких». Журнал клеточной физиологии. 208 (1): 123–132. Дои:10.1002 / jcp.20647.
- ^ Marambaud P, Dreses-Werringloer U, Vingtdeux V (2009). «Передача сигналов кальция при нейродегенерации». Мол нейродегенерация. 4 (1): 20. Дои:10.1186/1750-1326-4-20.
- ^ Барнетт М.В., Ларкман П.М., Ларкман (2007). «Потенциал действия». Прак Neurol. 7 (3): 192–7. PMID 17515599.
